MCM7和CDC6蛋白表達與肝細胞癌病理特征的相關性*
牛廣旭,賈如江,宋曉明,鄭神英,王朝輝
(1.邯鄲市中心醫院 病理科,056001; 2.邯鄲市中心醫院 普外一科,056001)
原發性肝癌以原發性肝細胞癌為主,多表現出肝區疼痛及乏力、消瘦、消化道癥狀等,但缺乏特異性表現,發現時多為中晚期[1]。原發性肝細胞癌的發病可能與飲酒、黃曲霉素、遺傳、肝硬化或病毒性肝炎有關,手術為其常用治療手段,但療效不甚理想[2-3]。隨分子腫瘤學研究的深入,探究疾病發生的分子機制可為肝細胞癌診斷及靶向治療提供更多參考[4]。微染色體維持蛋白7(minichro-mosome maintenance protein7,MCM7)在甲狀腺癌等癌癥中表達較高[5],細胞分裂周期蛋白6(cell division cyclin 6,CDC6)則在結直腸癌中表達較高[6]。肝細胞癌基因通路復雜,為揭示MCM7、CDC6在其中的影響,本研究分別對原發性肝細胞癌患者癌組織及癌旁組織(與癌組織距離>5 cm)內MCM7、CDC6表達加以觀察,分析這兩項指標在原發性肝細胞癌診斷及預后預測中的應用價值,為原發性肝細胞癌的診治及生存預測提供參考依據,現報告如下。
1 對象與方法
1.1 研究對象
選取2017年1月—2019年1月收治的68例原發性肝細胞癌患者,所有患者均行手術治療。68例患者中男45例、女23例,年齡40~69歲、平均(55.13±2.88)歲,腫瘤直徑<5 cm 20例、≥5 cm 48例,腫瘤淋巴結轉移(tumor node metastasis,TNM)分期Ⅰ~Ⅱ期41例、Ⅲ~Ⅳ期27例,分化程度低分化39例、中高分化29例,乙肝表面抗原(hepatits B surface antigen,HBsAg)陽性52例、陰性16例,血清甲胎蛋白(alpha fetoprotein,AFP)<400 μg/L 24例、≥400 μg/L 44例,衛星結節35例。納入標準:(1)患者入院后均診斷為原發性肝細胞癌[7],術后經病理學檢查證實;(2)均行常規手術治療;(3)均為首次診治,且術前未接受過放化療治療;(4)病歷資料完整;(5)患者均自愿參與本研究,并簽署知情同意書。排除標準:(1)預計存活時間≤3個月;(2)圍術期死亡;(3)隨訪失訪;(4)合并其他惡性腫瘤;(5)重要臟器損傷;(6)合并急慢性感染。
1.2 研究方法
1.2.1MCM7及CDC6檢測 68例患者根治性手術治療后迅速多點取材,分別取癌組織、癌旁組織各2塊,多聚甲醛固定、石蠟包埋處理,將標本切成3~4 μm厚切片后脫蠟至水,免疫組織化學染色方法(immunohistochemical sp method,SP)染色,以磷酸鹽緩沖液(phosphate buffer solution,PBS)代替一抗作為陰性對照,MCM7抗體購自Neomarker公司,CDC6購自美國Abcam公司,SP試劑盒、DBA試劑盒均購自北京中杉金橋生物技術公司。
1.2.2MCM7及CDC6判定標準 依據細胞染色程度與陽性細胞占比評分的乘積判定[8],陽性細胞染色程度:不著色記0分,淡黃色記1分,棕黃色記2分,棕褐色記3分。(1)MCM7陽性細胞比例評分為≥10%即記為陽性,計2分,<10%為陰性,計1分;染色陽性采用染色強度分數與陽性細胞比例分數的乘積[(染色程度評分+陽性細胞比例評分)/2]表示,>2分為陽性。(2)CDC6陽性細胞占比評分分別給予0分(<5%),1分(5%~25%),2分(26%~50%),3分(51%~75%),4分(>75%),兩項評分之積≥3分為CDC6高表達,<3分為CDC6低表達。
1.3 觀察指標
比較癌組織及癌旁組織中MCM7陽性檢出率及CDC6高表達占比;分析不同臨床病理特征的肝細胞癌患者MCM7陽性占比及CDC6高表達占比,并采取多因素logistics回歸分析MCM7陽性、CDC6高表達的危險因素;3年院外隨訪,記錄癌組織MCM7陽性及CDC6高表達患者術后3年存活率。
1.4 統計學分析

2 結果
2.1 癌組織及癌旁組織內MCM7陽性檢出率及CDC6高表達占比
MCM7及CDC6陽性均主要定位于細胞質或細胞核(圖1),癌組織內MCM7陽性檢出率及CDC6高表達占比高于癌旁組織,差異有統計學意義(P<0.05)。見表1。

表1 癌組織及癌旁組織內MCM7陽性檢出率及CDC6高表達占比[n(%)]
2.2 不同臨床病理特征肝細胞癌患者MCM7陽性檢出率及CDC6高表達占比
結果顯示,不同性別、年齡及HBsAg陽性患者的MCM7陽性檢出率及CDC6高表達占比差異無統計學意義(P>0.05);腫瘤直徑≥5 cm、TNM分期Ⅲ~Ⅳ期、分化程度低分化、血清AFP≥400 μg/L、有衛星結節患者的MCM7陽性檢出率及CDC6高表達占比較高,差異有統計學意義(P<0.05)。見表2。
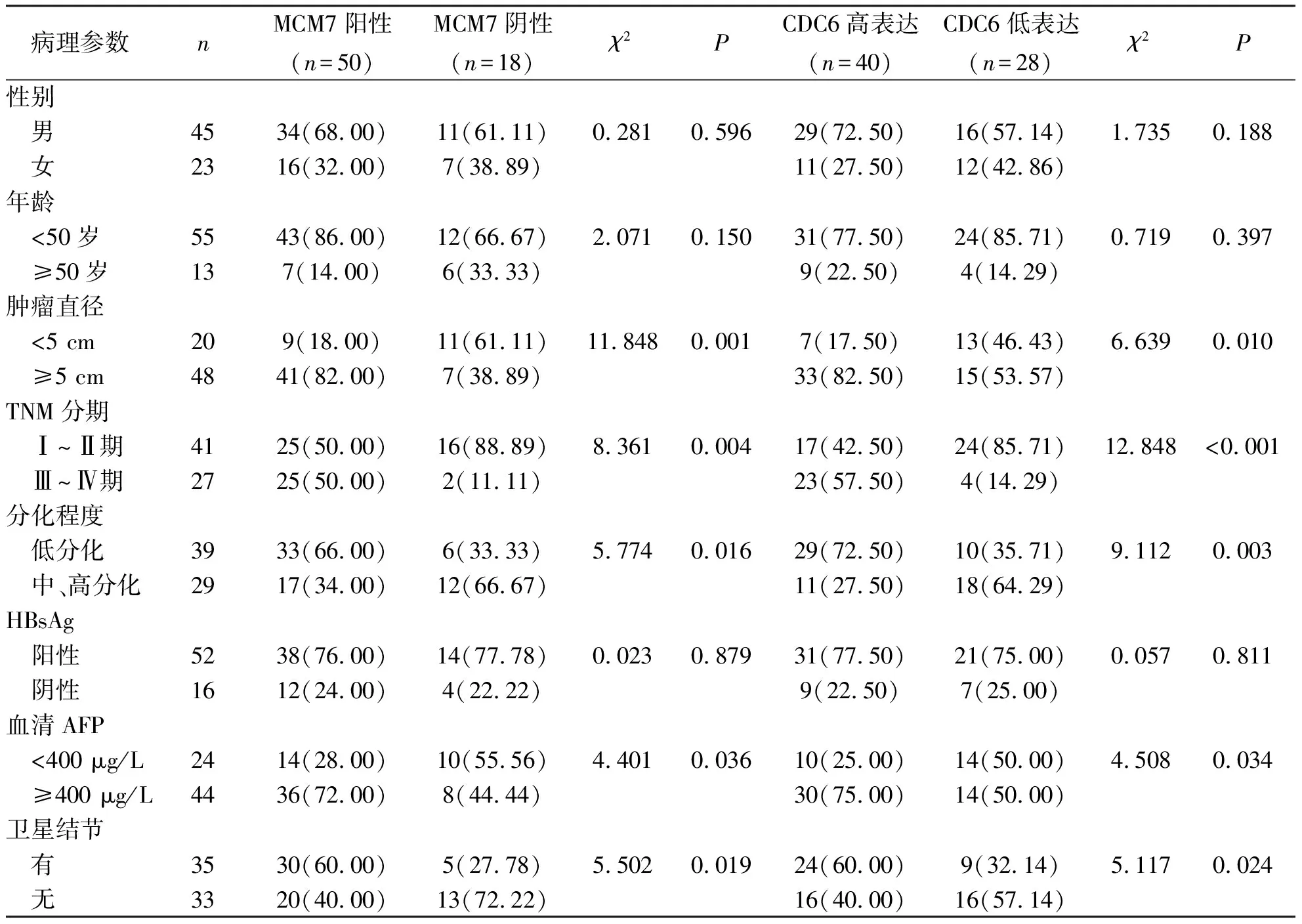
表2 不同臨床病理特征肝細胞癌患者MCM7陽性檢出率及CDC6高表達占比[n(%)]
2.3 MCM7陽性、CDC6高表達的多因素logistics回歸分析
將臨床病理特征存在差異的項目行量化賦值,腫瘤直徑≥5 cm為1分,<5 cm為0分;TNM分期Ⅲ-Ⅳ期為1分,Ⅰ~Ⅱ期為0分;分化程度低分化為1分,中、高分化為0分;HBsAg陽性為1分,陰性為0分;血清AFP≥400 μg/L為1分,<400 μg/L為0分;有衛星結節為1分,無為0分。結果顯示腫瘤直徑≥5 cm、TNM分期Ⅲ~Ⅳ期、低分化、HBsAg陽性、血清AFP≥400 μg/L、有衛星結節是MCM7陽性、CDC6高表達的危險因素(P<0.05)。見表3。

表3 MCM7陽性、CDC6高表達的多因素logistics回歸分析
2.4 癌組織MCM7陽性、CDC6高表達肝細胞癌患者術后3年存活率
68例行根治性手術的肝細胞癌患者均獲得3年院外隨訪,3年死亡率38.24%(26/68),存活率61.76%(42/68);50例癌組織MCM7陽性患者中死亡率44.00%(22/50)、存活率56.00%(28/50),18例癌組織MCM7陰性患者中死亡率22.22%(4/18)、存活率83.05%(14/18),Kaplan-Meier生存分析顯示癌組織MCM7陽性檢出率越高患者存活率越低(Log-Rank=15.025,P<0.05);40例癌組織CDC6高表達患者中死亡率50.00%(20/40)、存活率50.00%(20/40),28例癌組織CDC6低表達患者中死亡率21.43%(6/28)、存活率78.57%(22/28),Kaplan-Meier生存分析顯示癌組織CDC6表達越高患者存活率越低(Log-Rank=8.890,P<0.05)。
3 討論
肝細胞癌及其他癌癥的發病均與分子機制調控及基因有關,深入研究影響該病發生、發展的分子機制對提高療效、改善預后有重要意義[9-10]。MCM為蛋白家族,其中MCM7復合物與真核細胞復制有關,MCM7在與DNA復制起始點結合后,染色質開始復制,且MCM7二聚體復合體具有解螺旋酶活性與ATP水解活性,可雙鏈DNA解鏈[11-12]。王東星等[13]可證實MCM7對肝細胞癌的作用。細胞周期紊亂直接關系到腫瘤的發生,CDC6為ATP結合蛋白和復制前復合體一份子,具有ATP酶活性,多定位于人體17q21.3染色體[14-15],同樣在起始DNA復制中有重要地位,還通過抑制CDK1蛋白活性而參與細胞的惡性轉化,誘導腫瘤細胞增殖,連旭等[16]也佐證了這一點。癌細胞通過糖酵解獲取能量,ATP則伴隨糖酵解產生[17-19]。
本研究結果顯示癌組織內MCM7陽性檢出率及CDC6高表達占比高于癌旁組織,提示肝細胞癌患者癌組織內MCM7、CDC6呈現高表達。腫瘤直徑、TNM分期、分化程度、血清AFP水平及衛星結節均為評估肝細胞癌病情及預后的參照。賈清馨等[20]發現腫瘤執行與肝細胞癌術后生存率直接關聯;AFP被視為肝細胞癌的特異性血清標志物,如萬波等[21]也發現肝癌復發患者血清AFP水平顯著高于未復發組,且AFP高水平患者3年無瘤生存率顯著較低,預后不佳;微血管侵犯與肝癌復發、轉移關系密切,而衛星結節不僅與微血管侵犯檢出率有關,更與肝癌總生存率有關,丁凌等[22]研究也針對這一點進行了論證。本研究顯示腫瘤直徑≥5 cm、TNM分期Ⅲ-Ⅳ期、分化程度低分化、血清AFP≥400 μg/L、有衛星結節患者的MCM7陽性檢出率及CDC6高表達占比較高,并顯示腫瘤直徑≥5 cm、TNM分期Ⅲ-Ⅳ期、低分化、HBsAg陽性、血清AFP≥400、有衛星結節是MCM7陽性、CDC6高表達的危險因素,提示MCM7、CDC6不僅參與肝細胞癌的發病,還與病情進展有關,可能是肝細胞癌發展的關鍵靶點。牛廣旭等[23]也表明MCM7陽性檢出率會隨病情嚴重程度加深而升高。
最后,通過對68例肝細胞癌患者3年院外隨訪結果的觀察,發現肝細胞癌患者3年死亡率為38.24%,存活率為61.76%,50例癌組織MCM7陽性患者死亡率44.00%,存活率56.00%,18例癌組織MCM7陰性患者中死亡率22.22%,存活率83.05%;40例癌組織CDC6高表達患者中死亡率50.00%,存活率50.00%,Kaplan-Meier生存分析顯示癌組織MCM7陽性檢出率越高、CDC6表達越高患者存活率越低。提示癌組織MCM7陽性及CDC6高表達均會影響肝細胞癌患者生存質量。
綜上所述,本研究發現原發性肝細胞癌患者癌組織內MCM7和CDC6與疾病的進展有關,且癌組織MCM7陽性及CDC6高表達均會影響肝細胞癌患者存活率。在肝細胞癌的后續診斷及治療中,或可將MCM7及CDC6作為分子靶向治療新思路,或根據患者MCM7及CDC6表達建立相應預后評估模型,對患者存活率加以預測[24-25]。本研究僅對MCM7及CDC6與肝細胞癌患者生存質量的獨立影響加以觀察,但能否將MCM7及CDC6聯合應用進行肝細胞癌患者的預后預測尚不清楚,且對MCM7、CDC6與血清AFP的關系尚不明確,仍需多中心的深入研究。

