NAC通過調控活性氧影響脂肪間充質干細胞增殖和分化
劉裴裴,丁世杰,宋文娟,唐長波,李惠俠,唐紅
NAC通過調控活性氧影響脂肪間充質干細胞增殖和分化

1南京農業大學動物科技學院,南京 210095;2新疆農墾科學院畜牧獸醫研究所/省部共建綿羊遺傳改良與健康養殖國家重點實驗室,新疆石河子 832000
【目的】細胞在體外培養過程中易受氧化應激,細胞內活性氧水平升高,影響細胞功能。通過探究N-乙酰-L半胱氨酸(N-Acetyl-L-cysteine, NAC)對豬脂肪間充質干細胞(adipose-derived mesenchymal stem cells, ADSCs)活性氧的調控作用,進一步明確對其增殖和分化的影響,為培養脂肪種子細胞體外大量擴增和提高分化效率提供理論基礎和參考依據。【方法】為建立ADSCs體外培養氧化應激模型,在ADSCs增殖過程中加入不同濃度的H2O2(0、25、50、100 μmol·L-1),通過細胞計數結果、細胞形態、細胞活力、高通量高內涵活細胞共聚焦成像系統檢測細胞內活性氧水平,確定H2O2的添加濃度。為了篩選NAC促進ADSCs增殖的最佳添加濃度,在ADSCs增殖過程中加入不同濃度的NAC (0、1、2、3 mmol·L-1),通過細胞計數結果和細胞形態,確定NAC的適宜添加濃度。通過EdU染色和細胞計數分析不同處理條件下(Control、1 mmol·L-1NAC、50 μmol·L-1H2O2、1 mmol·L-1NAC + 50 μmol·L-1H2O2)的細胞增殖情況,為進一步探究NAC對氧化應激的ADSCs增殖的影響。為探究不同處理條件下ADSCs內活性氧的水平,對不同處理條件下增殖3 d后的ADSCs進行CellRox染色,通過高通量高內涵活細胞共聚焦成像系統檢測細胞內活性氧水平,明確ADSCs增殖與細胞內活性氧水平的關系。為探究ADSCs內活性氧水平對其分化的影響,ADSCs在不同處理條件下分化10 d,對其進行油紅O染色,Image J分析染色面積評估ADSCs的分化脂質積累量并通過RT-qPCR檢測ADSCs分化相關基因的相對表達量。【結果】ADSCs在增殖過程中,與對照組相比較,添加50 μmol·L-1H2O2組的ADSCs呈梭形,細胞內活性氧含量顯著升高(<0.05),氧化應激模型成功建立。與對照組相比,ADSCs在增殖過程中添加50 μmol·L-1H2O2,ADSCs增殖數目顯著降低(<0.05),但是在ADSCs分化過程中添加50 μmol·L-1H2O2,ADSCs的脂質積累量顯著升高(<0.05)。ADSCs在增殖過程中,與對照組相比較,添加1 mmol·L-1NAC組的ADSCs呈梭形,細胞內活性氧含量顯著降低(<0.05),ADSCs增殖數目顯著升高(<0.05),但是1 mmol·L-1NAC的添加對ADSCs的脂質積累沒有顯著影響(>0.05)。【結論】氧化應激的產生提高ADSCs中活性氧水平,不利于ADSCs體外大量擴增,誘導細胞分化,加速細胞衰老。在ADSCs體外擴增體系中添加1 mmol·L-1NAC可以降低因長期培養、外源刺激等因素帶來的氧化應激損傷,對氧化應激的ADSCs具有保護作用,能有效促進細胞的增殖,并且不會影響細胞的分化能力。
NAC;ADSCs;活性氧;增殖;分化;培養脂肪
0 引言
【研究意義】隨著人類生活水平的提高,對肉制品的需求量逐漸升高,根據聯合國糧食和農業組織報告,預計到2025年,肉類產量將增加16%。為緩解畜牧業的生產壓力,因此,需要尋找一種更綠色的技術來生產肉類[1]。培養肉技術作為一項高效、環保、可持續的新型肉類生產的方式,是近年來興起的一項顛覆性肉類生產技術,逐漸成為研究熱點。目前,培養肉的研究主要集中在肌肉組織的生產,作為肉制品中不可缺少的脂肪組織,也是培養肉生產的重點,ADSCs具有易分離且易向成熟脂肪分化的特點,在培養脂肪的生產中具有一定的生產潛力[2]。但是,ADSCs隨著培養時間的增加,其增殖和分化能力會明顯下降,從而影響培養脂肪的生產效率,因此,種子細胞在體外培養過程中具備優良增殖和分化能力是生產培養脂肪的關鍵。【前人研究進展】ADSCs從脂肪組織中分離,在體外培養過程中,其功能易受氧化應激的影響,有研究表明,干細胞增殖與分化的過程受信號轉導、氧化還原狀態及培養環境等因素的影響,其中氧化還原狀態對干細胞增殖及分化的影響尤為重要[3]。活性氧水平在一定程度上可以表示細胞內氧化還原狀態。已有研究證明,較低的活性氧使得細胞增殖能力增強,而過量的活性氧可能導致線粒體功能障礙和組織炎癥等問題[4]。Eto 等[5]研究表明ADSCs對活性氧的濃度非常敏感,過量的活性氧會使得細胞周期停滯,從而抑制細胞增殖,并作為信號分子誘導脂肪細胞的分化和衰老。Turker等[6]研究發現,較高劑量的H2O2(10 μmol·L-1)可促進3T3-L1小鼠前脂肪細胞向成熟脂肪分化。NAC是一種膳食補充劑,具有直接清除自由基的作用,能促進谷胱甘肽的合成,谷胱甘肽是細胞對抗氧化應激損傷的主要力量[7]。有研究表明,NAC可以通過降低細胞內活性氧的含量,從而調節多種不同種類細胞的增殖、分化及凋亡[8]。【本研究切入點】肌肉干細胞和ADSCs是兩種最主要的培養肉用種子細胞,實驗室前期探究了不同抗氧化劑對肌肉干細胞增殖分化的影響:如DING等[9]發現在細胞體外培養過程中添加P38抑制劑可促進牛肌肉干細胞的增殖并提高干性基因的表達;胡榮蓉等[10]發現,水溶性維生素E的類似物(Trolox)通過調節豬肌肉干細胞中活性氧的含量,促進豬肌肉干細胞增殖。脂肪組織是肉的重要組成部分,ADSCs在培養脂肪生產中也具有很大潛力,而抗氧化劑NAC在培養肉用ADSCs體外擴增及分化方面的作用尚不清楚。【擬解決的關鍵問題】ADSCs在體外培養過程中,受氧化應激的影響,細胞內活性氧的含量升高,影響ADSCs在體外的擴大培養,本研究通過添加抗氧化劑NAC,探究其對ADSCs內活性氧水平的影響,進一步研究細胞內活性氧水平對ADSCs增殖和分化的影響,為培養脂肪種子細胞規模化生產提供數據支撐和理論依據。
1 材料與方法
試驗于2021年在南京農業大學國家肉品質量安全控制工程技術研究中心進行。
1.1 試驗動物及試劑
3日齡幼豬,由蘇食集團生豬養殖基地提供。胎牛血清(fetal bovine serum, FBS)、DMEMF/12培養基、重組人成纖維細胞生長因子(basic fibroblast growth factor,bFGF)、磷酸鹽酸緩沖溶液(phosphate buffer saline, PBS),購于美國GIBCO公司;100×青霉素鏈霉素雙抗(penicillin-streptomycin, P.S.)、0.25%胰酶,購于上海貝博生物公司;CellRox ? Deep Red試劑,Trizol總RNA提取試劑,購于英濰捷基(上海)貿易有限公司;NAC、地塞米松(dexamethasone, DEX)、羅格列酮(rosiglitazone, Rosi)、3-異丁基-1-甲基黃嘌呤(3-isobutyl-1-methylxanthine, IBMX)、胰島素(insulin, INS)、吲哚美辛(indomethacin, IND),購于美國Abmole公司;分析純30% H2O2,購于上海國藥集團化學試劑有限公司;細胞總RNA提取試劑盒,購于天根生化科技(北京)有限公司;TB GreenTMPremix Ex TaqTMII、PrimeScript? RT Master Mix Perfect Real Time,均購于日本Takara公司;EdU染色試劑盒,購于上海碧云天生物技術有限公司。用于檢測脂肪細胞分化相關基因表達的實時熒光定量PCR(real-time fluorescent quantitative PCR, RT-qPCR)引物(序列見表1)均合成于南京金斯瑞生物科技有限公司。
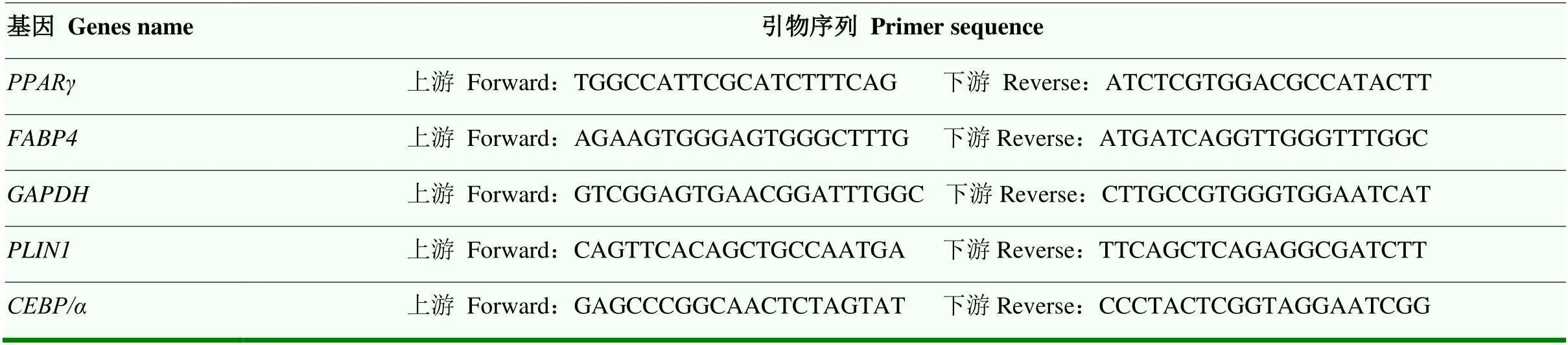
表1 RT-qPCR所用引物序列
1.2 試驗方法
1.2.1 豬ADSCs的培養 豬ADSCs的分離方法,參照李惠俠等[11]的分離方法。將原代ADSCs按照1.5×105個細胞的密度將細胞接種到直徑為10 cm培養皿中,用含有bFGF的完全培養基(DMEMF/12 + 10% FBS + 1% P.S.)在37℃、5% CO2的培養箱中培養細胞,生長因子與培養基的添加比例為1﹕2000,細胞增殖3 d,進行細胞傳代。
1.2.2 豬ADSCs的分化 將原代ADSCs按照4×104個細胞的密度將細胞接種在24孔板中,細胞融合度達到85%—95%時,加入誘導分化培養基(完全培養基 + 1 μmol·L-1DEX + 10 μg·mL-1INS + 0.1 mmol·L-1IND + 2 μmol·L-1Rosi + 0.1 mmol·L-1IBMX)進行誘導分化,5 d后換為維持分化培養基(完全培養基+ 10 μg·mL-1INS),維持分化2 d后,換為完全培養基,分化到第10 天,收樣檢測,在分化過程中,進行NAC和H2O2的處理。
1.2.3 氧化應激模型的建立 用H2O2處理細胞建立氧化應激模型,設置濃度梯度,分別為0、25、50、100 μmol·L-1,在37 ℃、5% CO2的培養箱中培養細胞3 d,進行細胞計數、細胞活力、細胞內活性氧含量的測定,根據分析結果及顯微鏡下細胞狀態,確定H2O2的添加濃度。
1.2.4 EdU染色 將原代ADSCs以2×104/mL接種到3.5 cm培養皿中,ADSCs經過不同的處理后,在37 ℃、5% CO2的培養箱中培養3 d,按照細胞增殖檢測試劑盒的操作技術說明書進行染色,在激光共聚焦顯微鏡下觀察并采集圖像,并進行EdU染色陽性細胞占比分析。
1.2.5 細胞計數 將原代ADSCs以1.5×105/mL接種到10 cm培養皿中,ADSCs經過不同的處理后,在37 ℃、5% CO2的培養箱中培養3 d,PBS清洗1遍,0.25%的胰酶消化,收集細胞后使用血細胞計數板進行細胞計數。
1.2.6 細胞內活性氧含量的測定 將細胞以1×104個/mL接到96孔板中,培養3 d,更換添加含有 CellRox Deep Red和Hoechst試劑的新鮮培養基,CellRox Deep Red試劑與培養基的配制比為1﹕500,Hoechst試劑與培養基的配制比為1﹕1000,將細胞放置在37 ℃、5%CO2的培養箱中孵育30 min,PBS清洗3次,添加不同處理的100 μL新鮮培養基覆蓋細胞,在活細胞狀態下通過高通量高內涵活細胞共聚焦成像系統采集圖像。
1.2.7 油紅O染色、異丙醇萃取、Image J分析 油紅O染色方法及提取法用來檢測細胞中甘油三酯的含量。參考脂肪細胞油紅O染色方法[11]。在每個視野下根據五點法,選取5張圖片,利用Image J軟件進行油紅O染色面積的檢測。
1.2.8 RT-qPCR 收集不同試驗組分化第10 天的細胞,加入Trizol試劑裂解細胞;按照RNA提取試劑盒說明書提取細胞總RNA,微量分光光度計測定總RNA濃度;按照反轉錄試劑盒說明書將RNA反轉成cDNA,并按照RT-qPCR的說明書,使用2-ΔΔCT的方法計算目的基因在不同cDNA模板中的相對表達量,以作為內參基因。
1.3 統計分析
本研究中試驗數據用平均值±標準誤(Mean ± SEM)表示,統計學差異由SPSS 20軟件評估,在Duncan事后檢驗下,采用單因素方差分析(One-way ANOVA)和檢驗進行數據分析。每個處理組設置3個生物學重復(n = 3),其中*代表差異顯著(<0.05),**代表差異極顯著(<0.01),***代表差異極顯著(<0.001)。圖由GraphPad Prism 8繪制。
2 結果
2.1 氧化應激模型的建立
高濃度H2O2短時間處理細胞是構建氧化應激模型常見的方法,本研究篩選構建氧化應激模型的適宜添加濃度標準為在確保細胞中活性氧水平顯著升高,抑制細胞增殖但不會破壞細胞形態的條件下,選擇盡可能高濃度的H2O2,篩選出的此濃度將應用到探究氧化應激的細胞中活性氧水平升高對ADSCs分化的影響研究中,因為在分化過程中需要全程添加H2O2,所以本研究構建氧化應激模型采用低濃度緩慢應激的方式。設置H2O2的濃度為0、25、50、100 μmol·L-1處理細胞3 d。細胞增殖3 d后,在顯微鏡下觀察到細胞的形態隨著H2O2濃度的升高變得細長,H2O2的添加濃度在25、50 μmol·L-1時視野中未見過多的死細胞,細胞形態正常,呈梭形,與從豬皮下脂肪組織中分離得到的細胞形態一致[12]。而H2O2的添加濃度在100 μmol·L-1時,顯微鏡下可觀察到較多的死細胞,細胞形態不正常,呈長條狀(圖1-A—D)。細胞計數結果表明,細胞增殖3 d后,H2O2的添加濃度為25、50、100 μmol·L-1時,較對照組相比,細胞增殖倍數為0.6倍、0.4倍、0.2倍(圖1-E),隨著H2O2添加濃度的升高,細胞數目顯著降低(<0.05)(圖1-F)。本研究通過EdU染色檢測不同濃度H2O2處理下的細胞活力,結果顯示,未添加H2O2的組(Control)中EdU陽性細胞占比為32%,細胞經過25、50、100 μmol·L-1處理后,EdU陽性細胞占比分別為23%、17%、5%,細胞經過25 μmol·L-1處理后,細胞活力與Control組無顯著性差異(>0.05),細胞經過50、100 μmol·L-1H2O2處理后,細胞活力較Control組顯著降低(<0.05)(圖1-G—K),細胞經過100 μmol·L-1H2O2處理后,活細胞數量少,細胞活力差,無法在細胞分化過程中全程添加。結合顯微鏡下細胞形態、細胞活力及細胞計數結果,選擇H2O2的添加濃度為50 μmol·L-1。
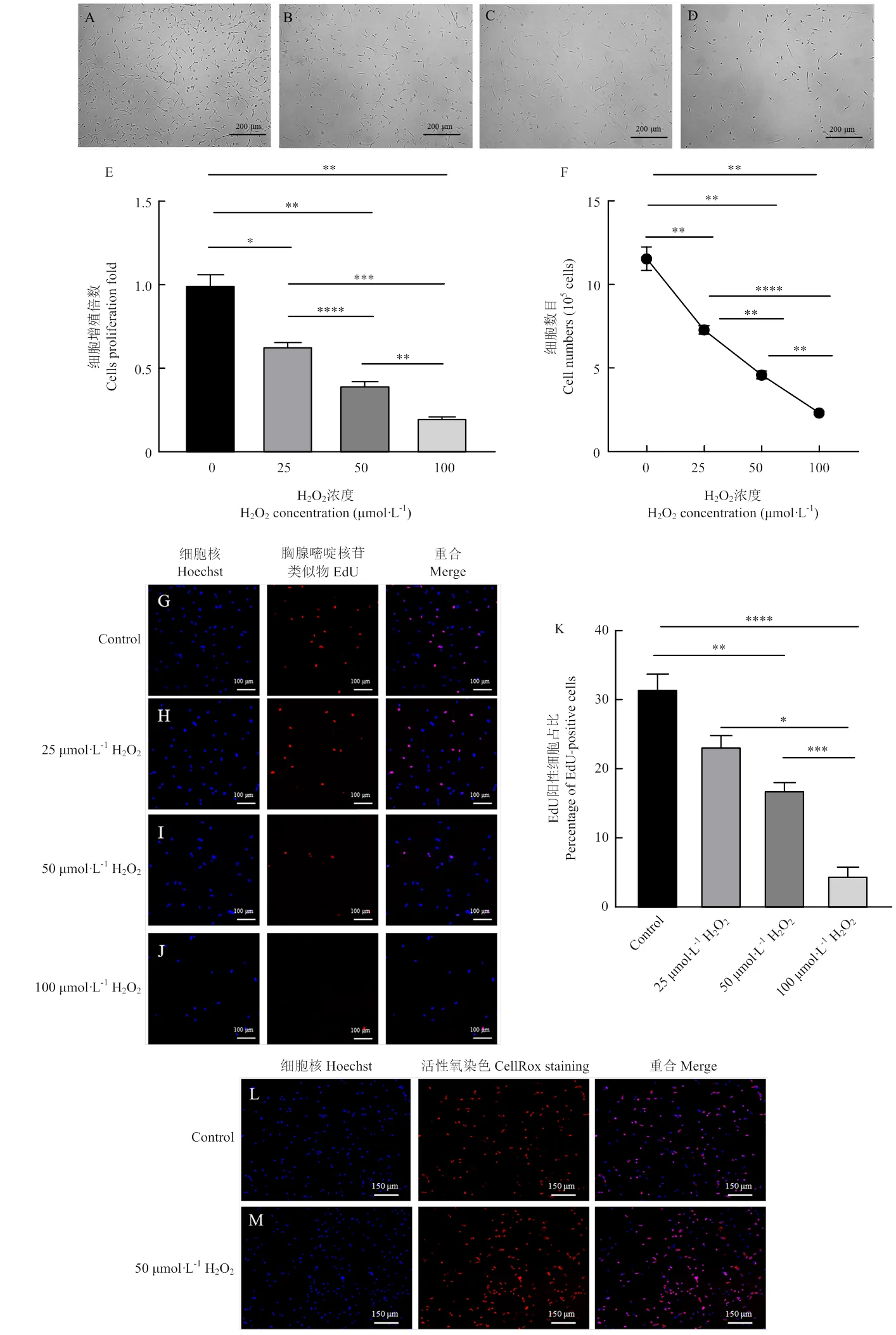
A-D. 細胞培養基中添加0、25、50、100 μmol·L-1H2O2時細胞的明場圖;E. 添加不同濃度H2O2時細胞增殖倍數;F.添加不同濃度H2O2時細胞計數;G-J. 添加不同濃度H2O2時細胞EdU染色圖;K. 添加不同濃度H2O2時細胞EdU染色陽性細胞百分比;L-M. 對照組與50 μmol·L-1H2O2添加組中細胞CellRox染色;N. 單位面積CellRox平均熒光強度;O. CellRox染色面積;P. CellRox總熒光強度
A-D. Bright field images of cells when 0, 25, 50, and 100 μmol·L-1H2O2were added to the cell culture medium. E. Cell proliferation folds when different concentrations of H2O2were added. F. Cell count when different concentrations of H2O2were added. G-J. EdU staining graph of cells when different concentrations of H2O2were added. K. Percentage of cells positive for EdU staining when different concentrations of H2O2were added. L-M. CellRox staining in the control and 50 μmol·L-1H2O2addition group. N. CellRox: cell average intensity. O. All CellRox mean stain area. P. All CellRox stain integrated intensities
圖1 構建氧化應激細胞模型
Fig. 1 Construction of an oxidative stress model of cells
為進一步確定,50 μmol·L-1H2O2添加時,ADSCs中活性氧水平是否顯著高于對照組,是否可以構建氧化應激模型。本研究通過CellRox熒光染料對細胞內活性氧染色,通過高通量高內涵活細胞共聚焦成像系統檢測對照組和50 μmol·L-1H2O2添加組中ADSCs內活性氧水平,結果表明,可以觀察到CellRox染色的陽性細胞(圖1-L、M),進一步進行CellRox染色定量分析,50 μmol·L-1H2O2添加組中ADSCs中單位面積CellRox平均熒光強度(圖1-N)、CellRox染色面積(圖1-O)、CellRox總熒光強度(圖1-P)顯著高于對照組(<0.05),以上結果表明,50 μmol·L-1H2O2添加組中ADSCs中活性氧水平顯著升高,成功構建氧化應激模型。
2.2 NAC適宜添加濃度的篩選
為篩選NAC促進ADSCs增殖最佳效果的添加濃度,用不同濃度梯度的NAC(0、1、2、3 mmol·L-1)處理細胞3 d。細胞增殖3 d后,通過顯微鏡觀察細胞形態(圖2-A—D),通過細胞計數對細胞的增殖數量(圖2-E)和增殖倍數(圖2-F)進行統計分析,結果表明,NAC的添加濃度為1、2、3 mmol·L-1時,與對照組相比,細胞數目分別為對照組的1.4倍、1倍、0.8倍,1 mmol·L-1處理組細胞數目顯著升高(<0.05),細胞形態正常,呈梭形,NAC促進ADSCs增殖最佳效果的添加濃度為1 mmol·L-1。
2.3 NAC通過降低ADSCs中活性氧水平促進細胞增殖
為探究NAC對氧化應激的ADSCs的增殖影響,在其培養過程中加入適宜濃度的NAC。試驗共分為4個組別:對照組(Control)、1 mmol·L-1NAC組、50 μmol·L-1H2O2組和1 mmol·L-1NAC+50 μmol·L-1H2O2組。細胞增殖3 d后,通過EdU染色試劑盒和血細胞計數板進行細胞計數,結果如圖3-A—E所示,在對照組(Control)中,EdU陽性細胞占32%,在添加1 mmol·L-1NAC的組中,EdU陽性細胞占51%,在添加50 μmol·L-1H2O2的組中,EdU陽性細胞占17%,在添加1 mmol·L-1NAC + 50 μmol·L-1H2O2組中,EdU陽性細胞占29%。同時,細胞計數結果顯示(圖3-F),添加1 mmol·L-1NAC組的細胞數目是對照組細胞數目的1.4倍(<0.05),添加1 mmol·L-1NAC+50 μmol·L-1H2O2組的細胞數目較對照組的細胞數目沒有顯著性變化(>0.05)。以上結果表明,1 mmol·L-1NAC可以促進ADSCs增殖且對氧化應激的ADSCs具有保護作用。
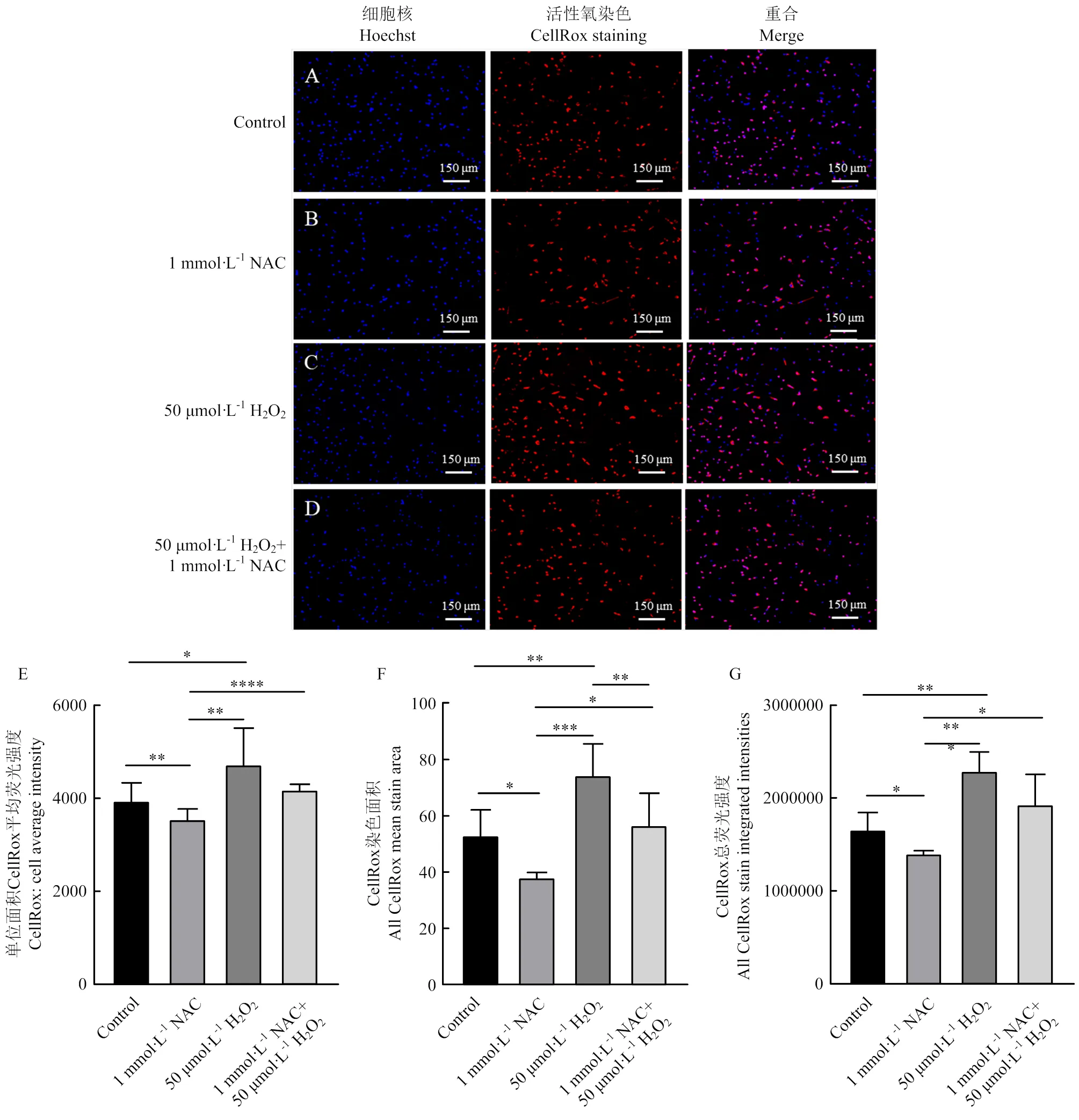
NAC是一種抗氧化劑,具有清除細胞內活性氧的作用。為探究ADSCs經過不同處理后,細胞內活性氧含量的變化。本研究通過CellRox deep red對經過不同處理的細胞進行活性氧染色,通過高通量高內涵活細胞共聚焦成像系統檢測熒光信號。如圖4-A—D所示,CellRox染色結果都呈陽性,經過50 μmol·L-1H2O2處理后的ADSCs中CellRox熒光強度最強,經過1 mmol·L-1NAC處理后的ADSCs中CellRox熒光強度最弱。隨后利用高通量高內涵活細胞共聚焦成像系統對CellRox染色進行定量分析。
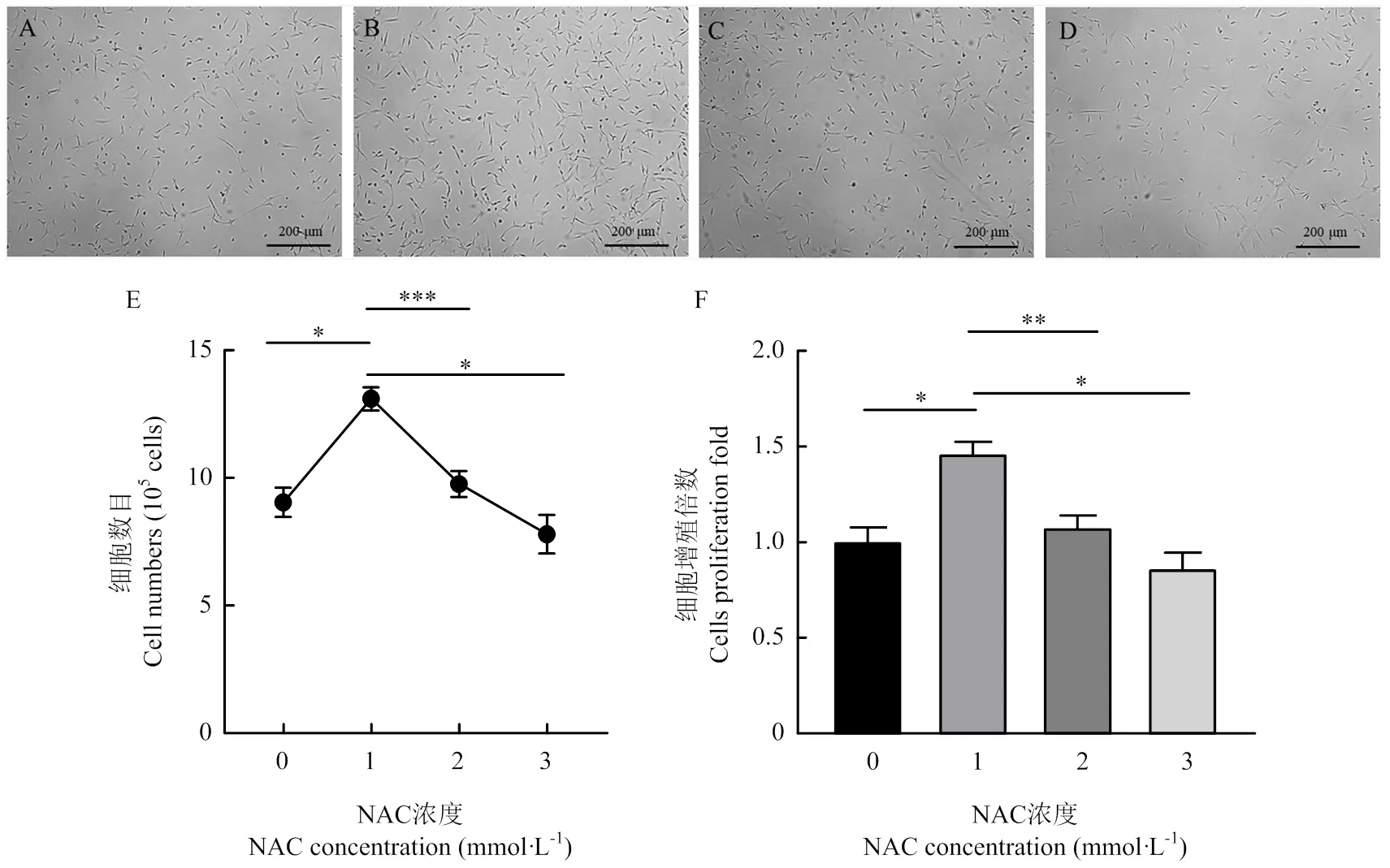
A-D.細胞培養基中添加0、1、2、3 mmol·L-1 NAC時細胞的明場圖;E. 添加不同濃度NAC時細胞計數;F. 添加不同濃度NAC時細胞增殖倍數
CellRox染料主要染細胞質,染料熒光強度越強、熒光范圍越大,說明細胞內活性氧的含量越高。本研究對ADSCs中單位面積CellRox平均熒光強度(圖4-E)、CellRox染色面積(圖4-F)和總熒光強度(圖4-G)進行評估。結果顯示,ADSCs經過50 μmol·L-1H2O2處理后,細胞內的單位面積CellRox平均熒光強度、CellRox染色面積和熒光強度顯著升高(<0.05),說明細胞內活性氧含量較高,進一步說明,50 μmol·L-1H2O2的添加成功構建氧化應激模型。ADSCs經過1 mmol·L-1NAC處理后,細胞內的單位面積平均熒光強度、每個細胞染色面積和總熒光強度顯著降低(<0.05),說明細胞內活性氧含量較對照組降低,NAC清除了ADSCs內的部分活性氧。氧化應激的ADSCs經過1 mmol·L-1NAC + 50 μmol·L-1H2O2處理后,細胞內的活性氧水平和對照組沒有顯著差異(>0.05)。以上結果說明,1 mmol·L-1NAC可以降低ADSCs內活性氧含量,保護ADSCs免受氧化應激的損傷,從而促進其增殖。
2.4 ADSCs中活性氧水平升高促進細胞分化
有研究表明,NAC可以減少3T3-L1脂肪細胞分化標志物的產生從而抑制脂肪細胞的分化[13]。為探究NAC對氧化應激的ADSCs分化的影響,在細胞分化過程中加入1 mmol·L-1NAC,試驗共分為四個組別:對照組(Control)、1 mmol·L-1NAC組、50 μmol·L-1H2O2組和1 mmol·L-1NAC + 50 μmol·L-1H2O2組。細胞分化10 d后,進行油紅O染色(圖5-A—D)和脂質積累量分析,結果表明,在熒光顯微鏡下可以觀察到呈紅色的脂滴,與對照組相比,50 μmol·L-1H2O2組的脂滴數量更多。進一步用異丙醇對油紅O染料進行提取,酶標儀檢測OD510吸光度,結果顯示,與對照組相比,1 mmol·L-1NAC組脂質積累量沒有顯著性差異(>0.05),而50 μmol·L-1H2O2組脂質積累量顯著升高(<0.05),1 mmol·L-1NAC+50 μmol·L-1H2O2組脂質積累量沒有顯著性差異(>0.05)(圖5-E)。通過Image J軟件對50×顯微鏡下油紅O染色圖片的面積進行分析(圖5-F),結果與對照組相比,1 mmol·L-1NAC組油紅O染色面積沒有顯著性差異(>0.05),50 μmol·L-1H2O2組油紅O染色面積顯著高于對照組(<0.05),1 mmol·L-1NAC + 50 μmol·L-1H2O2組油紅O染色面積沒有顯著性差異(>0.05),與脂質積累量的檢測結果一致。

A-D.不同處理組的EdU染色結果;E. 不同處理組的EdU染色陽性細胞百分比;F. 不同處理組的細胞計數
通過RT-qPCR檢測ADSCs在不同處理條件下分化相關基因的相對表達量,在分子水平上進一步探究NAC對氧化應激的ADSCs分化的影響。PPARγ和C/EBPα是脂肪生成的關鍵調控因子[14],與對照組相比, 50 μmol·L-1H2O2組中(圖6-A)和(圖6-B)的mRNA相對表達量顯著升高(<0.05),而1 mmol·L-1NAC組和1 mmol·L-1NAC + 50 μmol·L-1H2O2組中和的mRNA相對表達量沒有顯著性變化(>0.05)。是已知的分化脂肪細胞的標志物[15],50 μmol·L-1H2O2組中的mRNA相對表達量顯著高于其他處理組(圖6-C)。在脂肪分化過程中是必不可少的,它可以在成熟脂肪細胞的脂滴表面表達[16]。本研究中50 μmol·L-1H2O2組中的的mRNA相對表達量顯著高于對照組和1 mmol·L-1NAC組(圖6-D)。以上結果表明,50 μmol·L-1H2O2的添加使得ADSCs內的活性氧含量升高,有利于ADSCs的分化,而1 mmol·L-1NAC對ADSCs的分化沒有影響。
A-D. 不同處理組的CellRox染色;E. 不同處理組單位面積CellRox平均熒光強度;F. 不同處理組CellRox染色面積;G. 不同處理組CellRox總熒光強度
3 討論
3.1 氧化應激抑制ADSCs的增殖
多種干細胞在長期體外培養的過程中,出現干性衰退的問題[17],其影響因素有很多,如細胞培養環境、細胞內因子和信號通路的調節等。L'HONORE等[18]發現小鼠肌肉干細胞在體外短期培養時細胞內活性氧的含量逐漸增加,其增殖能力隨著培養天數的增加而不斷降低。在培養肉研究初期發現,ADSCs在體外擴增時其增殖和分化能力會隨著傳代次數的增加而逐漸降低,不利于種子細胞的大量獲取,成為制約培養肉大規模生產的重要因素。
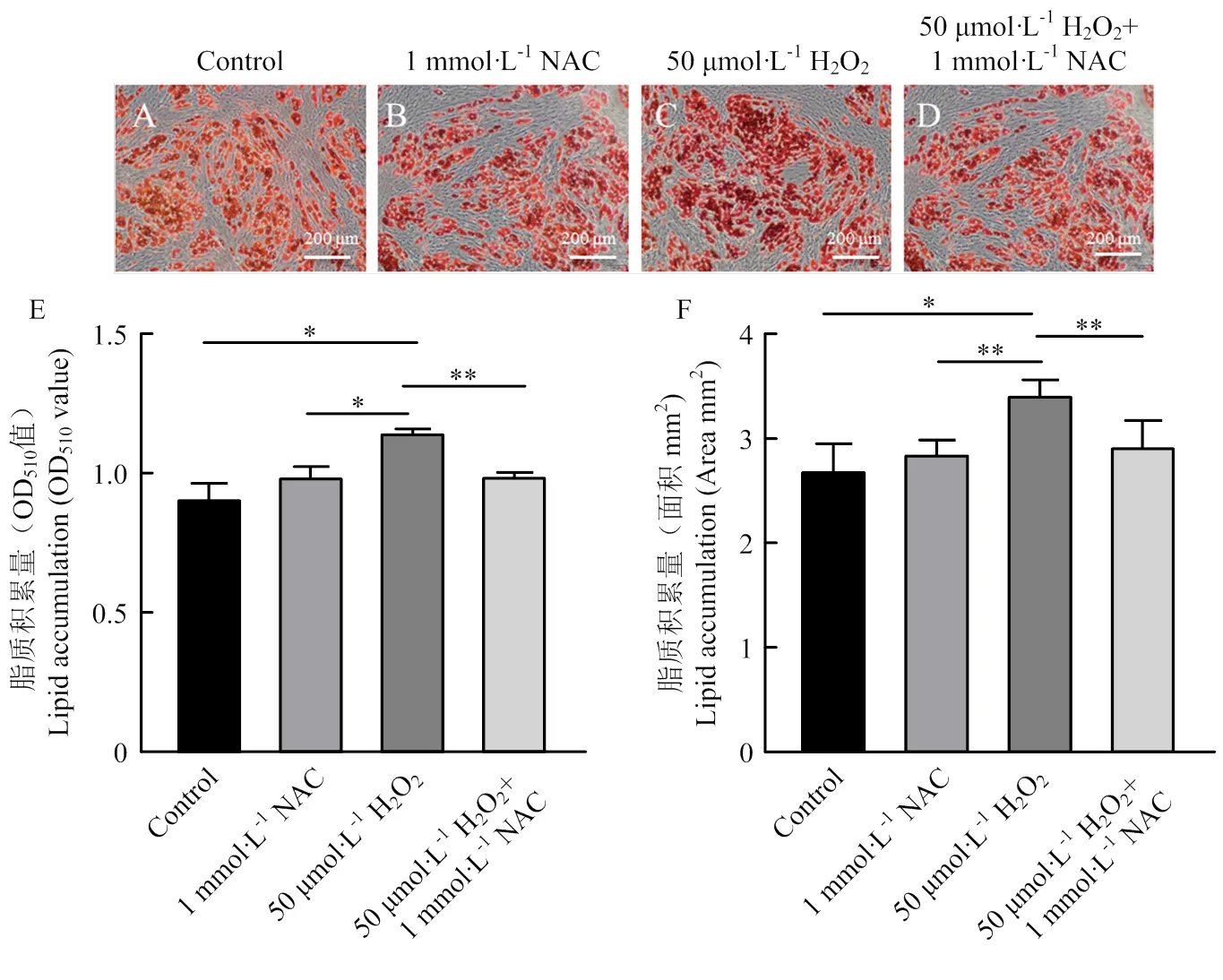
A-D. 不同處理組的油紅O染色圖;E. 不同處理組的脂質積累分析;F. 不同處理的油紅O染色面積分析
活性氧是一種重要的高活性分子,其來源主要包括線粒體呼吸系統、NADPH氧化酶、黃嘌呤氧化還原酶和黃嘌呤氧化酶系統等[19]。在正常情況下,有氧代謝產生的活性氧是各種生理過程的重要信號。然而,當細胞中活性氧濃度較高時,會影響氧化還原介導的信號轉導和細胞命運,損害細胞DNA、蛋白質、碳水化合物和脂質,影響原代細胞的功能,如黏附、增殖、遷移和分化[20]。有研究表明,活性氧可誘導JNK、p38MAPK和ERK等MAPK途徑的激活,以及凋亡蛋白的活化和抗凋亡途徑的抑制[21]。YAHATA等[22]研究發現活性氧積累至超出生理水平時造成DNA損傷并誘導細胞周期抑制劑的表達,導致造血干細胞增殖停滯,細胞發生老化和凋亡。本研究通過外源添加H2O2模擬ADSCs在體外培養過程中所受氧化應激,建立氧化應激模型。有研究表明,在ADSCs培養過程中,通過添加500 μmol·L-1H2O2處理細胞24 h建立氧化應激模型,除此之外,研究中還說明H2O2在超過正常生理狀態(>100 nmol·L-1)的濃度下,會誘導氧化應激[23]。高濃度短期處理是構建氧化應激模型常用的方法,本研究篩選用于構建氧化應激模型的添加濃度同時用在細胞分化過程中,所以采用低濃度長期處理的方法構建氧化應激模型。本研究通過添加50 μmol·L-1H2O2處理細胞3 d,ADSCs中活性氧水平顯著升高,細胞增殖顯著被抑制,細胞活力顯著降低,細胞形態呈梭形,成功建立氧化應激模型。
3.2 NAC可以降低細胞內活性氧含量促進ADSCs增殖
正常條件下,細胞內的氧化還原狀態處在一個動態平衡中,當細胞內的活性氧濃度升高時,細胞強大的抗氧化系統進行活性氧的清除[3]。但有時候,細胞在體外培養時,易受環境影響,產生氧化應激,然而抗氧化酶系統的抗氧化能力有限,細胞易造成損傷,增殖停滯,進而凋亡,這就需要創造低氧環境或加入抗氧化劑,保護細胞免受氧化應激的影響。目前調控細胞內活性氧水平的方法主要有三種,第一種是通過為細胞生長提供一個低氧環境,有研究表明,造血干細胞在可創造低氧環境兩性離子水凝膠中進行體外培養,可以減緩其分化并促進其自我更新[24]。第二種是通過基因編輯調控細胞內活性氧水平,但基因編輯可能在培養脂肪開發中引發消費者的不滿。第三種是通過添加具有清除活性氧的抗氧化劑,常用的抗氧化劑包括維生素C[25]、維生素E[26]、黃酮類化合物[27]、白藜蘆醇[28]等。
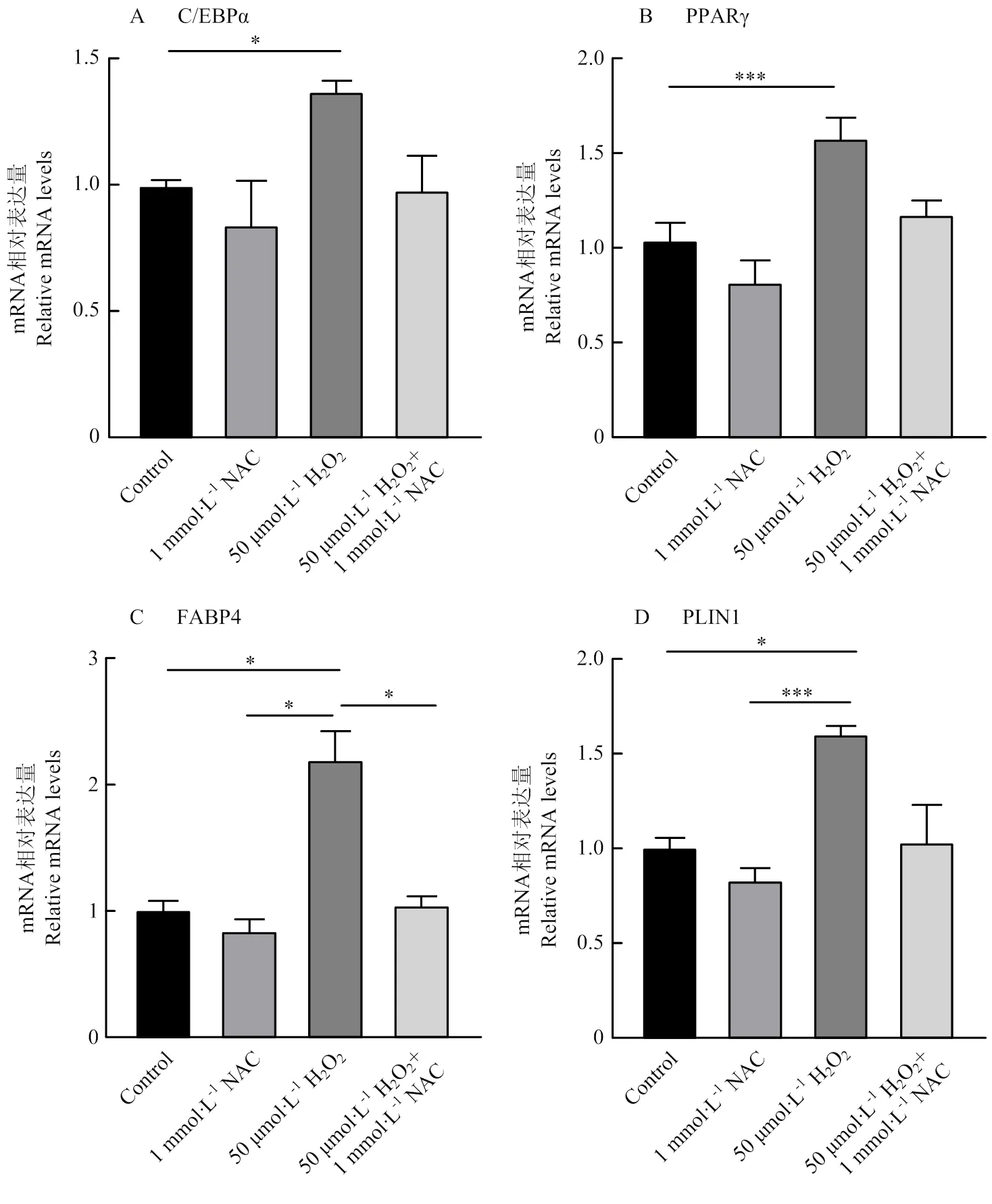
圖6 脂肪分化相關基因的相對表達量
NAC通過促進機體內谷胱甘肽的生物合成來有效減少自由基的累積效應對不同干細胞發揮抗氧化作用,包括造血干細胞和間充質干細胞。MARTACIC等[29]研究發現,NAC在體外可以保護人乳牙組織干細胞免受氧化應激損傷,從而保持這些細胞的再生潛力。對于NAC對脂肪細胞增殖的研究較少,有研究表明,NAC可以促進人來源的ADSCs增殖并且還可以抑制其凋亡和壞死[30]。在本研究中發現,細胞培養基中添加1 mmol·L-1NAC可以顯著降低ADSCs內活性氧的含量,同時促進ADSCs增殖,與XIONG等[30]的研究結果一致。NAC通過降低氧化應激的ADSCs中活性氧水平,逆轉了ADSCs的氧化損傷,對氧化應激誘導的ADSCs生長起到了保護作用。有研究表明,NAC發揮抗氧化作用是通過NF-κB介導的信號通路來實現的[31],對于NAC促進ADSCs增殖的作用機制尚不明確,還需要進一步探究。
3.3 ADSCs內活性氧水平升高有利于細胞成脂分化
脂肪細胞分化形成成熟脂肪是一個極其精密和復雜的過程,涉及許多脂肪信號傳導和轉錄因子表達。初始誘導后,轉錄因子C/EBPβ和C/EBPδ作為脂肪生成的主要早期調節因子,靶向C/EBPα和PPARγ的啟動子,當進一步刺激成為成熟的脂肪細胞時,PPARγ和C/EBPα一起調控,以驅動數百個下游脂肪基因的表達。最終,誘導晚期脂肪生成的因子如FABP4、PLIN 1等賦予脂肪細胞的生理功能并促進脂滴的進一步成熟[32]。有研究表明,脂肪細胞內活性氧的水平與其成脂分化能力息息相關,在人脂肪來源的干細胞誘導分化過程中添加100 μmol·L-1H2O2,可以促進細胞中脂質的積累,有利于其分化。在本研究中,在ADSCs分化過程中添加50 μmol·L-1H2O2,與對照組相比,細胞中的脂質積累量顯著升高,調控脂肪分化的關鍵因子C/EBPα、PPARγ的mRNA的相對表達量也顯著升高,除此之外,表征成熟脂肪生成的因子FABP4、PLIN 1的mRNA的相對表達量也顯著升高,以上結果說明,ADSCs中活性氧水平的升高有利于其分化。本研究與HIGUCHI等的研究結果一致。活性氧可以調節干細胞分化為成熟脂肪細胞,但潛在的信號傳導機制尚不清楚。有研究表明,胰島素信號傳導促進細胞內脂質合成,胰島素信號激活Akt-mTORC1途徑,從而通過轉錄因子SREBP-1和PPARγ增強成脂酶的表達。活性氧可通過抑制磷酸酯酶與張力蛋白同源物來增強胰島素觸發的Akt信號傳導。此外,有證據表明,活性氧可能促進C/EBPβ的二聚化,導致C/EBPβ的DNA結合活性增加,導致下游脂肪效應子C/EBPα的表達[33]。活性氧與脂肪細胞分化的調控機制,還需要進一步研究。反之,也有研究表明,NAC可以降低小鼠脂肪細胞內活性氧的水平從而抑制脂質積累,這主要是通過抑制ERK/JNK-MAPK信號通路的表達來抑制脂肪細胞分化[34]。HIGUCHI等[33]發現,人脂肪來源的間充質干細胞在100 μmol·L-1H2O2氧化應激條件下添加10 mmol·L-1NAC,脂肪細胞內脂質積累量顯著降低。在本研究中ADSCs在50 μmol·L-1H2O2創造的氧化應激下添加1 mmol·L-1NAC,ADSCs中脂質積累量沒有顯著性變化,可能是因為本研究中NAC添加濃度較低,降低的活性氧的水平對脂肪細胞的分化不足以產生顯著性影響。
4 結論
本研究證明,在氧化應激環境下豬脂肪間充質干細胞內活性氧含量升高,進而抑制細胞增殖,不利于培養脂肪種子細胞大量擴增。在豬脂肪間充質干細胞增殖過程中添加1 mmol·L-1N-乙酰-L半胱氨酸,細胞中活性氧水平降低,可有效緩解由于氧化應激造成豬脂肪間充質干細胞增殖能力下降的問題,為培養脂肪種子細胞的擴增奠定基礎。在活性氧對豬脂肪間充質干細胞分化能力的影響研究中,本研究證明,豬脂肪間充質干細胞中活性氧的升高,可以更好地誘導豬脂肪間充質干細胞向成熟脂肪細胞分化,有利于脂質的積累。本研究可以為實現培養脂肪種子細胞的擴大培養和提高培養脂肪種子細胞的分化效率提供理論依據,但N-乙酰-L半胱氨酸促進豬脂肪間充質干細胞增殖的作用機制和活性氧對豬脂肪間充質干細胞分化調控機制尚不明確,還需要進一步探究。
[1] 周光宏, 丁世杰, 徐幸蓮. 培養肉的研究進展與挑戰. 中國食品學報, 2020, 20(5): 1-11.
ZHOU G H, DING S J, XU X L. Progress and challenges in cultured meat. Journal of Chinese Institute of Food Science and Technology, 2020, 20(5): 1-11. (in Chinese)
[2] FISH K D, RUBIO N R, STOUT A J, YUEN J S K, KAPLAN D L. Prospects and challenges for cell-cultured fat as a novel food ingredient. Trends in Food Science & Technology, 2020, 98: 53-67.
[3] KOZAKOWSKA M, PIETRASZEK-GREMPLEWICZ K, JOZKOWICZ A, DULAK J. The role of oxidative stress in skeletal muscle injury and regeneration: focus on antioxidant enzymes. Journal of Muscle Research and Cell Motility, 2015, 36(6): 377-393.
[4] DENU R A, HEMATTI P. Effects of oxidative stress on mesenchymal stem cell biology. Oxidative Medicine and Cellular Longevity, 2016, 2016: 2989076.
[5] ETO H, KATO H, SUGA H, AOI N, DOI K, KUNO S, YOSHIMURA K. The fate of adipocytes after nonvascularized fat grafting: evidence of early death and replacement of adipocytes. Plastic and Reconstructive Surgery, 2012, 129(5): 1081-1092.
[6] TURKER I, ZHANG Y H, ZHANG Y M, REHMAN J. Oxidative stress as a regulator of adipogenesis. Faseb Journal, 2007, 21:830.
[7] RUSHWORTH G F, MEGSON I L. Existing and potential therapeutic uses for N-acetylcysteine: The need for conversion to intracellular glutathione for antioxidant benefits. Pharmacology & Therapeutics, 2014, 141(2): 150-159.
[8] JARIYAMANA N, CHUVEERA P, DEWI A, LEELAPORNPISID W, ITTICHAICHAROEN J, CHATTIPAKORN S, SRISUWAN T. Effects of N-acetyl cysteine on mitochondrial ROS, mitochondrial dynamics, and inflammation on lipopolysaccharide-treated human apical papilla cells. Clinical Oral Investigations, 2021, 25(6): 3919-3928.
[9] DING S J, SWENNEN G N M, MESSMER T, GAGLIARDI M, MOLIN D G M, LI C B, ZHOU G H, POST M J. Maintaining bovine satellite cells stemness through p38 pathway. Scientific Reports, 2018, 8(1): 10808.
[10] 胡榮蓉, 丁世杰, 郭赟, 朱浩哲, 陳益春, 劉政, 丁希, 唐長波, 周光宏. Trolox對豬肌肉干細胞增殖及分化的影響. 中國農業科學, 2021, 54(24): 5290-5301.
HU R R, DING S J, GUO Y, ZHU H Z, CHEN Y C, LIU Z, DING X, TANG C B, ZHOU G H. Effects of trolox on proliferation and differentiation of pig muscle stem cells. Scientia Agricultura Sinica, 2021, 54(24): 5290-5301. (in Chinese)
[11] 李惠俠, 羅肖, 劉榮鑫, 楊映娟, 楊公社. 激活Wnt/β-catenin信號通路抑制豬AMSCs向脂肪細胞分化. 畜牧獸醫學報, 2010, 41(12): 1523-1528.
LI H X, LUO X, LIU R X, YANG Y J, YANG G S. Activation of Wnt/β-catenin signaling pathway inhibits the adipogenic differentiation of porcine adipose-derived mesenchymal stem cells. Chinese Journal of Animal and Veterinary Sciences, 2010, 41(12): 1523-1528. (in Chinese)
[12] CHEN Y J, LIU H Y, CHANG Y T, CHENG Y H, MERSMANN H J, KUO W H, DING S T. Isolation and differentiation of adipose-derived stem cells from porcine subcutaneous adipose tissues. Journal of Visualized Experiments, 2016(109): e53886.
[13] CALZADILLA P, SAPOCHNIK D, COSENTINO S, DIZ V, DICELIO L, CALVO J C, GUERRA L N. N-acetylcysteine reduces markers of differentiation in 3T3-L1 adipocytes. International Journal of Molecular Sciences, 2011, 12(10): 6936-6951.
[14] KURI-HARCUCH W, VELEZ-DELVALLE C, VAZQUEZ- SANDOVAL A, HERNáNDEZ-MOSQUEIRA C, FERNANDEZ- SANCHEZ V. A cellular perspective of adipogenesis transcriptional regulation. Journal of Cellular Physiology, 2019, 234(2): 1111-1129.
[15] SATISH L, KRILL-BURGER J M, GALLO P H, DES ETAGES S, LIU F, PHILIPS B J, RAVURI S, MARRA K G, LAFRAMBOISE W A, KATHJU S, RUBIN J P. Expression analysis of human adipose- derived stem cells duringdifferentiation to an adipocyte lineage. BMC Medical Genomics, 2015, 8: 41.
[16] LI S J, RAZA S H A, ZHAO C P, CHENG G, ZAN L S. Overexpression of PLIN1promotes lipid metabolism in bovine adipocytes. Animals, 2020, 10(11): 1944.
[17] DING S J, WANG F, LIU Y, LI S, ZHOU G H, HU P. Characterization and isolation of highly purified porcine satellite cells. Cell Death Discovery, 2017, 3: 17003.
[18] L'HONORé A, COMMèRE P H, NEGRONI E, PALLAFACCHINA G, FRIGUET B, DROUIN J, BUCKINGHAM M, MONTARRAS D. The role of Pitx2 and Pitx3 in muscle stem cells gives new insights into P38α MAP kinase and redox regulation of muscle regeneration. eLife, 2018, 7: e32991.
[19] WANG X, HAI C X. Novel insights into redox system and the mechanism of redox regulation. Molecular Biology Reports, 2016, 43(7): 607-628.
[20] JIANG L, KON N, LI T Y, WANG S J, SU T, HIBSHOOSH H, BAER R, GU W. Ferroptosis as a p53-mediated activity during tumour suppression. Nature, 2015, 520(7545): 57-62.
[21] RODRIGUES M, TURNER O, STOLZ D, GRIFFITH L G, WELLS A. Production of reactive oxygen species by multipotent stromal cells/mesenchymal stem cells upon exposure to fas ligand. Cell Transplantation, 2012, 21(10): 2171-2187.
[22] YAHATA T, TAKANASHI T, MUGURUMA Y, IBRAHIM A A, MATSUZAWA H, UNO T, SHENG Y, ONIZUKA M, ITO M, KATO S, ANDO K. Accumulation of oxidative DNA damage restricts the self-renewal capacity of human hematopoietic stem cells. Blood, 2011, 118(11): 2941-2950.
[23] BHATTI F U R, KIM S J, YI A K, HASTY K A, CHO H. Cytoprotective role of vitamin E in porcine adipose-tissue-derived mesenchymal stem cells against hydrogen-peroxide-induced oxidative stress. Cell and Tissue Research, 2018, 374(1): 111-120.
[24] BAI T, LI J Q, SINCLAIR A, IMREN S, MERRIAM F, SUN F, O'KELLY M B, NOURIGAT C, JAIN P, DELROW J J, BASOM R S, HUNG H C, ZHANG P, LI B W, HEIMFELD S, JIANG S Y, DELANEY C. Expansion of primitive human hematopoietic stem cells by culture in a zwitterionic hydrogel. Nature Medicine, 2019, 25(10): 1566-1575.
[25] LI Y, ZHANG W Z, CHANG L, HAN Y, SUN L, GONG X J, TANG H, LIU Z P, DENG H C, YE Y X, WANG Y, LI J, QIAO J, QU J, ZHANG W Q, LIU G H. Vitamin C alleviates aging defects in a stem cell model for Werner syndrome. Protein & Cell, 2016, 7(7): 478-488.
[26] LA FATA G, WEBER P, MOHAJERI M H. Effects of vitamin E on cognitive performance during ageing and in Alzheimer’s disease. Nutrients, 2014, 6(12): 5453-5472.
[27] GUO Y, DING S J, DING X, LIU Z, WANG J L, CHEN Y, LIU P P, LI H X, ZHOU G H, TANG C B. Effects of selected flavonoids oncellproliferation and differentiation of porcine muscle stem cells for cultured meat production. Food Research International, 2022, 160: 111459.
[28] YIN R C, MAO S Q, ZHAO B L, CHONG Z C, YANG Y, ZHAO C, ZHANG D P, HUANG H, GAO J, LI Z, JIAO Y, LI C P, LIU S Q, WU D N, GU W K, YANG Y G, XU G L, WANG H L. Ascorbic acid enhances Tet-mediated 5-methylcytosine oxidation and promotes DNA demethylation in mammals. Journal of the American Chemical Society, 2013, 135(28): 10396-10403.
[29] MARTACIC J, FILIPOVIC M K, BOROZAN S, CVETKOVIC Z, POPOVIC T, ARSIC A, TAKIC M, VUCIC V, GLIBETIC M. N-acetyl-L-cysteine protects dental tissue stem cells against oxidative stress. Clinical Oral Investigations, 2018, 22(8): 2897-2903.
[30] XIONG L Y, SUN J M, HIRCHE C, YANG J, YANG Y Q, XIA Y, LEHNHARDT M, WANG R R, FU X.N-acetyl-L-cysteine promotes proliferation and suppresses interleukin-8 expression in adipose-derived stem cells. Aesthetic Plastic Surgery, 2012, 36(5): 1260-1265.
[31] 林芷昕, 謝秋萍, 王長康, 高玉云. N-乙酰半胱氨酸的生理功能及其在畜禽生產中的應用. 動物營養學報, 2022, 34(8): 4857-4866.
LIN Z X, XIE Q P, WANG C K, GAO Y Y. Physiological function of N-acetylcysteine and its application in livestock and poultry production. Chinese Journal of Animal Nutrition, 2022, 34(8): 4857-4866. (in Chinese)
[32] SUGII S, WONG C Y Q, LWIN A K O, CHEW L J M. Alternative fat: Redefining adipocytes for biomanufacturing cultivated meat. Trends in Biotechnology, 2023, 41(5): 686-700.
[33] HIGUCHI M, DUSTING G J, PESHAVARIYA H, JIANG F, HSIAO S T F, CHAN E C, LIU G S. Differentiation of human adipose-derived stem cells into fat involves reactive oxygen species and Forkhead box O1 mediated upregulation of antioxidant enzymes. Stem Cells and Development, 2013, 22(6): 878-888.
[34] BALAJI S N, TRIVEDI V. Suicidal inactivation of methemoglobin by generation of thiyl radical: Insight into NAC mediated protection in RBC. Current Molecular Medicine, 2013, 13(6): 1000-1009.
NAC Affects Proliferation and Differentiation of Adipose-Derived Mesenchymal Stem Cells by Regulating Reactive Oxygen Species

1College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095;2Institute of Animal Husbandry and Veterinary Medicine, Xinjiang Academy of Agricultural and Reclamation Sciences/State Key Laboratory for Sheep Genetic Improvement and Healthy Production, Shihezi 832000, Xinjiang
【Objective】 Cells are sensitive to oxidative stress and elevated levels of intracellular reactive oxygen species during in vitro culture, which affects cell function. In this research, the regulation of reactive oxygen species in porcine adipose mesenchymal stem cells by N-acetyl-L cysteine (NAC) was evaluated, and the effects on their proliferation and differentiation were further clarified, which could provide a theoretical basis and reference for cultured fat seed cells to expand in vitro in large numbers and improve differentiation efficiency. 【Method】 In this research, to model oxidative stress, the different concentrations of H2O2(0, 25, 50, and 100 μmol·L-1) were added during the proliferation of adipose-derived mesenchymal stem cells (ADSCs). The added concentration of H2O2was identified by cell counting results, cell morphology, cell viability and intracellular reactive oxygen species levels detected by a High-throughput High-content Live Cells Confocal Imaging System. To select the appropriate addition concentration of NAC to promote the proliferation of ADSCs, the different concentrations of NAC (0, 1, 2, and 3 mmol·L-1) were added during the proliferation of ADSCs, and the appropriate addition concentration of NAC was determined by cell counting results and cell morphology. To further explore the effect of NAC on the proliferation of oxidatively stressed ADSCs, cell proliferation under different treatment conditions (Control, 1 mmol·L-1NAC, 50 μmol·L-1H2O2, and 1 mmol·L-1NAC + 50 μmol·L-1H2O2) was analyzed by EdU staining and cell counting. To investigate the level of reactive oxygen species in ADSCs under different treatment conditions, ADSCs proliferated under different treatment conditions for 3 d were stained by CellRox, and the intracellular reactive oxygen species content was detected by High-throughput High-inclusion Live Cell Confocal Imaging System to clarify the relationship between ADSCs proliferation and intracellular reactive oxygen species level. To explore the effect of reactive oxygen species levels within ADSCs on their differentiation, ADSCs were stained with Oil Red O after 10 d of differentiation under different treatment conditions, and the amount of differentiated lipid accumulation in ADSCs was assessed by Image J analysis of stained area, and the relative expression of ADSCs differentiation-related genes was examined by RT-qPCR. 【Result】 During the proliferation of ADSCs, ADSCs in the group with 50 μmol·L-1H2O2were shuttle-shaped and had significantly higher intracellular reactive oxygen species content compared with the control group (<0.05), and the oxidative stress model was successfully established. Compared with the control group, when 50 μmol·L-1H2O2was added during proliferation of ADSCs, the number of ADSCs proliferation was significantly decreased (<0.05), but the lipid accumulation of ADSCs was significantly higher (<0.05) when 50 μmol·L-1H2O2was added during the differentiation of ADSCs. During the proliferation of ADSCs, ADSCs in the group with the addition of 1 mmol·L-1NAC had a shuttle shape, the intracellular reactive oxygen species content was significantly lower (<0.05), and proliferation number of ADSCs was significantly higher (<0.05) compared with the control group, but the addition of 1 mmol·L-1NAC during the differentiation of ADSCs had no significant effect on the lipid accumulation of ADSCs (>0.05). 【Conclusion】 When ADSCs were affected by oxidative stress, the level of reactive oxygen species in ADSCs increases, which was detrimental to the massive expansion of ADSCs in vitro, inducing cell differentiation and accelerating cellular senescence. The addition of 1 mmol·L-1NAC to the in vitro expansion system of ADSCs could reduce the oxidative stress damage brought about by long-term culture and exogenous stimulation, and had a protective effect on oxidatively stressed ADSCs, which could effectively promote cell proliferation and did not affect the differentiation ability of the cells.
NAC; ADSCs; reactive oxygen species; proliferation; differentiation; cultured fat

2022-05-09;
2023-09-17
國家重點研發計劃(2021YFC2101403)、國家自然科學基金(32172725)
劉裴裴,E-mail:1563398259@qq.com。通信作者李惠俠,E-mail:lihuixia@njau.edu.cn。通信作者唐紅,E-mail:urblockhead@163.com
(責任編輯 林鑒非)

