二氫槲皮素對心力衰竭大鼠心功能的保護作用及其作用機制
孫春梅,唐 玲,庹玉平
心力衰竭(heart failure,HF)是由心室充盈或射血功能受損引起的一種異質性綜合征,是各種心臟病發展的終末期階段,具有較高的發病率和死亡率,已成為嚴重影響人民健康的公共衛生問題[1-2]。盡管目前HF的研究和治療取得了明顯成效,但仍有部分病人因HF而功能受損、生活質量低下甚至過早死亡,臨床治療效果仍然有限[3]。研究發現,HF發病主要與體內細胞因子系統激活、心肌細胞過度凋亡等有關[4]。因此,開發針對HF發病機制相關的新治療方法對HF的臨床治療具有重要意義。二氫槲皮素(quercetin,DHQ)是松科植物黃杉、雪松等常見的典型黃酮類成分,具有一系列生物活性,包括抗氧化、抗炎、抗腫瘤和血管舒張等[5]。DHQ可通過抑制氧化應激、調節內質網應激以及線粒體凋亡途徑保護心肌缺血再灌注損傷、預防糖尿病性心肌病,還可通過減輕線粒體功能障礙和糖代謝紊亂改善心肌細胞肥大,其對壓力超負荷后的心肌肥厚和心肌纖維化也有一定改善作用[6-9]。DHQ對心肌損傷具有一定治療作用,但DHQ在HF方面的報道較少,且DHQ在心血管保護方面的作用機制尚未完全明確。因此,本研究探究DHQ對HF大鼠心功能的影響,并分析其相關作用機制。
1 材料與方法
1.1 實驗材料
無特定病原體(SPF)級雄性健康Wistar大鼠60只,6~8周齡。常規飼養在室溫18~24 ℃、相對濕度50%~70%、通風的動物室內,標準飼料喂養,自由飲水、進食。鹽酸阿霉素(規格:每袋100 g)購自江蘇達捷生物科技有限公司;DHQ(純度>98%,規格:0.25 g)購自江蘇艾康生物醫藥研發有限公司;卡托普利(規格:每片25 mg,國藥準字H32023731)購自常州制藥廠有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量試劑盒、增強化學發光試劑(enhanced chemiluminescence,ECL)均購自上海碧云天公司;蘇木精-伊紅(hematoxylin-eosin,HE)染色試劑盒、脫氧核糖核苷酸末端轉移酶介導的缺口末端標記法(TUNEL)細胞凋亡檢測試劑盒購自上海邦景實業有限公司;腦鈉肽(brain natriuretic peptide,BNP)、C反應蛋白(C-reactive pmtein,CRP)、白細胞介素-6(interleukin-6,IL-6)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)酶聯免疫吸附試驗(ELISA)試劑盒均購自武漢賽培生物科技有限公司;兔抗B淋巴細胞瘤2(B-cell lymphoma-2,Bcl-2)、B淋巴細胞瘤-2相關蛋白(B-cell-lymphoma-2 related protein,Bax)、切割型半胱氨酸天冬氨酸蛋白水解酶-3(cleaved cysteine aspartate proteolytic enzyme-3,Cleaved Caspase-3)、高遷移率族蛋白1(high mobility group protein1,HMGB1)、酪氨酸激酶2(Janus kinase 2,JAK2)、磷酸化JAK2(p-JAK2)、信號轉導與轉錄激活因子3(signal transducer and activator of transcription 3,STAT3)、磷酸化STAT3(phosphorylated STAT3,p-STAT3)抗體,鼠抗甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體均購自美國Abcam公司;辣根過氧化物酶(horseradish peroxidase,HRP)標記的山羊抗兔、山羊抗鼠免疫球蛋白G(IgG)抗體購自美國Thermo Fisher公司。
1.2 實驗方法
1.2.1 實驗模型制備
隨機選取15只大鼠,采用腹腔注射鹽酸阿霉素法造模,按1.25 mg/kg的劑量進行腹腔注射,每周2次,連續6周,累積注射15 mg/kg,觀察大鼠行為學改變(體質量減輕、活動量減少、精神不振、毛色黯淡無光等),于第16 天清晨采用心臟超聲檢測左室射血分數(left ventricular ejection fraction,LVEF),LVEF低于40%即表示HF模型建立成功。
1.2.2 實驗分組及給藥處理
將造模成功的45只大鼠隨機分為模型組(HF組)、DHQ低劑量組(L-DHQ組)、DHQ高劑量組(H-DHQ組)、卡托普利組(Captopril組),每組15只。另取15只健康大鼠設為對照組(NC組)。其中L-DHQ組大鼠灌胃DHQ溶液(0.4%羧甲基纖維素鈉配制)15 mg/kg;H-DHQ組大鼠灌胃DHQ溶液60 mg/kg;Captopril組大鼠灌胃卡托普利10 mg/kg;HF組和NC組大鼠灌胃同等劑量的0.4%羧甲基纖維素鈉溶液。每天灌胃1次,連續給藥14 d。
1.2.3 心功能指標檢測
大鼠末次給藥結束后,禁食不禁水12 h,以10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠,采用彩色超聲儀檢測大鼠LVEF、左室短軸縮短率(left ventricular fractional shortening,LVFS)、每搏心輸出量(stroke volume,SV),連續檢測3個連續心動周期,每個指標均取3次平均值。
1.2.4 采集樣本
超聲檢測結束后,經大鼠腹主動脈采血,靜置1 h,3 000 r/min離心10 min,收集血清,于-20 ℃保存。采血后立即處死大鼠,剪開胸腔快速取出心臟,以預冷的生理鹽水沖洗心臟,濾紙吸去多余水分,留取左室心肌組織,一部分心肌組織置于4%多聚甲醛固定,一部分心肌組織于-80 ℃保存備用。
1.2.5 HE染色觀察大鼠心肌組織病理變化
取4%多聚甲醛中的心肌組織,常規石蠟包埋切片,厚度為4 μm,取切片按HE試劑盒說明書進行HE染色、中性樹膠封片,光學顯微鏡下觀察。
1.2.6 TUNEL染色檢測大鼠心肌細胞凋亡情況
取大鼠心肌組織石蠟切片,常規脫蠟水化后用磷酸鹽緩沖液(PBS)沖洗,37 ℃下加入蛋白酶K溶液消化20 min,PBS沖洗,在4 ℃下孵育4 min,加入3%過氧化氫孵育10 min,PBS沖洗,加入TUNEL反應液于37 ℃下孵育60 min,洗滌后抗熒光素抗體孵育30 min,用二氨基聯苯胺(DAB)染色,隨后用蘇木精復染3 min,乙醇浸泡2 s,自來水沖洗,晾干后中性樹膠封片,光學顯微鏡下觀察心肌細胞凋亡情況,凋亡陽性細胞呈深棕黃色。細胞凋亡率(%)=凋亡陽性細胞數/總細胞數×100%。
1.2.7 ELISA法檢測大鼠血清中BNP、炎性因子和氧化應激指標水平
取大鼠血清,按照ELISA試劑盒說明書檢測血清BNP、IL-6、TNF-α、CRP、SOD、GSH-Px、MDA水平,采用酶標儀檢測待測標本吸光度(OD)值,繪制標準品回歸曲線,以OD值計算待測標本濃度水平。
1.2.8 蛋白免疫印跡(Western Blot)法檢測大鼠心肌組織相關蛋白表達
取大鼠心肌組織,加入預冷的裂解液,提取組織蛋白,以BCA法測定蛋白質量濃度,將蛋白樣品經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離,轉移至聚偏二氟乙烯(PVDF)膜,加入5%脫脂牛奶,37 ℃條件下封閉1 h,洗膜,分別加入Bcl-2(1∶500)、Bax(1∶500)、Cleaved Caspase-3(1∶800)、HMGB1(1∶1 000)、JAK2(1∶1 000)、p-JAK2(1∶1 000)、STAT3(1∶1 000)、p-STAT3(1∶1 000)、GAPDH(1∶1 000)抗體,4 ℃孵育過夜,洗膜,加入對應HRP標記的山羊抗兔、山羊抗鼠IgG抗體(1∶2 000),37 ℃孵育2 h,洗膜,加入ECL發光液,于暗室內曝光、顯影,采用凝膠成像分析系統拍照分析。
1.3 統計學處理

2 結 果
2.1 各組心功能指標比較
與NC組比較,HF組大鼠心功能指標LVEF、LVFS、SV均明顯降低,BNP水平明顯升高,差異均有統計學意義(P<0.05);與HF組比較,L-DHQ組、H-DHQ組和Captopril組大鼠心功能指標LVEF、LVFS、SV均明顯升高,BNP水平明顯降低,差異均有統計學意義(P<0.05),且H-DHQ組和Captopril組大鼠心功能指標LVEF、LVFS、SV均明顯高于L-DHQ組,BNP水平明顯低于L-DHQ組,差異均有統計學意義(P<0.05)。詳見表1。
表1 各組心功能指標比較
2.2 各組大鼠心肌組織病理變化
NC組大鼠心肌細胞排列整齊、緊密,結構清晰,無明顯變性、壞死;HF組大鼠心肌細胞排列紊亂,大量細胞變性、壞死,胞質呈溶解狀態,肌纖維明顯腫脹、斷裂,間質明顯充血水腫,伴大量炎性細胞浸潤;L-DHQ組、H-DHQ組和Captopril組大鼠心肌細胞變性、壞死程度明顯減少,間質水腫、炎性細胞浸潤均得到不同程度改善,且H-DHQ組和Captopril組大鼠心肌組織病理損傷改善更為明顯。詳見圖1。

圖1 各組大鼠心肌組織病理變化(HE染色,×400)
2.3 各組大鼠心肌細胞凋亡及凋亡蛋白表達比較
與NC組比較,HF組大鼠心肌細胞凋亡率、心肌組織中Bax和Cleaved Caspase-3蛋白表達量均明顯升高,Bcl-2蛋白表達量明顯降低,差異均有統計學意義(P<0.05);與HF組比較,L-DHQ組、H-DHQ組和Captopril組大鼠心肌細胞凋亡率、心肌組織中Bax和Cleaved Caspase-3蛋白表達量均明顯降低,Bcl-2蛋白表達量明顯升高,差異均有統計學意義(P<0.05),且H-DHQ組和Captopril組大鼠心肌細胞凋亡率、Bax和Cleaved Caspase-3蛋白表達量均明顯低于L-DHQ組,Bcl-2蛋白表達量明顯高于L-DHQ組,差異均有統計學意義(P<0.05)。詳見圖2~圖5。

圖2 光學顯微鏡下觀察各組心肌細胞凋亡情況(TUNEL染色,×200)

圖3 各組心肌細胞凋亡率比較

圖4 各組心肌細胞凋亡蛋白表達條帶圖
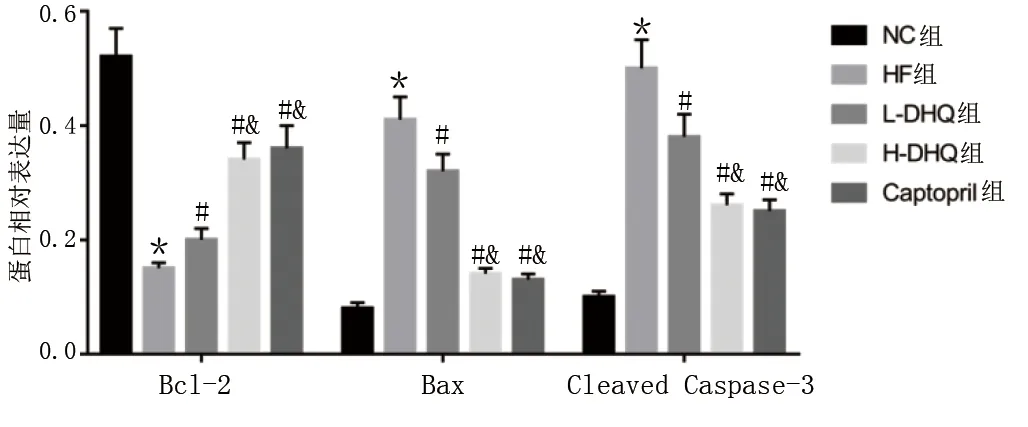
圖5 各組心肌細胞凋亡蛋白表達比較
2.4 各組大鼠血清炎性因子水平比較
與NC組比較,HF組大鼠血清IL-6、TNF-α、CRP水平均明顯升高(P<0.05);與HF組比較,L-DHQ組、H-DHQ組和Captopril組大鼠血清IL-6、TNF-α、CRP水平均明顯降低(P<0.05),且H-DHQ組和Captopril組大鼠血清IL-6、TNF-α、CRP水平明顯低于L-DHQ組(P<0.05)。詳見表2。
表2 各組大鼠血清炎性因子水平比較
2.5 各組大鼠血清氧化應激指標水平比較
與NC組比較,HF組大鼠血清SOD、GSH-Px水平均明顯降低,MDA水平明顯升高,差異均有統計學意義(P<0.05);與HF組比較,L-DHQ組、H-DHQ組和Captopril組大鼠血清SOD、GSH-Px水平均明顯升高,MDA水平明顯降低,且H-DHQ組和Captopril組大鼠血清SOD、GSH-Px、MDA水平改善程度明顯優于L-DHQ組,差異均有統計學意義(P<0.05)。詳見表3。
表3 各組大鼠血清氧化應激指標水平比較
2.6 各組大鼠心肌組織中HMGB1蛋白、JAK2/STAT3通路相關蛋白表達比較
與NC組比較,HF組大鼠心肌組織中HMGB1蛋白表達量、p-JAK2/JAK2和p-STAT3/STAT3比值均明顯升高(P<0.05);與HF組比較,L-DHQ組、H-DHQ組和Captopril組大鼠心肌組織中HMGB1蛋白表達量、p-JAK2/JAK2和p-STAT3/STAT3比值均明顯升高(P<0.05),且H-DHQ組和Captopril組大鼠心肌組織中HMGB1蛋白表達量、p-JAK2/JAK2和p-STAT3/STAT3比值均明顯高于L-DHQ組(P<0.05)。詳見圖6、圖7。

圖6 各組心肌組織中HMGB1蛋白、JAK2/STAT3通路相關蛋白表達的條帶圖

圖7 各組心肌組織中HMGB1蛋白、JAK2/STAT3通路相關蛋白表達比較
3 討 論
HF可以由幾乎所有的心血管疾病發展而來,臨床常見的病因有心肌梗死、高血壓、心肌病等。隨著對HF研究的深入,發現HF發生時心臟會出現一系列進行性病理變化,加重心肌損傷,進而導致心功能下降發生致死性HF[10-11]。DHQ因在炎癥、微生物感染、腫瘤、肝臟等疾病中顯示的藥理活性而受到特別關注[12]。有研究報道,DHQ還具有預防與治療心腦血管疾病的藥理作用[13]。本研究建立HF大鼠模型,分析DHQ對HF的作用機制。LVEF、LVFS、SV均是心臟超聲心動圖指標,可直觀反映心臟功能[14]。BNP主要儲存于心室肌內,具有擴張血管調節血壓動態平衡、促進水鈉排出以預防水鈉潴留的作用,HF發生時心室負荷增加,心肌細胞受到機械牽拉后刺激心室肌細胞大量分泌BNP。因此,BNP水平升高程度與HF嚴重程度呈正相關,是心室功能障礙的特異性指標[15]。本研究發現,DHQ可明顯改善HF大鼠LVEF、LVFS、SV、BNP水平,保護HF大鼠心功能。此外,HE染色結果顯示,高劑量DHQ對HF大鼠心肌組織病理損傷的改善效果與陽性藥物卡托普利的作用效果相當,提示DHQ具有明顯保護HF心功能的效果。
細胞凋亡在許多生理病理過程中起著至關重要的作用,逐漸但持續的心肌細胞凋亡是HF發生、進展的主要原因,抗細胞凋亡干預是HF的有效治療途徑之一[16]。心肌細胞凋亡過程中,Bcl-2家族和Caspase家族起重要作用。Bcl-2家族有兩個代表性成員:促進凋亡基因的Bax和抑制凋亡基因的Bcl-2,Bcl-2的過度表達可以阻斷細胞凋亡,保護心肌細胞,而Bax的作用正好相反。Caspase-3則是Caspase家族中最重要的成員,是控制心肌細胞凋亡發生、發展的標志酶[17]。Chen等[18]報道,DHQ通過調控Bcl-2、Bax和pro-Caspase-3蛋白表達抑制肝細胞凋亡。本研究檢測HF大鼠心肌細胞凋亡和凋亡蛋白表達,結果顯示,HF大鼠心肌細胞凋亡率明顯升高,心肌組織中Bax和Cleaved Caspase-3蛋白表達上調,Bcl-2蛋白表達下調。DHQ則可明顯降低HF大鼠心肌細胞凋亡率,并下調心肌組織中Bax和Cleaved Caspase-3蛋白表達,上調Bcl-2蛋白表達,且DHQ劑量越大其作用效果越強。表明DHQ可通過調控凋亡蛋白表達抑制HF大鼠心肌細胞凋亡。
氧化應激和炎癥反應是HF發生、發展的重要機制。HF發生時缺血、缺氧狀態會引起氧化代謝異常,形成氧化應激狀態,而氧化應激會引起炎癥反應,促進炎癥細胞因子CRP、TNF-α、IL-6等大量分泌產生,加重心肌組織損傷,從而導致HF的進展。因此,氧化應激敏感性指標(如SOD、GSH-Px、MDA)和炎癥標志物可預測HF病人的預后[19-20]。本研究結果顯示,DHQ能夠明顯降低HF大鼠血清炎性因子IL-6、TNF-α、CRP水平和MDA含量,增高HF大鼠血清SOD、GSH-Px活性,且高劑量DHQ效果明顯優于低劑量DHQ,與卡托普利作用效果比較無明顯差異。表明DHQ可明顯減輕HF大鼠炎癥反應和氧化應激狀態。
HMGB1是一種存在于真核細胞細胞核中的染色體蛋白。研究發現,單核細胞在HMGB1的刺激下可誘導TNF-α、IL-6等多種促炎細胞因子釋放,其在炎癥反應的發生、啟動中起到了關鍵作用,可作為炎癥性疾病的治療靶點[21]。Volz等[22]研究發現,HMGB1是HF病人死亡的獨立預測因子。Taskin等[23]研究表明,沉默HMGB1表達可抑制阿霉素的心臟毒性。提示HMGB1可能是HF治療的有效靶點。JAK/STAT信號通路作為一個進化保守的信號轉導通路,參與多種細胞過程,如炎癥、凋亡、細胞周期調控等[24]。研究表明,JAK2/STAT3通路的激活已被確定為心肌炎癥相關的內在轉導途徑[25]。本研究檢測HMGB1蛋白和JAK2/STAT3通路蛋白表達發現,HF大鼠心肌組織中HMGB1蛋白表達量、p-JAK2/JAK2和p-STAT3/STAT3比值均明顯升高,提示HMGB1蛋白表達改變及JAK2/STAT3通路激活參與HF大鼠心肌病理損傷的發生、發展。而經過DHQ干預后,HF大鼠心肌組織中HMGB1蛋白表達量、p-JAK2/JAK2和p-STAT3/STAT3比值則明顯降低,且高劑量DHQ的干預效果明顯優于低劑量DHQ,與卡托普利療效相當。該結果提示DHQ通過抑制HMGB1表達和JAK2/STAT3信號通路活化減輕HF大鼠心肌損傷。
綜上所述,DHQ可通過減輕炎癥反應、氧化應激和抑制細胞凋亡保護HF大鼠心功能,其保護作用與抑制HMGB1表達和抑制JAK2/STAT3信號通路活化有關。本研究證實DHQ對于治療HF具有潛在價值,可作為HF治療的候選藥物。
志謝:川北醫學院藥學院陳陽老師在本實驗研究中提供的幫助與指導。

