球孢白僵菌催化苯甲酸合成對羥基苯甲酸液體發酵優化
劉宗求,劉雨,彭繼蘭,王金華,王永澤,高娃*
(1.工業發酵省部共建協同創新中心,武漢 430068;2.湖北工業大學 生物工程與食品學院, 武漢 430068;3.發酵工程教育部重點實驗室,武漢 430068)
對羥基苯甲酸(p-hydroxybenzoic acid,p-HBA)作為單羥基酚酸的一種,是植物體內的天然次生代謝物,可以有效抑制真菌和細菌生長[1-2]。以對羥基苯甲酸合成的對羥基苯甲酸酯類是常見的食品防腐劑[3],被廣泛應用于果凍、糕點、魚制品以及調味品等食品領域[4],一些常見的調味品,如沙拉醬、番茄醬、果醬以及豆瓣醬等均會添加適量的對羥基苯甲酸酯類(添加量<0.05%)作為防腐劑,可以有效防止或延緩食品調味品因微生物而導致的變質[5],此外,對羥基苯甲酸及其衍生物還具有保濕、抗氧化、抗炎等功效,被應用在化妝品領域[6]。在醫藥領域中,由于其抗炎、抗氧化、抗菌等功效也被廣泛應用[7]。總的來說,對羥基苯甲酸作為一種化學物質,其應用領域涉及食品、化妝品、醫藥等多個領域。
目前對羥基苯甲酸常用的合成方法是由苯酚(石油衍生物)在高溫、高壓條件下通過Kolbe-Schmitt反應合成[8],在合成過程中,會產生許多具有毒性的副產物[9],對環境造成嚴重污染。所以,研發出對羥基苯甲酸的綠色合成方法非常重要。
球孢白僵菌(Beauveriabassiana)是一種進行羥基化[10](生物催化反應)常見的催化劑,張倩等[11]首次報道了通過球孢白僵菌催化合成對羥基苯甲酸的途徑。本研究以球孢白僵菌B2660為研究對象,使用苯甲酸作為底物,旨在優化液體發酵過程中的影響因素。
1 材料與方法
1.1 材料
1.1.1 菌種
球孢白僵菌(Beauveriabassiana)B2660:由湖北工業大學發酵工程教育部重點實驗室保存于-80 ℃冰箱中。
1.1.2 培養基
基礎液體培養基:葡萄糖20 g/L,酵母粉10 g/L,MgSO4·7H2O 2 g/L,CaCl2·2H2O 1 g/L,K2HPO4·3H2O 2.36 g/L,KH2PO40.75 g/L,微量元素溶液50 mL/L,pH 7。
液體發酵培養基:向基礎液體培養基中添加5 g/L苯甲酸,并用6 mol/L NaOH調節pH至7。
微量元素母液:EDTA-2Na 2 000 mg/L,FeSO4·7H2O 600 mg/L,ZnSO4·7H2O 200 mg/L,MnSO4·H2O 150 mg/L,H3BO330 mg/L,CoCl2·6H2O 20 mg/L,CuCl2·2H2O 40 mg/L,NiCl2·2H2O 40 mg/L,Na2MoO4·2H2O 5 mg/L。
上述培養基均于121 ℃下滅菌20 min。
1.2 方法
1.2.1 種子液的制備
挑選球孢白僵菌單菌落接種于基礎液體培養基中,于28 ℃、200 r/min培養48~72 h(孢子濃度約為108個/mL)后備用。
1.2.2 球孢白僵菌在不同濃度苯甲酸下耐受性的確定
將培養好的種子液分別接種于含不同濃度苯甲酸的液體發酵培養基中,接種量為5%(體積比),苯甲酸添加量設定為0,1,2,3,4,5,6 g/L,每組實驗3個平行,培養溫度為28 ℃,發酵時間為5 d,發酵結束后取樣,檢測球孢白僵菌菌體干重和對羥基苯甲酸的產量。
1.2.3 液體培養基碳、氮源的評估
在上述實驗基礎上探究不同碳、氮源對對羥基苯甲酸產量的影響,碳源設定為葡萄糖、蔗糖、麥芽糖、乳糖、玉米淀粉和甘油,氮源設定為酵母粉、蛋白胨、牛肉膏、硝酸鈉、硫酸銨和硫脲,每組實驗3個平行,培養溫度為28 ℃,轉速為200 r/min,碳源濃度為20 g/L,氮源濃度為20 g/L,于發酵5 d后取樣,檢測培養基中對羥基苯甲酸的產量。
1.2.4 最佳碳、氮源濃度的確定
在上述實驗基礎上,先保持氮源濃度為20 g/L不變,依次調整碳源濃度為10,20,30,40 g/L;再保持碳源濃度為20 g/L,依次調整氮源濃度為5,10,15,20 g/L,分別替換發酵培養基中的碳、氮源進行發酵培養5 d,溫度為28 ℃,轉速為200 r/min,于發酵結束后取樣,檢測培養基中對羥基苯甲酸的含量。
1.2.5 發酵條件對發酵的影響
在上述實驗基礎上,分別探究初始pH、接種量和轉速對發酵的影響,初始pH設定為6,6.5,7,7.5,8;接種量設定為5%、10%、15%、20%、25%;轉速設定為160,180,200,220,240 r/min,每組實驗3次平行,于發酵5 d后取樣,檢測培養基中對羥基苯甲酸的含量。
1.2.6 響應面實驗設計
根據上述實驗結果,固定苯甲酸添加量為5 g/L,碳源為20 g/L玉米淀粉,氮源為10 g/L蛋白胨,以接種量、初始pH和發酵轉速作為自變量,對羥基苯甲酸的產量作為響應值Y,利用SAS軟件設計響應面實驗,并使用Origin軟件繪制響應面圖,確定最優液體發酵條件并對其進行驗證。
1.2.7 相關指標檢測以及計算方法
參考謝瑩瑩等[12]的HPLC檢測方法:柱溫45 ℃,檢測波長254 nm;采用AB雙泵系統,流速0.5 mL/min,進樣量10 μL,體積比為60∶40,流動相A為甲醇,流動相B為1%冰醋酸水溶液。
菌體干重計算公式為:
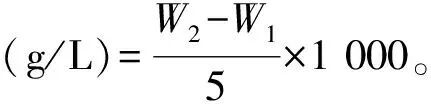
式中:W1表示9 cm直徑的濾紙在80 ℃烘箱中烘干至恒重的質量(g);W2表示5 mL發酵液離心后,將沉淀轉移至烘干至恒重的濾紙上,80 ℃再次烘干至恒重的質量(g)。
產率計算公式為:
式中:H0表示苯甲酸最初添加量(g/L);Q表示對羥基苯甲酸最終產量(g/L)。
2 結果與分析
2.1 球孢白僵菌在不同濃度苯甲酸下耐受性的確定
在球孢白僵菌催化苯甲酸合成對羥基苯甲酸的過程中,苯甲酸的添加量是影響菌體生長和產物積累的重要因素[13]。 在固定碳源為葡萄糖(20 g/L)、氮源為酵母粉(10 g/L)、初始pH為7.5的條件下,發酵5 d,結果見圖1。
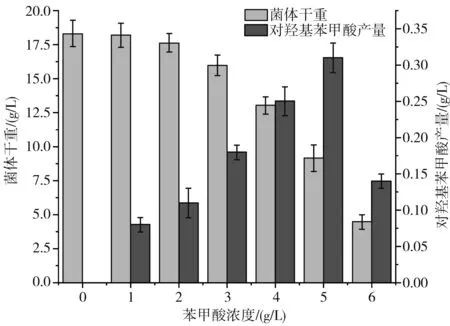
圖1 球孢白僵菌在不同濃度苯甲酸下的耐受性Fig.1 Tolerance of Beauveria bassiana under different concentrations of benzoic acid
由圖1可知,當底物濃度低于6 g/L時,隨著苯甲酸濃度的增加,球孢白僵菌的菌體干重逐漸降低,對羥基苯甲酸產量則先升高后降低。當苯甲酸濃度為5 g/L時,對羥基苯甲酸的產量達到最大值0.32 g/L,此時菌體干重為9.13 g/L。當苯甲酸添加量達到6 g/L時,對羥基苯甲酸的產量僅為0.14 g/L,同時菌體干重下降至4.48 g/L。結果表明苯甲酸的濃度設定為5 g/L時,球孢白僵菌具有較好的耐受性和催化效果。
2.2 液體培養基碳、氮源的評估
根據陳偉等[14]、張亞平等[15]的報道,碳、氮源是微生物生長所需的最基本的營養物質。碳源不僅是細胞組成的碳骨架,而且是維持菌體活動的能量來源;氮源是細胞合成蛋白質和核酸的必需原料。由于不同菌株對碳、氮源的需求和利用情況不同,因此研究發酵培養基中碳、氮源的使用非常必要。本研究選取了常見的6種碳源和6種氮源進行考察。在固定碳、氮源濃度為20 g/L,其他外部因素不變的情況下,分別改變碳源和氮源種類,進行了5 d的發酵,結果見圖2。
由圖2中a可知,當固定氮源為酵母粉(20 g/L)時,球孢白僵菌催化苯甲酸合成對羥基苯甲酸的能力與不同的液體發酵培養基碳源有關。結果顯示,碳源不同,對羥基苯甲酸的產量有差異,對羥基苯甲酸產量由大到小為玉米淀粉>甘油>乳糖>麥芽糖>葡萄糖>蔗糖。球孢白僵菌B2660利用玉米淀粉作為碳源時,對羥基苯甲酸的產量最高,為2.41 g/L,說明用玉米淀粉作為發酵培養基的碳源更有利于對羥基苯甲酸的積累。
由圖2中b可知,當固定碳源為葡萄糖(20 g/L)時,球孢白僵菌催化苯甲酸合成對羥基苯甲酸的能力與不同的液體發酵培養基氮源有關。結果顯示,氮源不同,對羥基苯甲酸的產量有差異,對羥基苯甲酸產量由大到小為蛋白胨>酵母粉>牛肉膏>硫酸銨>硝酸鈉>硫脲。可以明顯看出,有機氮源更有利于球孢白僵菌催化苯甲酸合成對羥基苯甲酸,最優的氮源為蛋白胨,對羥基苯甲酸產量為0.48 g/L。因此,后續研究選取玉米淀粉和蛋白胨作為液體發酵培養基的碳、氮源,進一步優化碳、氮源濃度,旨在提高對羥基苯甲酸的產量。
2.3 最佳碳、氮源濃度的確定
對于不同微生物菌株,其對碳、氮源的需求和利用情況也存在差異,適宜的營養條件可以提高微生物對碳、氮源的利用效率,促進微生物代謝通路的運轉,同時也可以避免營養濃度過高或過低對微生物生長產生的負面影響[16],因此需要通過優化實驗來確定最適宜的碳、氮源濃度。
在上述實驗得到最佳碳、氮源的基礎上進行了碳、氮源濃度的優化,先保持氮源濃度為20 g/L不變,依次設定碳源濃度為10,20,30,40 g/L,分別替換液體發酵培養基中的碳源進行發酵培養5 d,結果見圖3中a。當固定氮源濃度為20 g/L時,對羥基苯甲酸的產量隨著玉米淀粉濃度的增加呈現先增后減的趨勢,并在玉米淀粉濃度為20 g/L時,產量達到最大值(2.43±0.02) g/L。
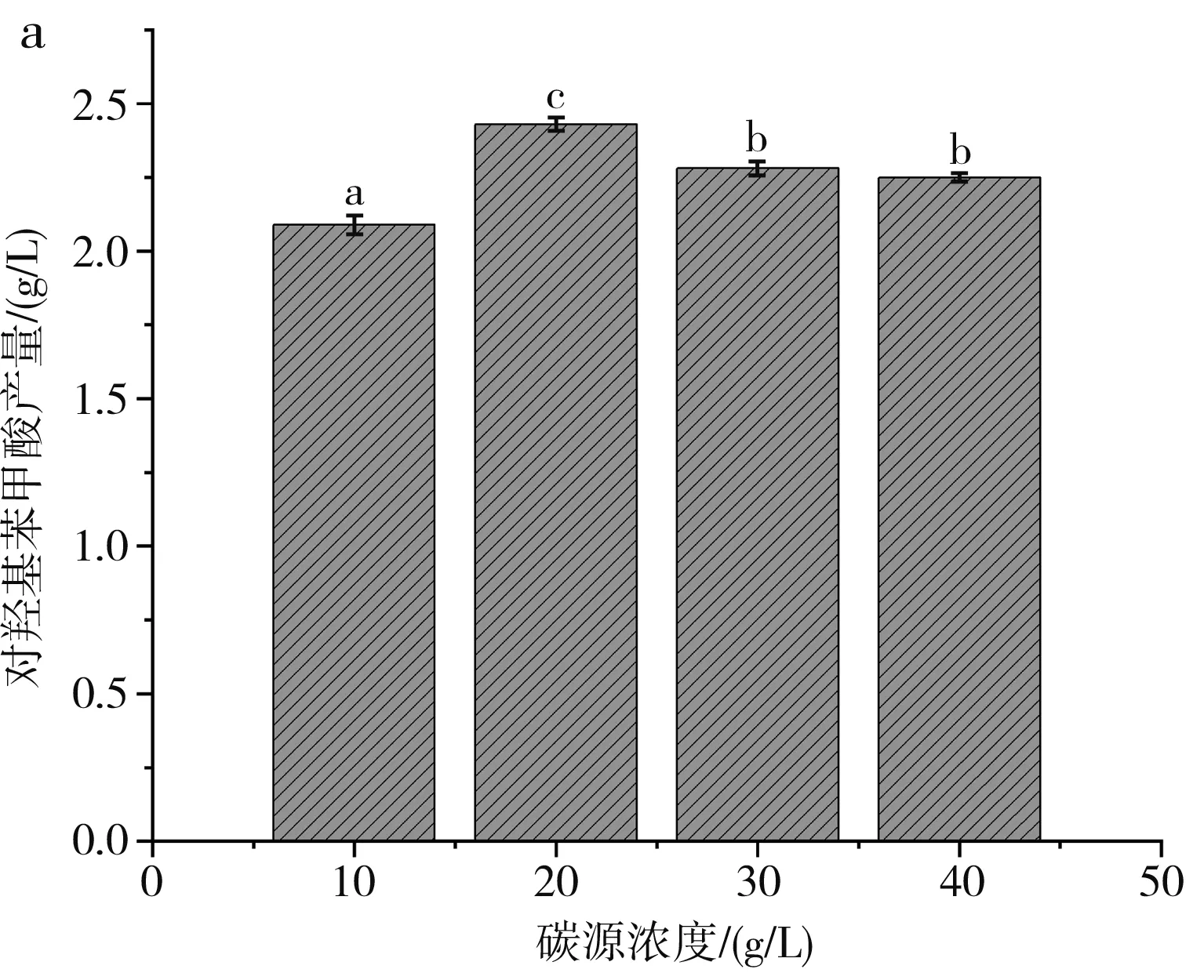
圖3 不同碳、氮源濃度對對羥基苯甲酸產量的影響Fig.3 Effect of different carbon and nitrogen source concentrations on the yield of p-hydroxybenzoic acid
固定碳源玉米淀粉濃度為20 g/L,依次設定氮源濃度為5,10,15,20 g/L,分別替換液體發酵培養基中的氮源進行發酵培養5 d,結果見圖3中b。當氮源濃度為10 g/L時,對羥基苯甲酸的產量達到最大值(2.66±0.02) g/L。
綜上所述,球孢白僵菌B2660催化苯甲酸合成對羥基苯甲酸液體發酵培養基的最優碳、氮源濃度為玉米淀粉20 g/L和蛋白胨10 g/L。
2.4 初始pH、接種量和轉速對發酵的影響
在上述實驗基礎上,對液體發酵過程中的初始pH、接種量和轉速進行優化,旨在提高球孢白僵菌催化苯甲酸合成對羥基苯甲酸的能力。
2.4.1 初始pH對發酵的影響
苯甲酸是一種常見的防腐劑,其抑菌和殺菌作用很大程度上受pH值的影響[13]。因此,在液體發酵過程中,選擇適宜的初始pH值可以有效幫助菌株生長發育并維持菌株的催化能力。
在固定碳源為玉米淀粉(20 g/L)、氮源為蛋白胨(10 g/L)、發酵溫度為28 ℃的情況下,使用6 mol/L NaOH和3.3 mol/L HCl調節發酵培養基的初始pH值,探究不同初始pH值對對羥基苯甲酸產量的影響,結果見圖4。
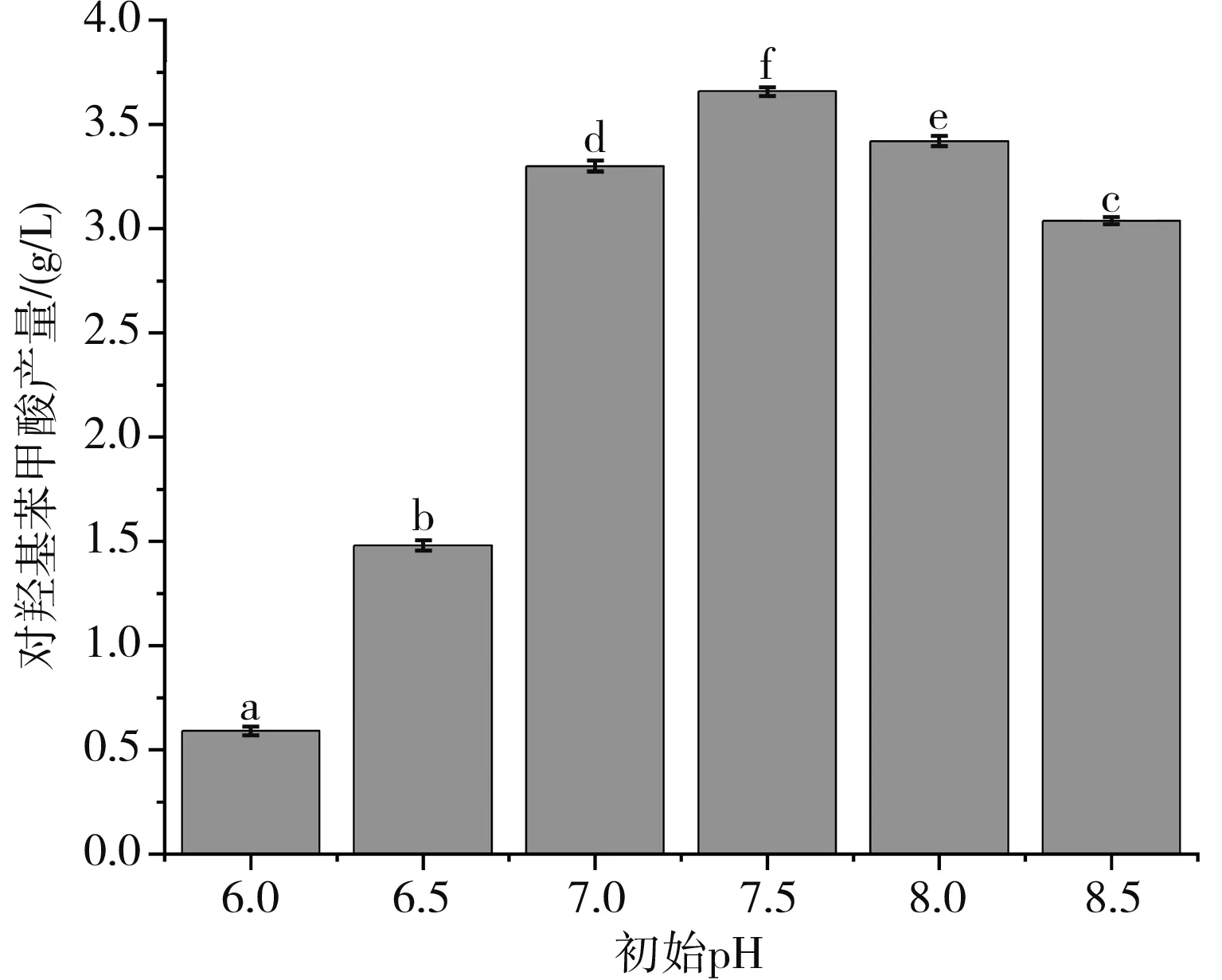
圖4 不同初始pH值對對羥基苯甲酸產量的影響
由圖4可知,初始pH值的不同會導致對羥基苯甲酸的產量不同。當初始pH值為7.0時,對羥基苯甲酸產量為3.3 g/L,當初始pH值下降至6.5時,對羥基苯甲酸產量下降至1.48 g/L,當初始pH值進一步下降至6.0時,對羥基苯甲酸產量僅為0.59 g/L,表明在pH值6.0~7.5范圍內,初始pH值越低,球孢白僵菌催化苯甲酸合成對羥基苯甲酸的能力越弱,當初始pH為7.5時,對羥基苯甲酸產量達到最大值,為3.66 g/L。但是隨著初始pH的進一步增加,對羥基苯甲酸的產量逐漸降低。
2.4.2 接種量對發酵的影響
接種量影響著微生物的生長發育和生物代謝,接種量過低會導致發酵液中菌體含量偏低,微生物生長緩慢,接種量過高會導致微生物黏度增加,溶解氧不足[17]。在固定碳源為玉米淀粉(20 g/L)、氮源為蛋白胨(10 g/L)、發酵溫度為28 ℃、初始pH為7.5的情況下,考察接種量對對羥基苯甲酸產量的影響,結果見圖5。
由圖5可知,當接種量在5%~25%時,隨著接種量的增加,對羥基苯甲酸的產量呈現先升高后降低的趨勢,當接種量為15%時,對羥基苯甲酸產量達到最大值,為3.73 g/L,因此,以15%接種量為依據進行后續響應面實驗優化。
2.4.3 轉速對發酵的影響
在液體發酵過程中,轉速對培養基中的溶氧效率起著決定性作用。通常情況下,轉速越高,培養基中的溶解氧含量越充足,有利于微生物的生長和代謝。但是當轉速超過一定閾值時,會產生較強的剪切力,對菌體造成損害[18],因此需要選擇適宜的轉速,以更好地維持球孢白僵菌的正常生長和催化能力。
由圖6可知,在本實驗中,在固定碳源為玉米淀粉(20 g/L)、氮源為蛋白胨(10 g/L)、發酵溫度為28 ℃、初始pH為7.5、接種量為15%的情況下,探究了轉速對對羥基苯甲酸產量的影響。結果表明,隨著轉速的升高,對羥基苯甲酸產量逐漸升高,并在200 r/min時達到最大值(3.74 g/L),隨著轉速進一步升高,對羥基苯甲酸產量開始逐漸降低。以上結果表明,在液體發酵過程中,選擇適宜的搖床轉速非常重要,可以優化溶氧效率,提高對羥基苯甲酸的產量。
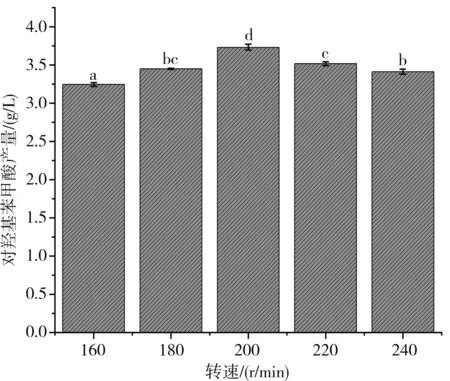
圖6 不同轉速對對羥基苯甲酸產量的影響Fig.6 Effect of different rotation speeds on the yield of p-hydroxybenzoic acid
2.5 響應面實驗結果
根據單因素實驗分析結果,固定碳源為20 g/L玉米淀粉,氮源為10 g/L蛋白胨,溫度為28 ℃,選擇接種量、初始pH和轉速作為自變量,以發酵第5天時對羥基苯甲酸的產量作為響應值(Y),響應面分析實驗通過SAS軟件設計,確定最佳的液體發酵條件并進行驗證。根據Box-Behnken實驗設計原理設計實驗因素水平表,見表1。

表1 Box-Behnken實驗因素和水平Table 1 Box-Behnken experimental factors and levels
2.5.1 模型設計與分析
依據Box-Behnken實驗設計原理,通過SAS軟件設計了n=15的響應面分析實驗,實驗設計與結果見表2。
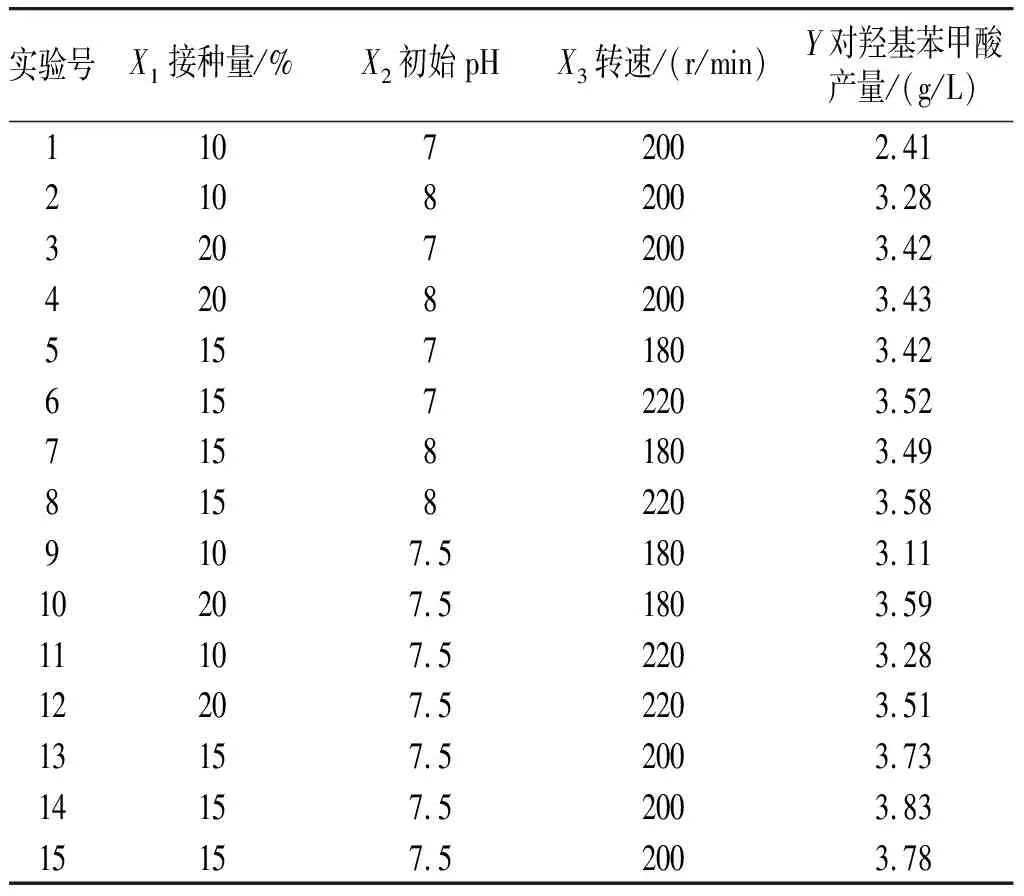
表2 Box-Behnken實驗設計和結果Table 2 Box-Behnken experimental design and results
以發酵5 d時對羥基苯甲酸的產量(Y)作為響應值,根據表2中的Box-Behnken實驗結果,利用SAS軟件對該數據進行二次回歸分析,得到回歸方程[19]:Y=-74.098 6+1.307 536X1+16.755 71X2+0.037 83X3-0.015 41X12-0.089X1X2-0.000 65X1X3-1.009 048X22-0.000 202X2X3-0.000 062X32。
由表3可知,該響應面模型顯著(P<0.05),失擬項不顯著(P=0.072 7>0.05),表明該模型在研究區域擬合較好,決定系數R2=0.937 4,表明預測有6.26%的變異情況不能由該模型解釋,調整決定系數RAdj2=0.824 6,剔除自變量個體對R2的影響系數為0.824 6,表明該回歸方程具有較好的擬合水平。綜上可知,該回歸方程適合對球孢白僵菌B2660液體發酵對羥基苯甲酸條件進行分析和預測。
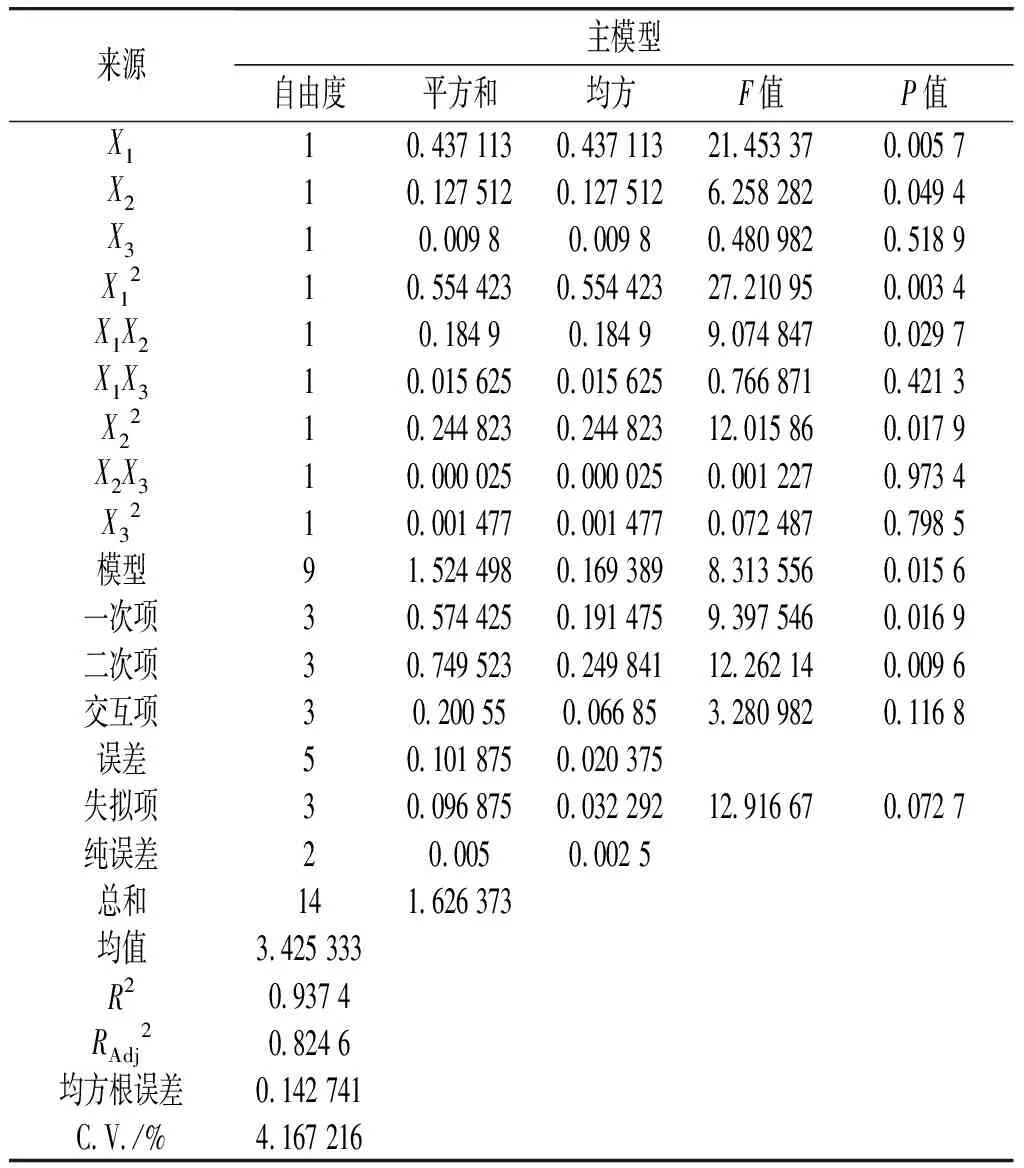
表3 響應面實驗回歸模型方差分析Table 3 Analysis of variance of response surface experimental regression model
2.5.2 各因素響應面交互作用分析
以2.5.1中的回歸方程為依據,利用Origin軟件繪制響應面分析圖,確定接種量、初始pH和轉速對球孢白僵菌催化苯甲酸合成對羥基苯甲酸產量的影響[20],響應面和等高線圖見圖7。
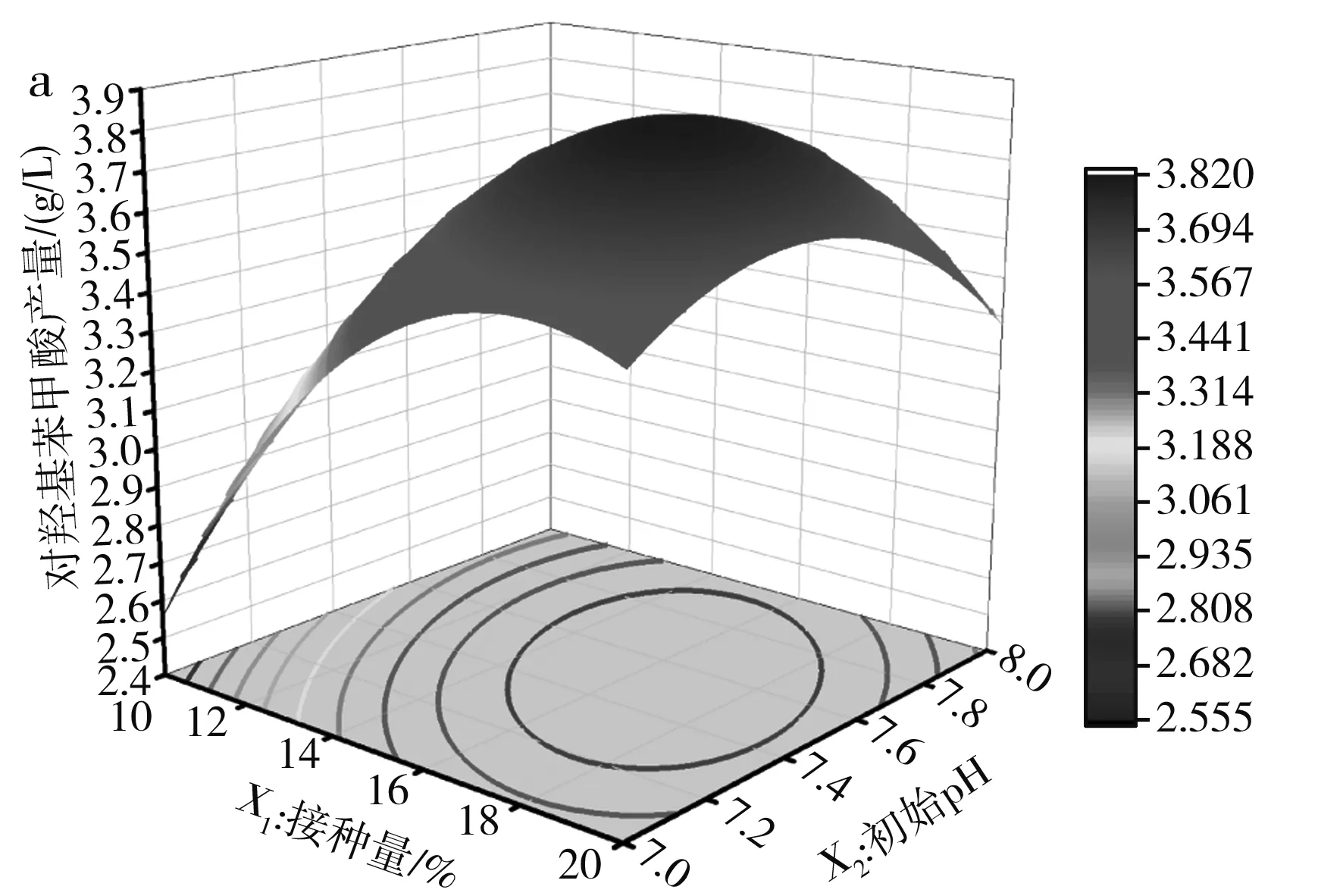
圖7 各因素交互作用對對羥基苯甲酸產量影響的響應面和等高線圖Fig.7 Response surface diagrams and contour lines of the effect of interaction of various factors on the yield of p-hydroxybenzoic acid
由圖7可知,各因素最優水平均在所選范圍內,對球孢白僵菌催化苯甲酸合成對羥基苯甲酸產量的影響越大,其響應面圖傾斜度越高。結合表3和圖7可以看出,實驗所選的3個因素均具有很好的交互作用,且交互作用強弱為X1X2>X1X3>X2X3。
2.5.3 響應面模型結果預測與檢驗
從以上實驗可以得出球孢白僵菌催化苯甲酸合成對羥基苯甲酸的液體發酵過程中最適苯甲酸添加量為5 g/L,最優碳、氮源組合為玉米淀粉20 g/L和蛋白胨10 g/L,發酵溫度為28 ℃,初始pH值為7.5,轉速為200 r/min,接種量為17.5%。按照此條件進行驗證,對羥基苯甲酸的產量可達3.85 g/L,產率為76.69%,與理論數據(產量為3.80 g/L,產率為75.72%)較吻合,說明此次優化方案可行。
3 結論
本文對球孢白僵菌催化苯甲酸合成對羥基苯甲酸在液體發酵過程中的碳、氮源和發酵條件進行了優化。最終確定了液體發酵過程中最適苯甲酸添加量為5 g/L,最優碳、氮源組合為玉米淀粉20 g/L和蛋白胨10 g/L,發酵溫度為28 ℃,初始pH為7.5,轉速為200 r/min,接種量為17.5%。按照此條件進行驗證,對羥基苯甲酸的產量可達3.85 g/L,產率為76.69%。相較于優化前,對羥基苯甲酸產量(0.31 g/L)提升了約12倍。相較于張倩等[11]利用球孢白僵菌B2660進行全細胞催化苯甲酸(2 g/L)合成對羥基苯甲酸(1.2 g/L),催化底物濃度提高2.5倍,產量提升3.18倍。
Meijnen等[21]將外源基因導入惡臭假單胞菌上,以木糖和甘油作為混合底物合成對羥基苯甲酸,產率最高為16.3 Cmol%。Peng等[22]和Quévrain等[23]發現微泡菌Microbulbifersp. A4B-17可以生產對羥基苯甲酸,產量可達10 mg/L。與上述研究相比,本研究在產率和產量方面均有明顯提高。
綜上所述,本研究中對羥基苯甲酸產量得到了一定的提升,同時也為利用微生物液體發酵苯甲酸合成對羥基苯甲酸提供了新的研究思路。

