改良增菌條件應用于Soleris系統對食品中沙門氏菌的檢驗
姚盧悅,陳麗花
(1.上海應用技術大學 香料香精技術與工程學院,上海 201418;2.普研(上海)標準技術服務有限公司,上海 201318)
沙門氏菌(Salmonella)是一種常見的食源性致病微生物,由其引發的病例報道較多見[1-3]。因此,沙門氏菌的檢驗是食品生產、流通和銷售等消費環節中十分重要的微生物監測項目。
食品中沙門氏菌檢驗的現行國家標準方法是GB 4789.4-2016[4],檢驗周期為5~7 d。為滿足對快檢法準確兼具高效的應用需求,近年來酶聯免疫法[5-6]、PCR法[7-10]、ATP熒光法[11]、流式細胞儀法[12]和質譜法[13-14]等檢測技術快速發展,還出現了多技術平臺聯用的快檢方法[15-17],但是受限于場地、設備操作和人員技術能力等問題較難大規模推廣。而Soleris系統則復合了光學檢測和培養模塊,其應用研究多見于乳制品、保健品等中的菌落總數、大腸菌群等的快檢[18-19]。該系統通過光學檢測器對獲得實時系統特征值檢出時間(DT值),達到快速預警的檢測目的,通過多個培養模塊疊加可實現批量化、多樣化檢驗的優勢。
按照Soleris系統對食品中沙門氏菌進行檢驗的操作程序,其增菌步驟采用胰蛋白胨大豆肉湯(trypticase soy broth,TSB)于36 ℃培養24 h。隨后將增菌培養物以1.0 mL體積轉移到氯化鎂孔雀綠肉湯(Rappaport-Vassiliadis broth,RV)中42 ℃選擇性增菌 8 h。相較于使用TSB的增菌方法,我國國家標準方法中緩沖蛋白胨水(buffered peptone water,BPW)的使用更廣泛,配制成本也更低廉。本試驗以保證Soleris系統沙門氏菌檢驗檢出率為前提,著力于Soleris法增菌條件的優化和改良,通過與國家標準檢測法等效性研究為采用此法進行食品中沙門氏菌檢驗提供了參考。
1 試驗材料與方法
1.1 培養基及試劑
S2-SAL沙門氏菌檢測試劑瓶、S2-SALI沙門氏菌檢測添加劑:紐勤生物科技(上海)有限公司;緩沖蛋白胨水(buffered peptone water,BPW)、胰蛋白胨大豆肉湯(trypticase soy broth,TSB)、胰蛋白胨大豆瓊脂培養基(trypticase soy agar,TSA)、腦心浸液肉湯(brain heart infusion broth,BHI)、氯化鎂孔雀綠肉湯(Rappaport-Vassiliadis broth,RV)、平板計數瓊脂(plate count agar,PCA):北京陸橋技術股份有限公司;氯化鈉:國藥集團化學試劑有限公司;API 20E生化鑒定條:梅里埃診斷產品(上海)有限公司。
1.2 試驗用菌株
本研究所使用的菌株見表1。

表1 測試菌種Table 1 Tested strains
1.3 待檢樣品準備
將從市場上獲得的已經完成國標法沙門氏菌檢測并生化鑒定為沙門氏菌陽性的豬肉和牛肉樣品以25 g/份的量各分裝成10份,共計20份樣品。
1.4 試驗儀器與設備
Soleris微生物快速檢測儀 紐勤生物科技(上海)有限公司;移液器 Eppendorf中國有限公司;BWS-12恒溫水浴鍋、DHP-9272生化培養箱 上海一恒科學儀器有限公司;DC-05低溫循環水槽 江蘇天翎儀器有限公司;MQD-S2NR振蕩培養箱 上海旻泉儀器有限公司。
1.5 試驗方法與過程
1.5.1 熱損傷菌懸液的制備
參考謝雨龍等[20]、張佩佩等[21]對沙門氏菌熱失活的研究,將試驗菌接種到BHI中37 ℃振蕩4 h;吸取1 mL培養物到60 ℃的9 mL生理鹽水管中,立即水浴3 min;轉移1 mL熱處理菌液到4 ℃的9 mL生理鹽水管中獲得熱損傷菌懸液。
1.5.2 前增菌生長比較試驗
按照增菌液種類將試驗組分為BPW組和TSB組。將熱受損沙門氏菌逐級10倍稀釋,制成濃度約為102~103CFU/mL的菌液,取1 mL接種到BPW和TSB中,使增菌液中的沙門氏菌起始濃度約為1~10 CFU/mL。以增菌液添加菌液的時間為起點,做0 h菌落計數,每2 h取培養物進行菌落計數,以生長對數值繪制生長曲線,評價沙門氏菌在不同培養液和不同增菌時間下的修復生長情況。
1.5.3 選擇性增菌優化試驗
前增菌培養物分別按照1.0 mL和0.1 mL的接種體積接種到RV中,42 ℃培養8 h后按照GB 4789.28-2013[22]對微生物的生長情況進行定性和半定量分析。
1.5.4 Soleris系統試驗
取0.1 mL RV培養物接種到S2-SAL試劑瓶中,按照沙門氏菌檢驗程序(見表2)上機檢驗。

表2 沙門氏菌儀器檢測參數設置Table 2 Parameter setting of Salmonella instrument detection
1.5.5 樣品沙門氏菌檢驗
從20份已檢出沙門氏菌的肉類樣品中隨機抽取牛肉和豬肉各5份進行熱處理作為熱損傷測試組,剩余樣品作為自然樣品組,備用。在25 g樣品中加入225 mL BPW預增菌18 h,隨后各自按照國標法和Soleris法進行后續檢測,比較國標法與Soleris法的試驗結果,驗證方法的可行性。
1.6 試驗數據處理
采用Excel 2019、Origin 2019b進行數據和圖表的基本處理,采用 IBM SPSS Statistics 23進行t檢驗分析。
2 結果與分析
2.1 BPW組與TSB組生長試驗結果比較
對不同培養時間的TSB和BPW培養物進行菌落計數,計算各自的生長對數值,繪制生長曲線,見圖1和圖2。
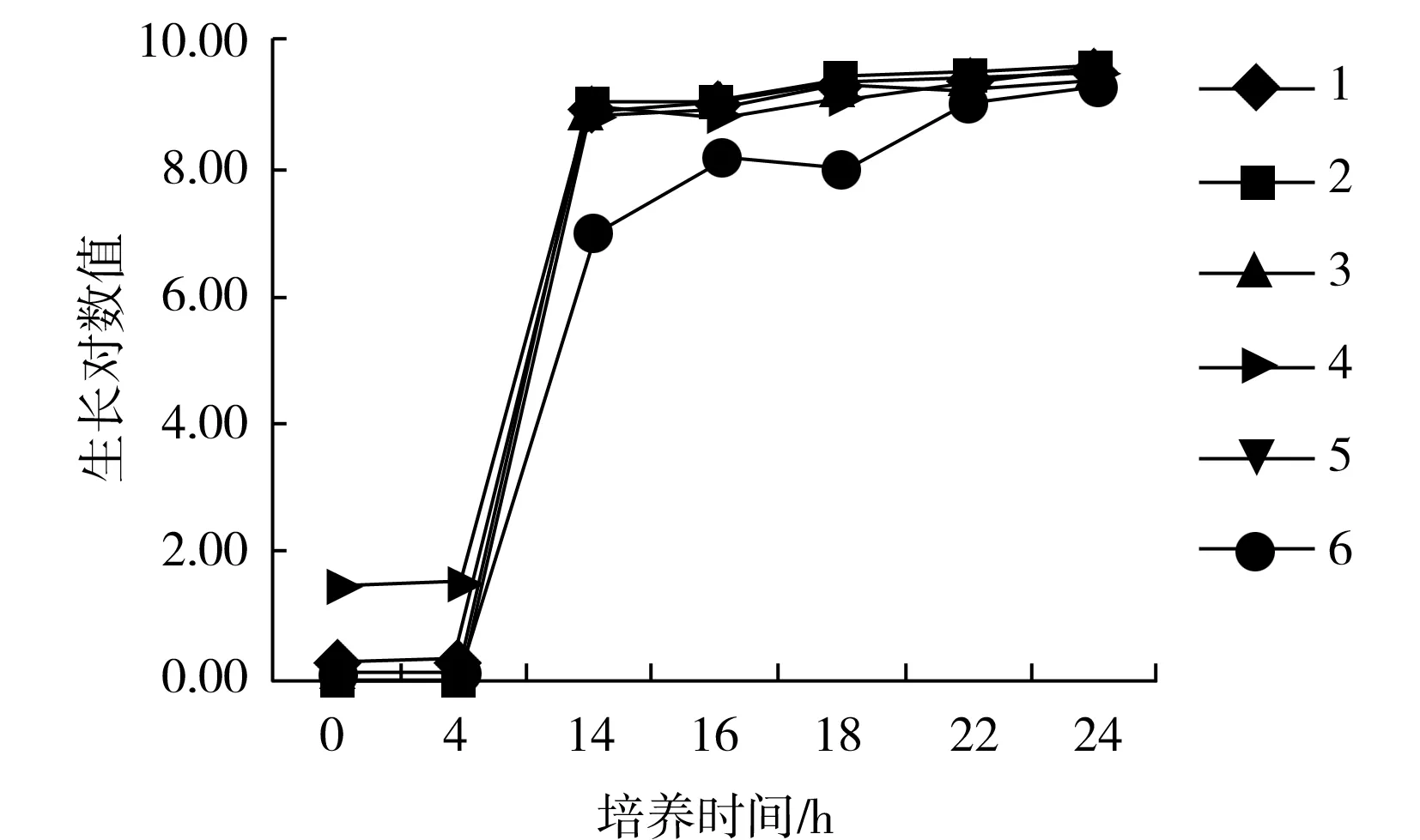
圖1 TSB組沙門氏菌生長曲線Fig.1 Salmonella growth curve of TSB group
運用SPSS中的獨立樣本t檢驗分析兩個試驗組中熱受損沙門氏菌在不同培養時間下沙門氏菌的生長對數值,獲得兩個試驗組中熱受損沙門氏菌的生長是否存在顯著性差異的結果,見表3。
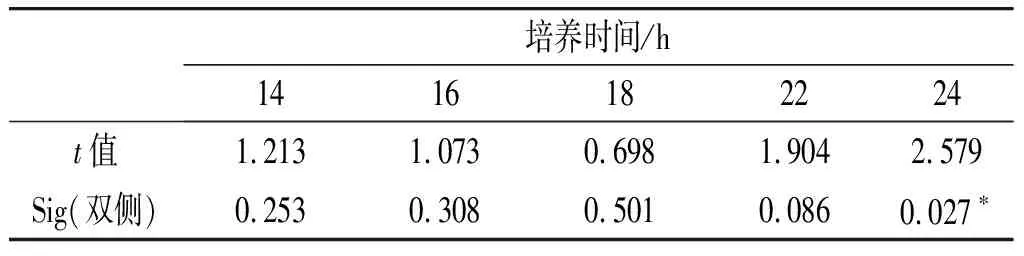
表3 TSB組和BPW組生長對數值顯著性分析
由表3可知,BPW 和TSB兩種培養基的增菌效果在14,16,18,22 h時無顯著差異(P>0.05),僅在24 h時增菌效果產生了差異(P<0.05)。
繪制肺炎克雷伯氏菌和奇異變形桿菌的熱受損菌的生長曲線后發現:奇異變形桿菌在BPW中的生長效率遠遠低于TSB(見圖3和表4);肺炎克雷伯氏菌在不同增菌時間下的平均生長對數值比TSB組的平均生長對數值低0.83。因此采用BPW進行前增菌對控制干擾菌、增強試驗選擇性有重要的意義,但是隨著增菌時間的增加,生長對數值差值逐漸縮小。
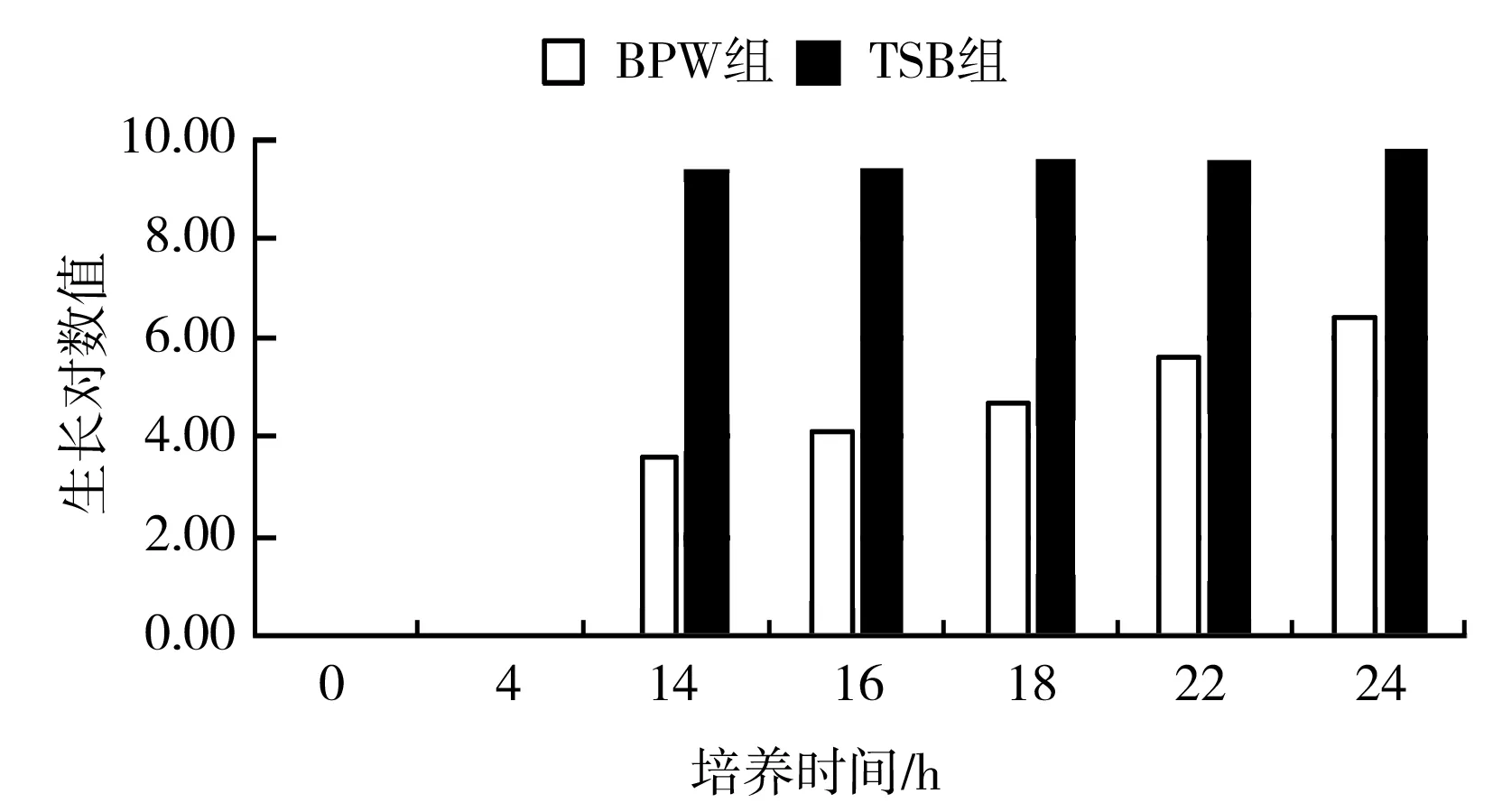
圖3 奇異變形桿菌增菌效果比較Fig.3 Comparison of Proteus mirabilis's enrichment effect

表4 不同培養時間奇異變形桿菌生長對數值比較Table 4 Comparison of Proteus mirabilis's growth logarithms at different cultivation time
2.2 選擇性增菌試驗結果分析
參考GB 4789.28-2013[22]中的方法對接種后的RV肉湯進行濁度觀察:采用1.0 mL接種體積增菌8 h后沙門氏菌陽性對照管與陰性對照管相比濁度有明顯變化,肺炎克雷伯氏菌和奇異變形桿菌的接種管濁度與沙門氏菌管相近;采用0.1 mL接種體積增菌8 h后各管濁度變化無法用肉眼判斷是否與陰性對照管存在差異,因此采用半定量劃線法對RV培養物生長情況進行確認,結果見表5。
由表5可知,對半定量劃線結果進行計算,沙門氏菌平均G值為8.75,證明采用0.1 mL接種體積仍可使沙門氏菌獲得良好的生效效果,且對常見的試驗干擾菌肺炎克雷伯氏菌和奇異變形桿菌起到抑制其生長的作用。所以,控制和改良RV接種體積能夠進一步保持沙門氏菌的生長優勢,增強Soleris方法的選擇性。
2.3 Soleris系統檢驗結果
18 h培養物前增菌后分別按照Soleris法和國標法進行后續測試,BPW組和TSB組24 h培養物增菌后按照Soleris法測試,記錄各試驗組DT值(見圖4和圖5)。
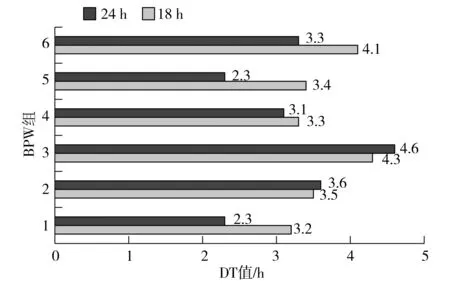
圖4 BPW組DT值Fig.4 DT value of BPW group
對各組DT值(系統檢出時間)進行分析,BPW組前增菌培養18 h和24 h后 Soleris DT值平均為3.63 h和3.20 h;TSB組前增菌培養18 h和24 h后 Soleris DT值平均為3.72 h和3.10 h。由顯著性分析可知,BPW組前增菌18 h和24 h后t值為1.084,Sig(雙側)P=0.304>0.05;TSB組前增菌18 h和24 h后t值為1.291,Sig(雙側)P=0.226>0.05。將BPW組和TSB組前增菌18 h后的DT值進行計算,t值為0.274,Sig(雙側)P=0.790>0.05,將BPW組和TSB組前增菌24 h后的DT值進行計算,t值為0.585,Sig(雙側)P=0.858>0.05。由t檢驗可知,經過18 h前增菌與RV增菌,TSB組與BPW組DT值間無顯著差異,24 h TSB組與BPW組DT值間也無顯著差異,且兩組組內18 h前增菌和24 h前增菌的DT值也無顯著差異。
2.4 樣品測試結果
樣品分為熱損傷組和對照組,經過Soleris法和國標法的比對測試,測試結果見表6。
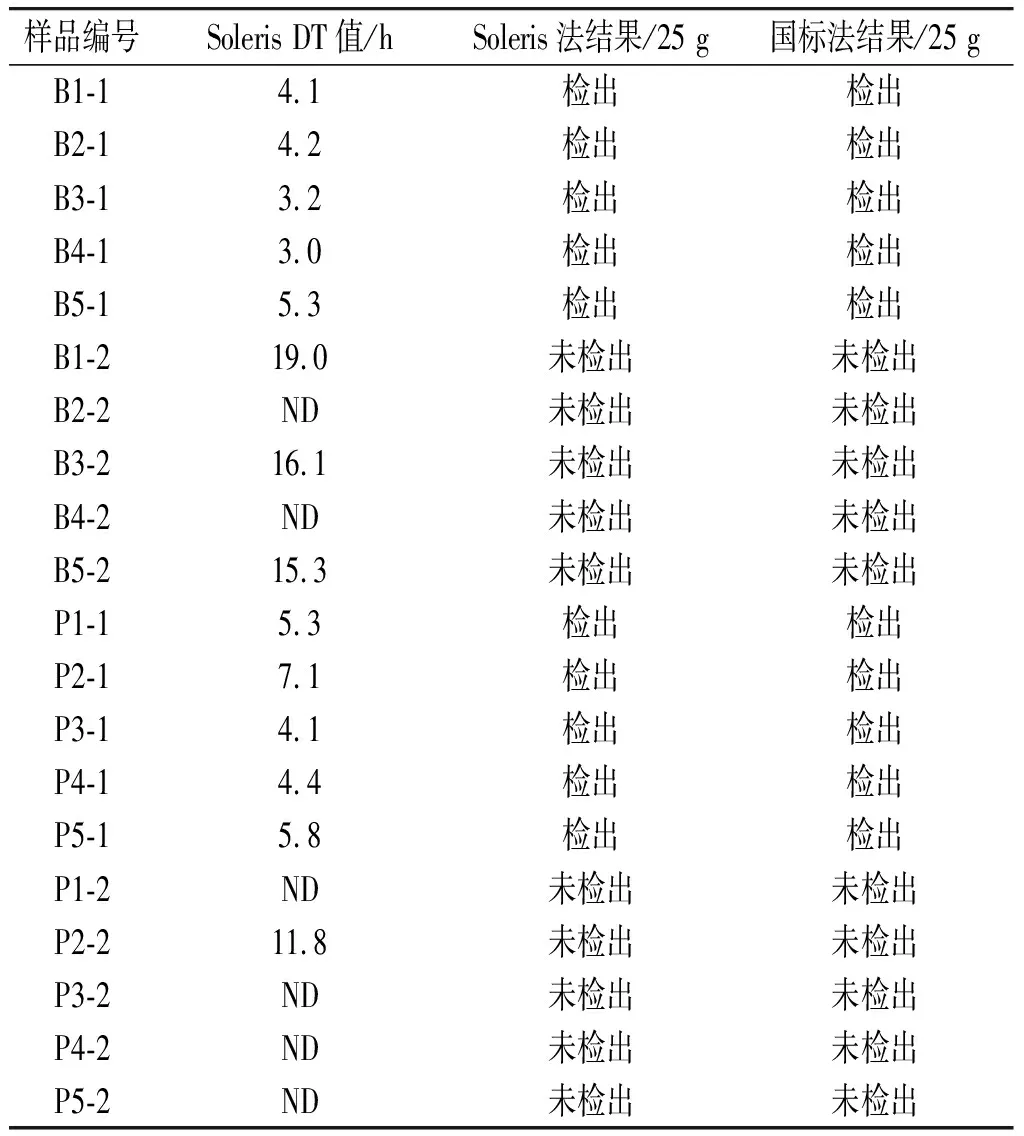
表6 樣品檢驗結果(沙門氏菌檢驗)Table 6 Detection results of samples (Salmonella detection)
表6中B1-1~B5-1為牛肉樣品的自然樣品組,B1-2~B5-2為熱處理牛肉組;P1-1~P5-1為豬肉自然樣品組,P1-2~P5-2為熱處理豬肉組。通對對20份樣品的檢測結果進行匯總和分析:10份自然陽性樣品均有沙門氏菌檢出。陽性牛肉樣品的Soleris系統DT值平均為4.0 h,陽性豬肉樣品的DT值平均為4.3 h。經過熱處理的生肉樣品中雖然B1-2、B3-2、B5-2、P2-2 4個樣品有DT值檢出,經選擇性分離和API生化鑒定確認為非沙門氏菌。對Soleris系統判定為“ND”的S2-SAL陰性試劑瓶進行表觀觀察,未觀察到明顯變化,因此將瓶中培養液進行劃線培養,分離平板上無菌生長。陰性結果試劑瓶繼續培養24 h,表觀無變化,劃線培養后也無菌生長,因此排除假陰性的可能。20份肉類樣品的Soleris法檢測結果與國標法檢測結果一致,對于低風險樣品的沙門氏菌從預增菌至Soleris檢驗完成僅需46 h,比國標法檢驗速度更快。
3 討論與小結
經過對BPW生長率的研究表明增菌14,16,18,22 h其增菌效果與采用TSB增菌無顯著性差異,僅采用24 h兩種增菌液的增菌效率才出現顯著差異。通過RV接種量比較培養試驗,以0.1 mL前增菌培養物進行Soleris法的選擇性增菌,沙門氏菌的平均生長G值為8.75,在保持目標菌良好的增菌效率前提下能夠有效抑制肺炎克雷伯氏菌和奇異變形桿菌這兩種食品沙門氏菌檢驗中常見的干擾菌的增殖,提高了方法的選擇性。以18 h和24 h兩個重點前增菌考察時間完成整個Soleris沙門氏菌試驗后發現:樣品中沙門氏菌含量越高,Soleris檢出DT值越小;BPW組18 h和24 h平均DT值為3.63 h和3.72 h,TSB組18 h和24 h平均DT值為3.20 h和3.10 h,進行DT值顯著性分析,BPW組和TSB組組內、BPW組和TSB組組間18 h和24 h DT值均無顯著差異。經過改良前增菌液種類和增菌時間、改進RV接種量對Soleris系統上機檢驗無顯著影響。因此,以BPW作為Soleris法檢測沙門氏菌的前增菌液增菌18 h,以0.1 mL體積轉接RV進行后續試驗的增菌條件不僅能提高Soleris檢測過程中對干擾菌的抑制,而且保持了Soleris系統的高度響應。
將由市場上獲得的沙門氏菌陽性肉類食品樣品分成自然樣品組和熱處理樣品組,采用Soleris法以改良后的條件進行沙門氏菌檢驗,Soleris系統對有DT值檢出的樣品進行實時檢測的同時保持了快速預警的優勢;對于Soleris系統報告為陰性的樣品,全部檢測時間僅需要46 h,且無假陰性發生,從而節省了鑒定試驗和人員投入等測試成本。綜合樣品檢測結果,Soleris法檢驗結果與國標法檢測結果完全一致,從而證明了采用Soleris法進行食品中沙門氏菌檢驗具有一定的應用推廣意義。本試驗主要集中于陽性菌驗證、肉類陽性樣本和熱處理樣本的試驗,對其他食品類型樣品的實際檢驗應用還需要進一步進行適用性研究。

