血清Lp-PLA2、Cys-C水平與HBV感染肝硬化患者Child-Pugh分級(jí)的關(guān)聯(lián)性
田二軍,姜楠,王濱,陳超華
平頂山市第一人民醫(yī)院檢驗(yàn)科,河南 平頂山 467000
乙型肝炎病毒(hepatitis B virus,HBV)可引起急性/慢性乙型肝炎、肝硬化、肝癌等嚴(yán)重肝臟疾病,我國(guó)HBV 感染者多達(dá)1.2億,HBV持續(xù)感染可導(dǎo)致肝硬化發(fā)生,隨著病情進(jìn)展,可發(fā)展為原發(fā)性肝癌[1-2]。肝臟活檢是判斷肝硬化病情嚴(yán)重程度的“金標(biāo)準(zhǔn)”,但取樣區(qū)域受病理醫(yī)生的主觀影響,導(dǎo)致檢驗(yàn)結(jié)果可能存在偏差,同時(shí)活檢難以長(zhǎng)期監(jiān)測(cè)患者病情,因而尋找有效診斷指標(biāo)用于評(píng)估病情進(jìn)展成為研究重點(diǎn)。脂蛋白相關(guān)磷脂酶A2(lipoprotein associated phospholipase A2,Lp-PLA2)屬于特異性血管炎性因子,可提高細(xì)胞因子表達(dá),促進(jìn)內(nèi)皮細(xì)胞凋亡,且與乙肝肝硬化病情進(jìn)展有關(guān)[3]。胱抑素C(Cystatin C,Cys-C)屬于半胱氨酸蛋白酶抑制劑超家族成員,且與肝腎組織纖維化發(fā)生有關(guān),可參與肝腎病變過(guò)程[4-5]。目前Lp-PLA2、Cys-C 與HBV 感染肝硬化相關(guān)研究相對(duì)較少。本研究主要檢測(cè)HBV 感染肝硬化患者血清Lp-PLA2、Cys-C 水平,分析其與Child-Pugh 分級(jí)、肝硬化程度相關(guān)性,為臨床診治提供參考。
1 資料與方法
1.1 一般資料 選取2020年8月至2022年10月平頂山市第一人民醫(yī)院收治且符合以下納入和排除標(biāo)準(zhǔn)的153 例HBV 感染者作為研究對(duì)象,其中肝硬化者86 例(設(shè)為肝硬化組)、乙型肝炎者67 例(設(shè)為肝炎組),另選取同期于本院體檢的健康志愿者51 例作為對(duì)照組。肝硬化組患者中男性45 例,女性41 例;年齡32~54 歲,平均(42.58±3.49)歲;體質(zhì)量指數(shù)(BMI) 20~28 kg/m2,平均(24.16±1.19) kg/m2;病程1~5 年,平均(3.24±0.57)年。肝炎組患者中男性35 例,女性32 例;年齡29~55 歲,平均(41.96±4.12)歲;BMI 20~29 kg/m2,平均(23.96±1.28) kg/m2;病程1~6 年,平均(3.19±0.71)年。對(duì)照組中男性28 例,女性23 例;年齡30~55歲,平均(42.19±4.03)歲;BMI 20~29 kg/m2,平均(24.03±1.33)kg/m2。三組受檢者的一般資料比較差異均無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),具有可比性。本研究經(jīng)本院醫(yī)學(xué)倫理委員會(huì)批準(zhǔn),所有受檢者均知情且簽署知情同意書(shū)。
1.2 納排標(biāo)準(zhǔn) (1)納入標(biāo)準(zhǔn):①符合肝硬化診斷標(biāo)準(zhǔn)[6],且經(jīng)CT檢查、肝組織活檢證實(shí)為乙肝肝硬化;②符合HBV感染診斷標(biāo)準(zhǔn)[7];③原發(fā)性肝癌患者符合肝癌診斷標(biāo)準(zhǔn)[8];④未合并其他類型肝炎病毒感染;⑤未合并脂肪肝等慢性肝病者。(2)排除標(biāo)準(zhǔn):①合并心腎功能障礙;②伴有免疫系統(tǒng)、凝血功能障礙;③既往抗病毒或保肝治療史;④伴有酒精性、藥物性肝炎者;⑤合并甲狀腺功能亢進(jìn)者;⑥既往手術(shù)史者。
1.3 方法
1.3.1 不同病情程度判定標(biāo)準(zhǔn) 依據(jù)HBV-DNA載量將HBV 感染者分為低病毒載量44 例、中病毒載量71 例、高病毒載量38 例,其中低病毒載量為103copies/mL≤HBV-DNA 載量≤105copies/mL、中病毒載量為105copies/mL<HBV-DNA≤107copies/mL、高病毒載量為HBV-DNA載量>107copies/mL[9]。肝硬化組依據(jù)Child-Pugh分級(jí)分為A級(jí)34例、B級(jí)28例、C級(jí)24例;依據(jù)肝硬化程度[10]分為代償期肝硬化32例、失代償期肝硬化31例、原發(fā)性肝癌23例。Child-Pugh分級(jí)[11]:包括肝性腦病、肝性腦病程度、腹水、血膽紅素、血清蛋白、凝血酶原時(shí)間,每個(gè)指標(biāo)分為3 個(gè)層次,分別記為1分、2分、3分,A級(jí)≤6分,6分<B級(jí)≤9分,C級(jí)>9分。
1.3.2 肝功能指標(biāo)檢測(cè) 肝硬化組、肝炎組均于入組時(shí)采集空腹靜脈血10 mL,對(duì)照組于體檢當(dāng)日采集空腹靜脈血10 mL,血液樣本分為兩份(5 mL/份),常規(guī)離心后取血清。采用cobas c701全自動(dòng)生化分析儀(羅氏)檢測(cè)血清堿性磷酸酶(ALP)、γ-谷氨酰轉(zhuǎn)肽酶(GGT)、白蛋白(ALB)、球蛋白(GLO)水平。
1.3.3 血清Lp-PLA2、Cys-C水平檢測(cè) 入組時(shí)采用HITACHI Labospect 008As檢測(cè)血清Lp-PLA2、Cys-C水平,美康生物科技股份有限公司提供檢測(cè)試劑盒。
1.4 觀察指標(biāo) (1)比較不同組別、不同HBV-DNA載量、不同Child-Pugh 分級(jí)、不同肝硬化程度受檢者的血清Lp-PLA2、Cys-C 水平;(2)分析入組時(shí)血清Lp-PLA2、Cys-C水平與肝功能指標(biāo)、Child-Pugh分級(jí)、肝硬化程度相關(guān)性;(3)評(píng)價(jià)入組時(shí)血清Lp-PLA2、Cys-C對(duì)肝硬化所致原發(fā)性肝癌的診斷價(jià)值。
1.5 統(tǒng)計(jì)學(xué)方法 應(yīng)用SPSS26.0 統(tǒng)計(jì)學(xué)軟件分析數(shù)據(jù)。計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差(±s)表示,兩組間比較采用t檢驗(yàn),多組間比較行單因素方差分析,進(jìn)一步兩兩比較采用SNK-q檢驗(yàn);采用Pearson法分析血清Lp-PLA2、Cys-C 水平與肝功能指標(biāo)相關(guān)性,并采用Spearman 法分析其與Child-Pugh 分級(jí)、肝硬化程度相關(guān)性;采用受試者工作特征曲線(ROC)評(píng)價(jià)血清p-PLA2、Cys-C 對(duì)肝硬化所致原發(fā)性肝癌的診斷價(jià)值。以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 三組受檢者的血清Lp-PLA2、Cys-C 水平與肝功能指標(biāo)比較 肝硬化組患者的血清Lp-PLA2、Cys-C、ALP、GGT、GLO 水平明顯高于肝炎組、對(duì)照組,且肝炎組明顯高于對(duì)照組,而肝硬化組患者的血清ALB 水平明顯于肝炎組、對(duì)照組,且肝炎組明顯低于對(duì)照組,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表1。
表1 三組受檢者的血清Lp-PLA2、Cys-C水平與肝功能指標(biāo)比較(±s)Table 1 Comparison of serum Lp-PLA2,Cys-C levels and liver function indicators among the three groups(±s)
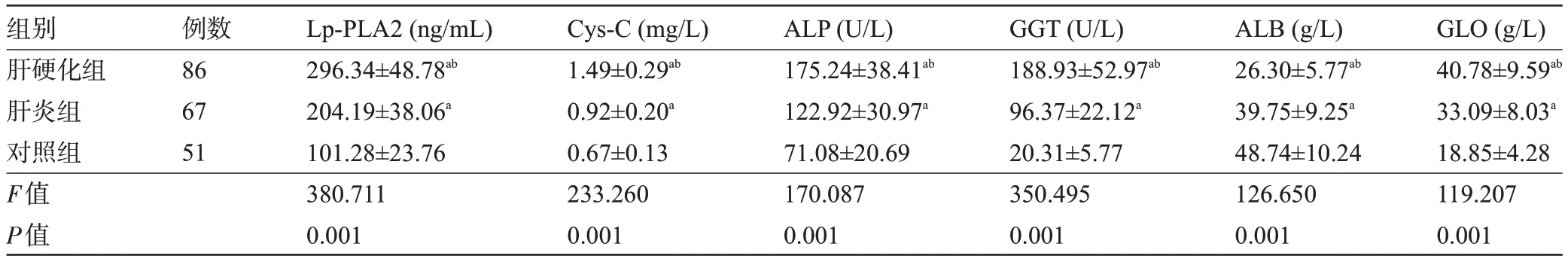
表1 三組受檢者的血清Lp-PLA2、Cys-C水平與肝功能指標(biāo)比較(±s)Table 1 Comparison of serum Lp-PLA2,Cys-C levels and liver function indicators among the three groups(±s)
注:與對(duì)照組比較,aP<0.05;與肝炎組比較,bP<0.05。Note:Compared with that in the control group,aP<0.05;Compared with that in the hepatitis group,bP<0.05.
組別肝硬化組肝炎組對(duì)照組F值P值例數(shù)86 67 51 Lp-PLA2(ng/mL)296.34±48.78ab 204.19±38.06a 101.28±23.76 380.711 0.001 Cys-C(mg/L)1.49±0.29ab 0.92±0.20a 0.67±0.13 233.260 0.001 ALP(U/L)175.24±38.41ab 122.92±30.97a 71.08±20.69 170.087 0.001 GGT(U/L)188.93±52.97ab 96.37±22.12a 20.31±5.77 350.495 0.001 ALB(g/L)26.30±5.77ab 39.75±9.25a 48.74±10.24 126.650 0.001 GLO(g/L)40.78±9.59ab 33.09±8.03a 18.85±4.28 119.207 0.001
2.2 不同HBV-DNA 載量患者的血清Lp-PLA2、Cys-C 水平比較 隨著HBV-DNA 載量增加,患者的血清Lp-PLA2、Cys-C水平呈上升趨勢(shì),差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表2。
表2 不同HBV-DNA載量患者的血清Lp-PLA2、Cys-C水平比較(±s)Table 2 Comparison of serum Lp-PLA2 and Cys-C levels in patients with different HBV DNA loads(±s)
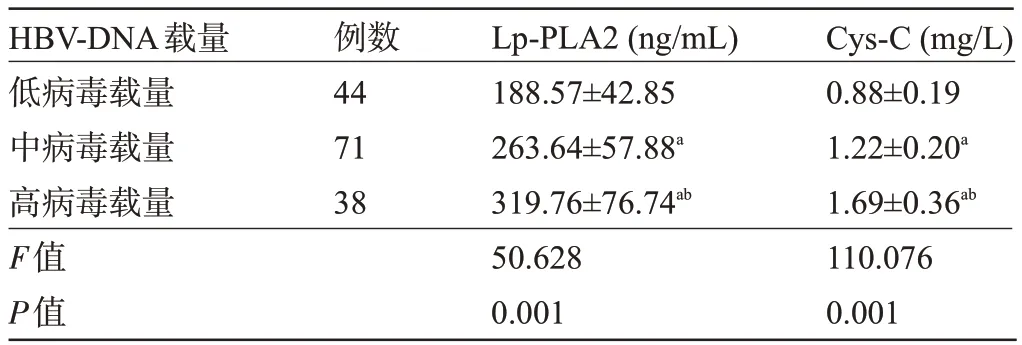
表2 不同HBV-DNA載量患者的血清Lp-PLA2、Cys-C水平比較(±s)Table 2 Comparison of serum Lp-PLA2 and Cys-C levels in patients with different HBV DNA loads(±s)
注:與低病毒載量比較,aP<0.05;與中病毒載量比較,bP<0.05。Note: Compared with low viral load,aP<0.05; Compared to the viral load,bP<0.05.
HBV-DNA載量低病毒載量中病毒載量高病毒載量F值P值Cys-C(mg/L)0.88±0.19 1.22±0.20a 1.69±0.36ab 110.076 0.001例數(shù)44 71 38 Lp-PLA2(ng/mL)188.57±42.85 263.64±57.88a 319.76±76.74ab 50.628 0.001
2.3 不同Child-Pugh 分級(jí)患者的血清Lp-PLA2、Cys-C 水平比較 隨著Child-Pugh 分級(jí)增加,肝硬化患者的血清Lp-PLA2、Cys-C水平呈上升趨勢(shì),差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表3。
表3 不同Child-Pugh分級(jí)患者的血清Lp-PLA2、Cys-C水平比較(±s)Table 3 Comparison of serum Lp-PLA2 and Cys-C levels among patients with different Child-Pugh grades(±s)
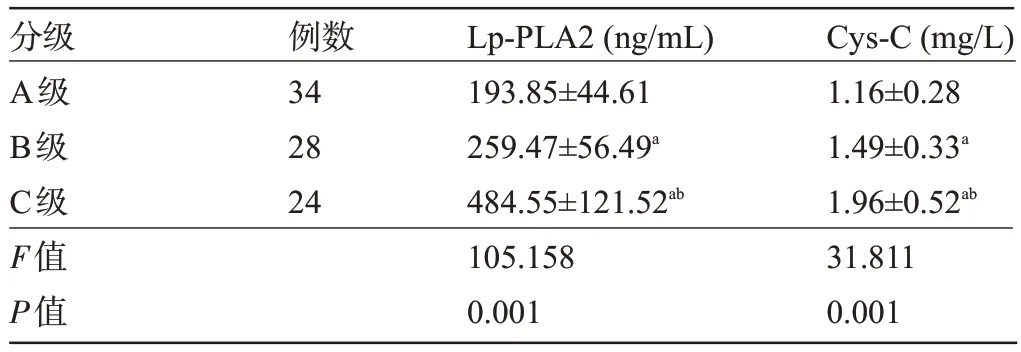
表3 不同Child-Pugh分級(jí)患者的血清Lp-PLA2、Cys-C水平比較(±s)Table 3 Comparison of serum Lp-PLA2 and Cys-C levels among patients with different Child-Pugh grades(±s)
注:與A級(jí)比較,aP<0.05;與B級(jí)比較,bP<0.05。Note:Compared with Class A,aP<0.05;Compared to Level B,bP<0.05.
分級(jí)A級(jí)B級(jí)C級(jí)F值P值Cys-C(mg/L)1.16±0.28 1.49±0.33a 1.96±0.52ab 31.811 0.001例數(shù)34 28 24 Lp-PLA2(ng/mL)193.85±44.61 259.47±56.49a 484.55±121.52ab 105.158 0.001
2.4 不同肝硬化程度患者的血清Lp-PLA2、Cys-C 水平比較 隨著肝硬化程度加重,患者的血清Lp-PLA2、Cys-C 水平呈上升趨勢(shì),差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表4。
表4 不同肝硬化程度患者的血清Lp-PLA2、Cys-C水平比較(±s)Table 4 Comparison of serum Lp- PLA2 and Cys- C levels in patients with different degrees of cirrhosis(±s)
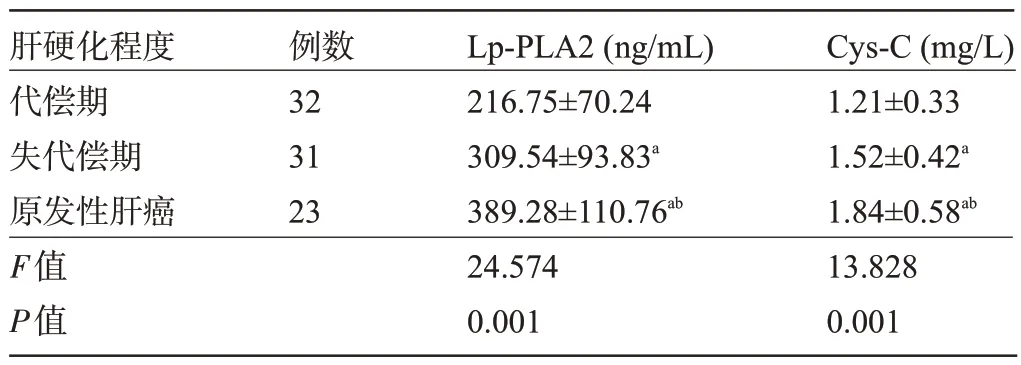
表4 不同肝硬化程度患者的血清Lp-PLA2、Cys-C水平比較(±s)Table 4 Comparison of serum Lp- PLA2 and Cys- C levels in patients with different degrees of cirrhosis(±s)
注:與代償期比較,aP<0.05;與失代償期比較,bP<0.05。Note:Compared with that of the compensation period,aP<0.05;Compared with that of the compensatory period,bP<0.05.
肝硬化程度代償期失代償期原發(fā)性肝癌F值P值例數(shù)32 31 23 Lp-PLA2(ng/mL)216.75±70.24 309.54±93.83a 389.28±110.76ab 24.574 0.001 Cys-C(mg/L)1.21±0.33 1.52±0.42a 1.84±0.58ab 13.828 0.001
2.5 肝硬化患者血清Lp-PLA2、Cys-C 水平與肝功能、Child-Pugh 分級(jí)及肝硬化程度的相關(guān)性 經(jīng)Pearson法相關(guān)性分析結(jié)果顯示,血清Lp-PLA2、Cys-C水平與ALP、GGT、GLO 呈正相關(guān)(P<0.05),而與ALB呈負(fù)相關(guān)(P<0.05);經(jīng)Spearman 法相關(guān)性分析結(jié)果顯示,血清Lp-PLA2、Cys-C水平與Child-Pugh分級(jí)(A級(jí)=1、B級(jí)=2、C級(jí)=3)、肝硬化程度(代償期=1、失代償期=2、原發(fā)性肝癌=3)呈正相關(guān)(P<0.05),見(jiàn)表5。
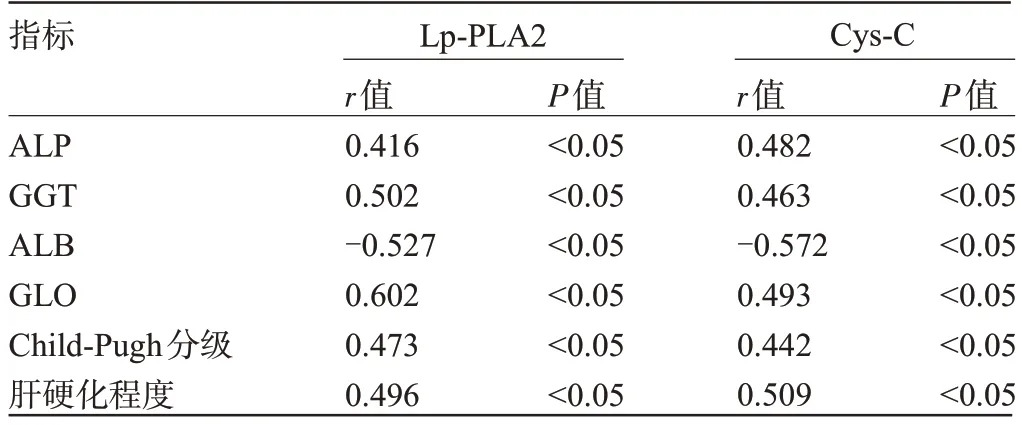
表5 肝硬化患者血清Lp-PLA2、Cys-C 水平與肝功能、Child-Pugh分級(jí)及肝硬化程度的相關(guān)性Table 5 Correlation between serum Lp-PLA2, Cys-C levels and liver function,Child Pugh grade,and degree of cirrhosis in patients with liver cirrhosis
2.6 血清Lp-PLA2、Cys-C 對(duì)肝硬化所致原發(fā)性肝癌的診斷價(jià)值 以失代償期31例為陽(yáng)性樣本,以代償期32 例為陰性樣本,繪制ROC 曲線,結(jié)果顯示,血清Lp-PLA2、Cys-C 聯(lián)合鑒別診斷失代償期的AUC 明顯大于單獨(dú)指標(biāo)鑒別診斷,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05);以原發(fā)性肝癌23 例為陽(yáng)性樣本,以失代償期31例為陰性樣本,繪制ROC曲線,結(jié)果顯示,血清Lp-PLA2、Cys-C聯(lián)合鑒別診斷原發(fā)性肝癌的AUC明顯大于單獨(dú)指標(biāo)鑒別診斷,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表6、圖1和圖2。
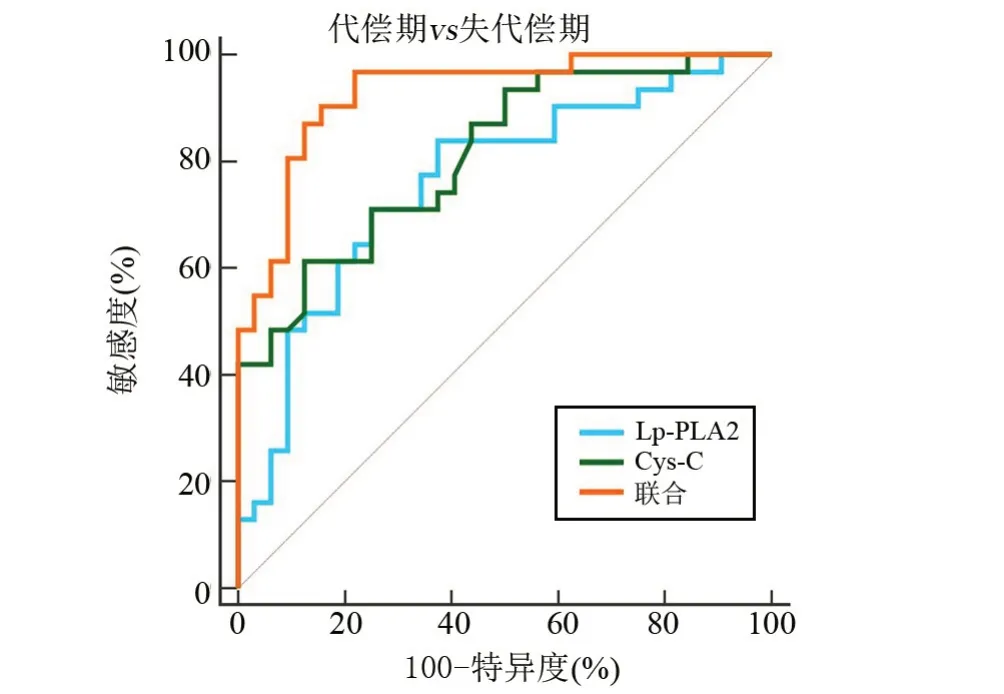
圖1 血清Lp-PLA2、Cys-C聯(lián)合鑒別診斷失代償期患者的ROCFigure 1 ROC of Lp- PLA2 and Cys- C alone and in combiration for differential diagnosis of decompensated patients
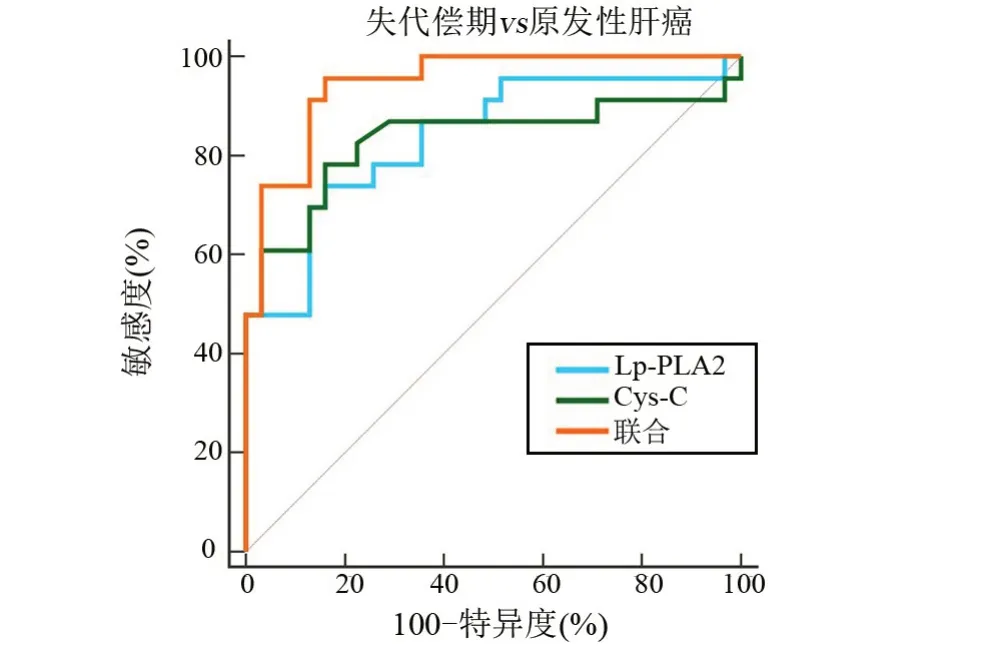
圖2 血清Lp-PLA2、Cys-C聯(lián)合鑒別診斷原發(fā)性肝癌患者的ROCFigure 2 ROC of Lp-PLA2 and Cys-C alone and in combiration for differential diagnosis of primary liver cancer
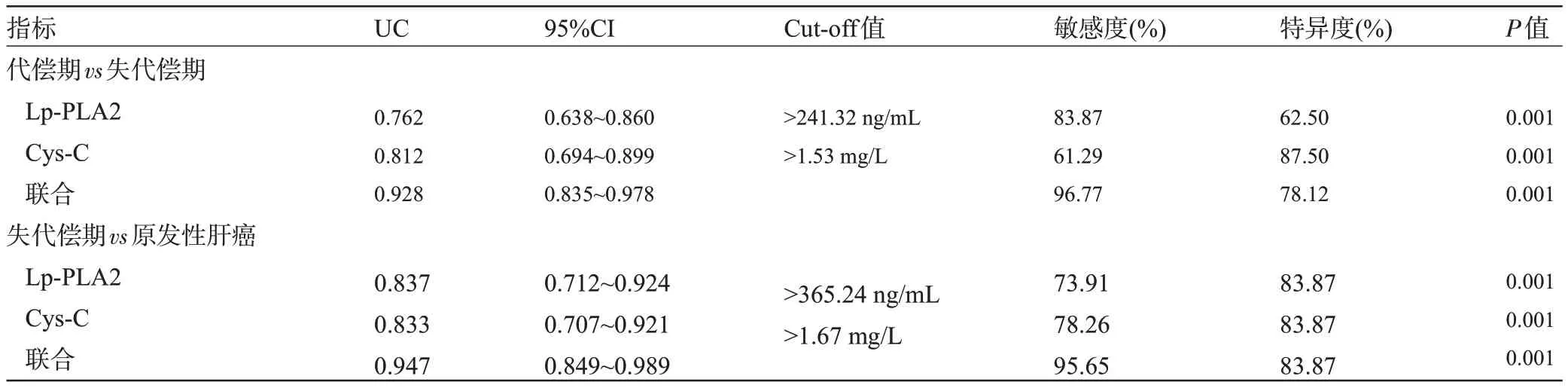
表6 血清Lp-PLA2、Cys-C對(duì)肝硬化所致原發(fā)性肝癌的診斷價(jià)值Table 6 Diagnostic value of serum Lp-PLA2 and Cys-C in primary liver cancer caused by cirrhosis
3 討論
HBV感染后可刺激機(jī)體免疫系統(tǒng),破壞肝細(xì)胞合成膠原功能,致使肝纖維化發(fā)展,甚至誘發(fā)肝癌與急性腎損傷[12]。生化、影像學(xué)檢查是重要輔助檢查手段,Child-Pugh 分級(jí)可評(píng)估肝臟儲(chǔ)備功能,但未能明確肝硬化嚴(yán)重程度,因而尋找細(xì)胞因子評(píng)估患者病情嚴(yán)重程度具有重要意義。
Lp-PLA2 水平升高與機(jī)體氧化應(yīng)激反應(yīng)密切相關(guān),可提高細(xì)胞對(duì)細(xì)胞血脂成分的吸收代謝能力,中和氧化型磷脂,以此降低其對(duì)肝臟或其他臟器組織損傷[13-14]。本研究結(jié)果顯示,肝硬化組血清Lp-PLA2 水平高于肝炎組、對(duì)照組,且肝炎組高于對(duì)照組,提示Lp-PLA2 差異性表達(dá)可能影響HBV 感染肝硬化病情進(jìn)展。本研究發(fā)現(xiàn)隨著HBV-DNA載量增加,血清Lp-PLA2 水平呈上升趨勢(shì),其與ALP、GGT、GLO、Child-Pugh分級(jí)、肝硬化程度呈正相關(guān),而與ALB呈負(fù)相關(guān),證實(shí)Lp-PLA2水平變化可能反映肝功能情況,肝臟感染程度。其作用機(jī)制可能為L(zhǎng)p-PLA2 表達(dá)異常可影響肝臟上皮細(xì)胞生理功能,而HBV感染肝硬化進(jìn)展過(guò)程中,可刺激肝細(xì)胞產(chǎn)生細(xì)胞因子,導(dǎo)致Lp-PLA2 水平升高。
Cys-C 可反映機(jī)體內(nèi)氧化應(yīng)激代謝狀態(tài),并可調(diào)節(jié)炎性反應(yīng)、細(xì)胞外基質(zhì)降解及吞噬功能,同時(shí)Cys-C 水平升高可提高游離氧自由基水平、局部微循環(huán)環(huán)境中游離電子濃度,促進(jìn)肝臟間質(zhì)細(xì)胞損傷及纖維化,加劇氧化還原反應(yīng)平衡紊亂,促進(jìn)肝硬化病情進(jìn)展[15-17]。本研究結(jié)果顯示,肝硬化組血清Cys-C 水平高于肝炎組、對(duì)照組,且肝炎組高于對(duì)照組,其水平與ALP、GGT、GLO 呈正相關(guān),而與ALB 呈負(fù)相關(guān),提示HBV 感染肝硬化患者伴有肝腎功能降低。其原因可能為HBV感染肝硬化患者體內(nèi)醛固酮水平升高,可增強(qiáng)腎小管重吸收能力,引起腎小管、腎小球功能失衡,導(dǎo)致Cys-C 水平升高。本研究結(jié)果顯示,隨著HBVDNA 載量、Child-Pugh 分級(jí)增加及肝硬化程度加重,血清Cys-C 水平呈上升趨勢(shì),提示Cys-C 表達(dá)與HBV感染肝硬化病情密切相關(guān),這主要是由于Cys-C 水平升高可影響肝臟上皮細(xì)胞,破壞線粒體膜完整性,促進(jìn)轉(zhuǎn)氨酶釋放,降低肝臟合成、解毒功能,影響肝細(xì)胞再生,并可影響胱抑素富集程度,促進(jìn)活性氧形成,引起細(xì)胞脂質(zhì)過(guò)氧化反應(yīng),加重肝組織損傷程度,致使肝功能惡化。目前Lp-PLA2、Cys-C 在肝硬化應(yīng)用中的研究相對(duì)較少,本研究探討Lp-PLA2、Cys-C在診斷肝硬化程度方面的臨床價(jià)值,結(jié)果顯示,血清Lp-PLA2、Cys-C聯(lián)合鑒別診斷失代償期的AUC大于單獨(dú)指標(biāo)鑒別診斷,其聯(lián)合鑒別診斷原發(fā)性肝癌的AUC大于單獨(dú)指標(biāo)鑒別診斷,提示血清Lp-PLA2、Cys-C在診斷肝硬化程度中具有一定臨床應(yīng)用價(jià)值。
綜上所述,HBV 感染肝硬化患者血清Lp-PLA2、Cys-C水平升高,且與肝功能指標(biāo)、Child-Pugh分級(jí)、肝硬化程度密切相關(guān),聯(lián)合檢測(cè)其水平在診斷肝硬化程度方面具有一定臨床價(jià)值,因而監(jiān)測(cè)Lp-PLA2、Cys-C水平變化有助于判斷HBV 感染肝硬化患者肝硬化程度,可為臨床制定治療方案提供參考。

