從B細胞淋巴瘤-2抑制劑開發看國內外藥企專利布局的異同
辜艷
(上海恒瑞醫藥有限公司 上海 200245)
B 細胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)是最早發現的與細胞凋亡密切相關的蛋白,與腫瘤的發生發展和耐藥均有密切的關聯。Bcl-2 的生理學功能是阻遏細胞凋亡,延長細胞壽命,故若其過表達,就會造成細胞生長及其增殖失控,導致腫瘤的發生[1]。反之,抑制Bcl-2,就可能使腫瘤細胞凋亡,從而達到治療目的。
然而,靶向Bcl-2 的藥物的開發并不順利,直到2016 年,全球首個Bcl-2 抑制劑維奈克拉(venetoclax)才獲得美國FDA 批準。維奈克拉是艾伯維公司開發的第三代Bcl-2 抑制劑,其現已在多個國家或地區獲準上市,用于治療慢性淋巴細胞白血病(chronic lymphocytic leukemia, CLL)、小淋巴細胞淋巴瘤(small lymphocytic lymphoma, SLL)和急性髓細胞白血病(acute myeloid leukemia, AML)。維奈克拉治療患者可能出現耐藥現象,同時不良反應也會限制某些患者獲益[2],這為后來者留下了生存和發展的空間。
在2022 年第64 屆美國血液學會年會上,亞盛醫藥和百濟神州分別公布了它們各自在研的Bcl-2 抑制劑APG-2575 和BGB-11417 的最新臨床研究數據。從化學結構看,這2 個化合物的結構都與維奈克拉相似(表1),特別是APG-2575。很明顯,APG-2575 和BGB-11417 是在保留維奈克拉母體結構的基礎上對其進行局部結構改造后得到的。本文分析艾伯維公司、亞盛醫藥和百濟神州在Bcl-2 抑制劑專利布局上的異同,希望能對其他藥企的藥物開發活動有所啟迪。

表1 主要Bcl-2抑制劑的化學結構
1 專利布局的內容及途徑
艾伯維公司很早就致力于Bcl-2 抑制劑的開發,2009 年起便陸續提交了核心化合物及其晶型、制備方法、用途或治療方法(包括聯合用藥)的專利申請,其中大多數為國際專利申請,通過專利合作條約同時向多個國家或地區申請專利。亞盛醫藥和百濟神州也是如此,對核心化合物同樣有完善的專利布局(表2)。
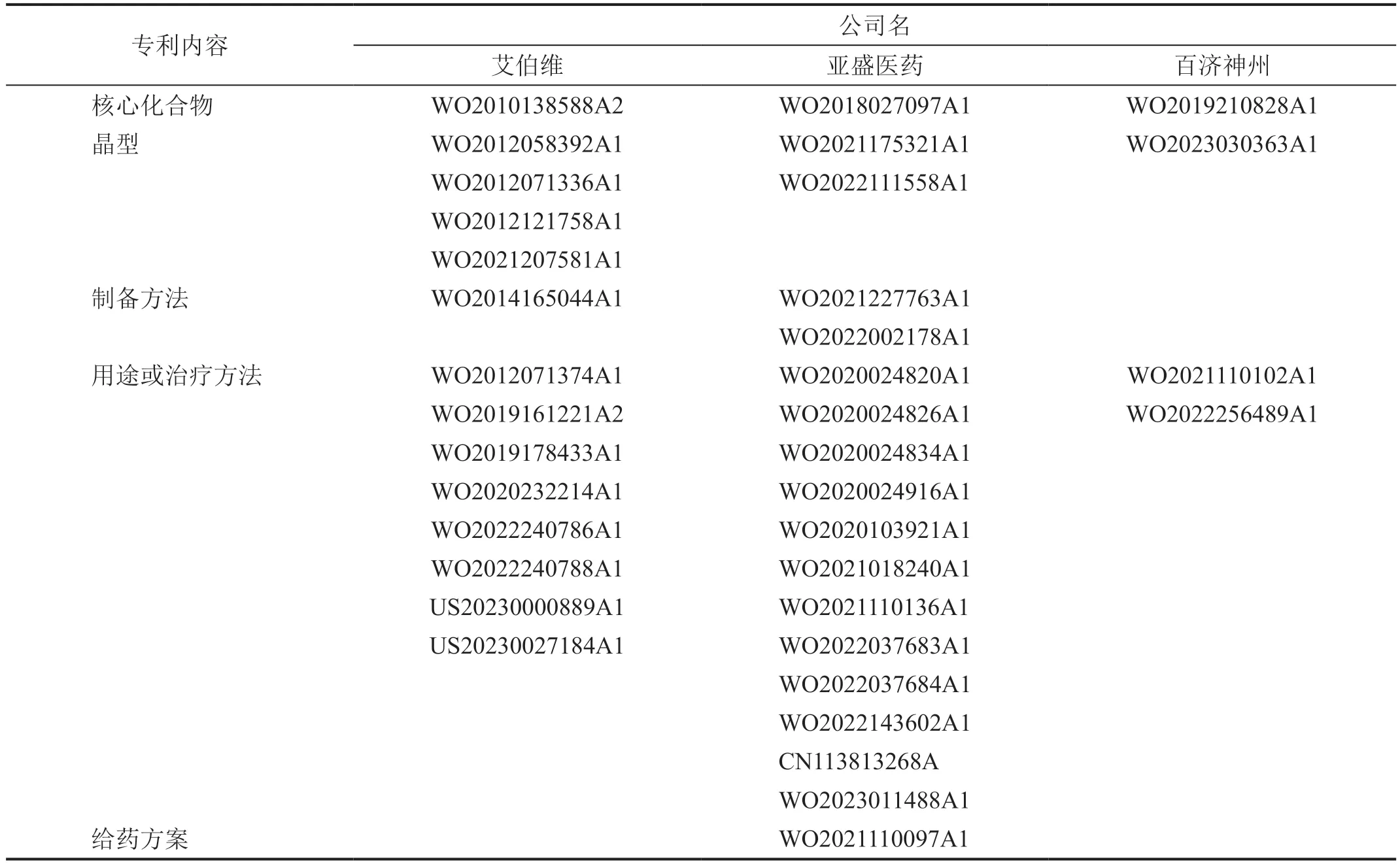
表2 3家公司申請的Bcl-2抑制劑專利a)
由表2 可知,3 家公司在Bcl-2 抑制劑專利布局上的主要不同點在于:
1)亞盛醫藥專門提交了一項給藥方案專利申請WO2021110097A1,但艾伯維公司沒有申請類似專利,而百濟神州可能還未到申請類似專利的時間節點。
2)艾伯維公司和百濟神州除圍繞核心化合物提交了化合物專利申請外,還針對與核心化合物結構完全不同的化合物提交了專利申請。特別是百濟神州,其通過對新波制藥有限公司的WO2019040573A1 所申請的化合物進行結構改造,提交了新化合物專利申請WO2021083135A1,可能想在多種結構化合物方向有所作為。
2 核心化合物專利申請的保護范圍
維奈克拉、APG-2575 的核心化合物專利申請目前已在多個國家或地區獲得授權,而BGB-11417 的核心化合物專利申請因較前兩家公司晚申請幾年,目前僅有一項美國同族專利獲得授權。下面以中國、歐洲和美國3個全球最為重要的商業區域為例,歸納一下維奈克拉、APG-2575 和BGB-11417 的核心化合物專利申請的保護范圍。
由表3 可知,3 家公司對各自核心化合物的專利保護都十分完善,具體體現在:

表3 3家公司核心化合物專利申請的保護范圍a)
1)基于實施例概括了不同保護范圍的馬庫什通式化合物,為專利審查時的修改預留了足夠的空間。
2)通過制備大量化合物并測試生物活性來支持更大保護范圍的馬庫什通式化合物,讓競爭企業望而卻步。
3)充分利用各個國家或地區專利法中的分案/繼續申請制度,即先申請保護核心化合物等重點化合物或保護范圍涵蓋核心化合物且預期專利權穩定的小馬庫什通式化合物,后續再提交分案申請、繼續申請或部分繼續申請,嘗試謀取更大保護范圍的馬庫什通式化合物專利。這么做,一方面能讓核心化合物專利申請盡快獲得授權,另一方面還可利用專利審查的幾年時間,跟蹤競爭企業的相關動態,盡可能地圈住他人的化合物,從而對他人的研發工作形成專利壁壘。
值得一提的是,維奈克拉的中國分案申請CN104876927B(權利要求1 請求保護通式Ⅱ化合物)先后兩次被提出無效宣告請求(具體請參見國家知識產權局專利局第53977 號和第58648 號無效宣告請求審查決定書)。其中第一次無效宣告請求時,請求人亞盛醫藥未能提供足夠的證據,最終僅使CN104876927B 權利要求3 的化合物因公開不充分而被宣告無效。雖然這沒有動搖CN104876927B 權利要求1 保護的通式Ⅱ化合物,但審查合議組卻在無效宣告決定中認定該專利權利要求1 不能享有優先權。第二次無效宣告請求時,請求人侯曉菲給出了新的證據:艾伯維公司的在先專利WO2009155386A1 中公開了一個化合物,該化合物能破壞CN104876927B 中通式Ⅱ化合物的新穎性。由于CN104876927B 中的其余3 項權利要求均為保護具體化合物,且《專利審查指南》第三章4.6 節規定“無效宣告程序中發明專利文件的修改僅限于權利要求書”,導致艾伯維公司無法通過合并從屬權利要求而縮小保護范圍。
一項授權專利被兩次提出無效宣告請求,其實質必然是觸及到了他人利益。事實亦然,APG-2575 確實落入了CN104876927B 的通式Ⅱ化合物范圍內。幸運的是,隨著兩次無效宣告,亞盛醫藥已成功地為APG-2575 在中國的開發掃清了專利方面的障礙。不過,正如表3 所示,艾伯維公司的授權專利EP2435432B1 中也涵蓋了通式Ⅱ化合物,且該專利的保護范圍較CN104876927B 中的權利要求1 還大。從亞盛醫藥在歐洲的專利申請情況分析,其與艾伯維公司肯定還會發生專利訴訟,但結果能否像在中國這般順利,現尚難以預測。
3 聯合用藥專利布局
2023 年1 月,維奈克拉已進入我國國家醫保目錄,用于治療成人AML 患者。維奈克拉單藥或聯合用藥治療AML 的有效性和安全性均優于傳統治療方案[3]。
研究發現,伊布替尼能夠增強CLL/SLL 細胞對維奈克拉的敏感性,兩藥聯用有協同效應[4]。因此,目前國際上治療CLL/SLL 多采用Bcl-2 抑制劑和布魯頓酪氨酸激酶(Bruton’s tyrosine kinase, BTK)抑制劑聯合用藥的方式。從ClinicalTrials.gov 網站信息看,艾伯維公司、亞盛醫藥和百濟神州3 家公司均注冊了各自Bcl-2 抑制劑與BTK 抑制劑聯合用藥的臨床試驗,并均申請了相應的聯合用藥專利,其中艾伯維公司為維奈克拉聯用伊布替尼或阿卡替尼(都是自己公司上市藥品),亞盛醫藥為APG-2575 聯用伊布替尼或阿卡替尼,百濟神州為BGB-11417 聯用澤布替尼(自己公司上市藥品)。
亞盛醫藥還在開展APG-2575 與自己公司在研的MDM2-p53 抑制劑APG-115 或蛋白酪氨酸激酶抑制劑奧雷巴替尼聯合用藥的探索,并在進行APG-2575 單藥或與伊布替尼或利妥昔單抗聯合用藥治療華氏巨球蛋白血癥的臨床試驗。
4 小結
根據以上分析,可以得到一些啟示,希望對國內其他藥企藥物開發的專利布局有所啟迪:
1)通過開發不同的適應證或不同的用藥方式,實現差異化布局,尋得自身的獨特優勢。
2)對于起步較晚的公司,可以嘗試瞄準多個陽性化合物,尋找不同的出路。
3)技術上應跟緊,行動需快,專利布局要趁早。特別是對一些熱門靶點藥物,必須加快相關專利申請的速度。藥物研發人員和知識產權從業人員必須保持良好的溝通,才能讓整個項目的推進事半功倍。
4)必須對相關專利申請進展進行及時、有效的跟蹤。從陽性化合物的母案專利申請開始,就應密切關注其審查過程,推測其是否有可能提交或已提交分案/繼續申請。此外,還要謹慎分析這些專利的授權范圍,以及專利權是否穩定。唯有如此,才能幫助公司選擇正確的研發方向并進行合理的專利布局。
目前,國內藥企的藥物開發模式仍主要是“快速跟隨(fast follow)”。令人欣喜的是,我們發現一些曾在藥物開發專利布局上吃過虧的公司,經及時調整策略后,已在其他項目上遠超他人。希望有更多的藥企能夠認識當下激烈的競爭態勢,更加注重知識產權的保護,因為只有那些發明構思新穎、專利布局完善的公司才能脫穎而出。

