不同懸液滴加劑量在人類染色體制備中的應用
楊麗霞,陳 坤,張 帆,李淑云,齊山芹
1.山東中醫藥大學第二附屬醫院生殖科,山東濟南 250001;2.山東中醫藥大學,山東濟南 250014
染色體常規G顯帶檢測作為細胞遺傳學的經典檢測技術,是染色體病診斷的金標準,在產前診斷、輔助生殖等領域也具有重要的作用[1-2]。在染色體制備過程中滴片環節是其中重要的步驟之一,制作出高質量的標本玻片是保障染色體核型診斷準確的前提和必要條件。本研究使用染色體分散儀制片,在相對固定的溫度及濕度環境設定下,采用4種不同劑量細胞懸液滴加制片,通過制片后自動掃描分析系統采集有效細胞圖占比、分裂相展開面積、染色體帶紋辨析度等指標評價,以期探討制片環節中適宜的細胞懸液滴加劑量,制作出更加有利于核型分析的標本玻片,提高分析效率及診斷準確性,現報道如下。
1 材料與方法
1.1標本采集 在2021年9-10月山東中醫藥大學第二附屬醫院(以下簡稱本院)10個不同批次的外周血染色體檢測標本中隨機選取標本各1份,共計選取10份標本為研究對象,在正式發放檢測報告后剩余的細胞懸液標本用于本研究。
1.2儀器與試劑 主要儀器:染色體分散儀(美國IDEX)、染色體自動掃描分析系統(德國蔡司)、移液槍、超凈工作臺、恒溫培養箱、離心機、醫用冰柜、鼓風干燥箱、電熱恒溫水溫箱等;主要試劑:離心管式T型淋巴細胞培養基(廣州拜迪)、秋水仙素、胰蛋白酶、吉姆薩染色液、低滲液、甲醇、冰乙酸等,均為國產試劑;玻片:病理級顯微鏡載玻片(10127107P-G,江蘇世泰)。
1.3方法
1.3.1細胞懸液制備 采用常規方法接種及收獲外周血細胞標本:采集外周血標本3 mL于肝素抗凝管中,5 mL注射器7號針頭垂直接種26~28滴于淋巴細胞培養基中,傾斜放置于37 ℃培養箱中培養68~72 h,1 mL注射器5號針頭垂直加入秋水仙素(20 μg/mL)2滴,繼續培養1.5 h,再經過離心、低滲、預固定、3次固定后制成細胞懸液,放置于-18 ℃醫用冰柜中保存備用。
1.3.2滴片 染色體分散儀預設參數:溫度為27 ℃,相對濕度為55%,玻片編號后平置于染色體分散儀內鏤空架上,細胞懸液自低溫冰柜中取出后立即滴片。采用移液槍吸取懸液滴加,每份標本調整4種不同劑量各滴加2張玻片,每張玻片分別在兩端近中心點1/2處各滴加懸液2滴,分別制作10、20、30、40 μL 4組各20張標本玻片,共計制片80張。滴片后靜置15 min,玻片裝入銅質染色架放置75 ℃鼓風干燥箱中烤片3 h。
1.3.3常規G顯帶 參照文獻[3]及《全國染色體病診斷與產前診斷培訓班——細胞遺傳學實驗室工作手冊》[4],進行常規G顯帶操作。
1.3.4掃描分析 采用染色體自動掃描分析系統采集細胞圖,設置每張玻片高倍鏡掃描70個細胞圖,用于眾數分析及核型診斷。
1.4評價指標 (1)有效細胞圖占比,染色體自動掃描分析系統所采集的細胞圖圖像清晰、細胞相對完整、可用于分析診斷的細胞圖作為有效細胞圖,并計算有效細胞圖占比。(2)分裂相展開面積(R值),4組劑量分別選取20個有效細胞圖,計算其R值:R=πab/4AB[5]。(3)染色體帶紋辨析度評價,評價標準參照《人類細胞遺傳學國際命名體制ISCN2016》所示染色體核型示意圖,質評條帶及評分標準參考文獻[6-7],制訂以下評分標準:320~<400條帶計1分;400~<550條帶計2分;550條帶計3分;>550條帶計4分。
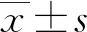
2 結 果
2.14組有效細胞圖占比比較 染色體自動掃描分析系統采集有效細胞圖占比隨著滴加劑量增大而降低:10 μL組、20 μL組、30 μL組采集有效細胞圖占比均大于40 μL組,差異有統計學意義(10 μL組與40 μL組比較χ2=17.106,P<0.001;20 μL組與40 μL組比較χ2=11.683,P=0.001;30 μL組與40 μL組比較χ2=13.378,P<0.001)。10 μL組、20 μL組、30 μL組采集有效細胞圖占比比較,差異無統計學意義(P>0.05)。見表1。

表1 4組有效細胞圖占比比較
2.24組R值比較 10 μL組、20 μL組、30 μL組、40 μL組R值分別為0.16±0.03、0.21±0.04、0.25±0.07、0.28±0.08,4組R值比較,差異有統計學意義(F=16.059,P<0.001)。10 μL組與20 μL、30 μL、40 μL組R值比較,差異有統計學意義(P<0.05);20 μL組與40 μL組R值比較,差異有統計學意義(P<0.05);20 μL組與30 μL組R值比較,差異無統計學意義(P>0.05);30 μL組與40 μL組R值比較,差異無統計學意義(P>0.05)。隨著懸液滴加劑量增加,R值隨之增加,但是達到一定閾值后,展開面積過大,將影響掃描系統采集到完整的細胞圖。見圖1。

注:A為10 μL組;B為20 μL組;C為30 μL組;D為40 μL組。
2.3染色體帶紋辨析度比較 10 μL組、20 μL組、30 μL組、40 μL組染色體帶紋質量評分分別為(1.60±0.60)、(2.25±0.72)、(2.45±0.83)、(2.65±0.81)分,隨滴加劑量增大而逐漸升高,差異有統計學意義(F=7.493,P<0.001)。40 μL組染色體帶紋質量評分與30 μL組、20 μL組比較,差異無統計學意義(P>0.05);20 μL組染色體帶紋質量評分與30 μL組比較,差異無統計學意義(P>0.05)。10 μL組染色體帶紋質量評分低于其他3組,差異均有統計學意義(P<0.05)。見圖2。

注:A為10 μL組;B為20 μL組;C為30 μL組;D為40 μL組。
3 討 論
近年來,遺傳學檢測在優生優育及產前診斷、染色體疾病診斷等領域得到廣泛應用,染色體核型分析目前仍然是遺傳學診斷重要的檢測方法之一[8]。外周血染色體檢測技術在1960年由MOORHEAD等建立,是細胞遺傳學研究的重要基礎。如何制備出高質量的染色體標本,提高分析效率及核型診斷的準確性,以便給予臨床診斷及治療更加精準的參考指標,是各個細胞遺傳實驗室不斷追求的目標。染色體制備步驟繁瑣,影響因素較多,制備過程中的實驗室條件控制,尤其是制片環節的標準化及可重復性條件的建立是研究的重點之一[9-10]。SPURBECK等[11]首次提出了染色體分散動力學理論,為解決染色體分散問題提供了理論基礎。依據染色體分散動力學原理設計的染色體分散儀在染色體制備中的應用,為實驗室制片環節的條件控制提供了可能性。在滴片時可設定相對穩定的溫度及相對濕度等參數,從而保證染色體制備的重復性和一致性。盡管如此,不同的實驗室設置參數也略有差異[9,12-13],溫度波動范圍為25~30 ℃,相對濕度波動范圍為50%~55%。本研究采用染色體分散儀滴片時設定溫度為27 ℃,相對濕度為55%。但是即使對染色體分散儀進行相對穩定的參數設置,不同實驗人員制片及不同批次制片效果仍有差異。因此,制片環節中只對滴片環境溫度及濕度的控制尚不足以保證穩定的制片效果,如何進一步完善制片環節中的條件設定,以保證制片效果的穩定性是急需解決的問題。
染色體制備環節中滴加懸液劑量對制片效果影響的研究較少提及,本實驗室在染色體制備的各個環節,如標本接種、細胞培養、細胞收獲、顯帶等保持常規操作的前提下,制作本研究所用標本玻片,在滴片環節采用同一臺染色體分散儀、在同一時間、由同一名實驗室人員制片,分別采用10、20、30、40 μL 4種不同的懸液劑量,在相同滴片環境中制作4組染色體玻片,通過比較4組標本玻片中染色體自動掃描分析系統所采集有效細胞圖占比、R值、染色體帶紋辨析度等指標,發現在相同或者相近的溫度、濕度條件下滴片時,細胞懸液滴加劑量不同,染色體制片效果不同:低劑量懸液滴片有效細胞圖占比高于高劑量懸液滴片;隨著劑量逐漸增加,R值隨之增加,染色體帶紋辨析度也隨之增高,但是劑量增加到一定程度時,因過度分散,易造成掃描系統采集細胞不完整,使有效細胞圖數量減少,從而影響分析效率及診斷準確性。
有研究者認為,中期染色體分散質量主要取決于載玻片上固定液的揮發過程,通過溫度及濕度的協同作用,以保證最佳的分散效果[14]。本研究中滴片環節是在染色體分散儀中進行,設置了相對穩定的溫度及濕度條件,4組不同懸液劑量制片均由一名實驗室人員在同一時間內完成,出現分散效果的不同,考慮是由于劑量效應使玻片表面固定液的揮發速度產生差異:滴加劑量小的玻片表面固定液在同等溫度及濕度條件下,干燥時間相對較短,分散過程也相應縮短,R值較小,染色體伸展不充分;而滴加劑量大的玻片表面固定液在同等溫度及濕度條件下則干燥時間相對較長,染色體分散過程相應延長,展開面積也增大,染色體伸展充分。因此,增加懸液滴加劑量在同等溫度及濕度設定條件下可提高染色體的分散程度及帶紋辨析度。但是劑量增加到一定程度,細胞過于分散可造成掃描系統采集完整的細胞圖數量減少,反而不利于核型分析。本研究中,在染色體分散儀設定溫度為27 ℃,相對濕度為55%的條件下,20 μL組、30 μL組制片效果優于10 μL組、40 μL組,能夠在保證足量的有效細胞圖被采集的前提下,獲得適度分散及高質量帶紋辨析度的中期染色體,以滿足核型分析的需要。
本研究通過評價不同懸液滴加劑量在染色體分散儀制片中的效果,旨在探索染色體制片環節中重復性好、一致性程度高的條件設定,在以后的實驗室推廣中結合自動化設備的引進[15],不斷完善染色體制備標準化流程,獲得高質量的中期染色體核型,提高分析效率及核型診斷準確性,為臨床診斷及治療提供更加科學的參考指標,以利于精準醫療的深入開展。

