食管癌患者血清HIF-1α、HO-1、iNOS水平及其與氟尿嘧啶化療敏感性的關系
劉 咪,賀 娜,閆紅林,葉 娜,王凌雪
1.西安醫(yī)學院第一附屬醫(yī)院消化內(nèi)科,陜西西安 710077;2.西安醫(yī)學院第一附屬醫(yī)院內(nèi)鏡中心,陜西西安 710077;3.長安醫(yī)院輸血科,陜西西安 710016
化療是食管癌治療中的重要環(huán)節(jié),在食管癌的化療常用藥物中,5-氟尿嘧啶通過抑制胸苷酸合成酶增加活性氧濃度,通過損傷腫瘤細胞DNA來誘導腫瘤細胞凋亡[1-2]。然而,腫瘤細胞對化療藥物的敏感性具有較大差異,耐藥仍是腫瘤化療失敗的主要障礙之一[3]。缺氧誘導因子-1α(HIF-1α)可激活多種缺氧反應基因,加強腫瘤細胞對缺氧環(huán)境的適應過程[4]。血紅素加氧酶-1(HO-1)在抗氧化應激、炎癥反應抑制、抗凋亡等生物學過程中發(fā)揮重要作用[5]。在病理條件下,誘導型一氧化氮合酶(iNOS)經(jīng)誘導后將生成大量一氧化氮(NO),導致組織損傷[6]。既往關于食管癌患者氟尿嘧啶化療敏感性的研究較多,但對于HIF-1α、HO-1、iNOS水平與化療敏感性的關系相關研究較少[7]。基于此,本研究通過比較氟尿嘧啶化療前后食管癌患者血清HIF-1α、HO-1、iNOS水平變化,探討其與化療敏感性的關系,旨在為臨床治療食管癌提供參考,現(xiàn)報道如下。
1 資料與方法
1.1一般資料 選取2018年4月至2021年7月西安醫(yī)學院第一附屬醫(yī)院(以下簡稱本院)收治的102例初治食管癌患者作為食管癌組,其中男55例,女47例;年齡42~79歲,平均(62.88±10.33)歲;上胸段29例,中胸段48例,下胸段25例;臨床分期:Ⅱ期39例,Ⅲ期42例,Ⅳ期21例。納入標準:(1)經(jīng)病理活檢證實為原發(fā)性食管鱗狀細胞癌,于本院初治,采用氟尿嘧啶輔助化療;(2)卡氏功能狀態(tài)(KPS)評分≥70分;(3)既往未接受過放化療或手術治療。排除標準:(1)合并嚴重器質性疾病;(2)合并對免疫產(chǎn)生影響的慢性疾病,如系統(tǒng)性紅斑狼瘡等;(3)近期有感染史;(4)食管穿孔形成;(5)合并其他惡性腫瘤;(6)預計生存時間不足3個月。所有研究對象均自愿參與本研究,本研究符合赫爾辛基宣言,且經(jīng)本院醫(yī)學倫理委員會批準。
1.2方法
1.2.1化療 食管癌患者接受氟尿嘧啶化療,5-氟尿嘧啶(廠家:天津金耀藥業(yè)有限公司,批準文號:國藥準字H12020959)溶于250 mL 0.9%氯化鈉注射液中,0.5 g/d,第1~5天連續(xù)輸注,治療2周后,停藥1周,以3周為1個療程。在此基礎上聯(lián)合應用多西他賽(廠家:湖北華源世紀藥業(yè)有限公司,批準文號:國藥準字H20083578),每個療程第1天以 35 mg/m2輸注2 h,每3周重復使用。在第3次化療結束后進行手術。
1.2.2血清指標檢測 食管癌組于化療前、3次化療結束后分別抽取空腹靜脈血4 mL,室溫條件下離心,分離血清,酶聯(lián)免疫吸附試驗檢測血清HIF-1α、HO-1、iNOS水平,試劑盒購自上海朗頓生物科技有限公司。
1.3療效評價 采用國際抗癌聯(lián)盟制定的腫瘤近期療效評定標準[8]進行療效評價:完全緩解(CR)指X線食管鋇餐造影及CT檢查結果可見食管部位腫瘤消失;部分緩解(PR)指食管部位腫瘤縮小程度在50%及以上;穩(wěn)定(SD)指X線食管鋇餐造影及CT檢查結果顯示腫瘤縮小程度<50%或增大程度≤25%;進展(PD)指X線食管鋇餐造影和CT檢查顯示腫瘤增大程度>25%。CR與PR患者為治療有效患者。
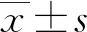
2 結 果
2.1不同臨床特征食管癌患者化療前血清HIF-1α、HO-1、iNOS水平比較 食管癌患者血清HIF-1α、HO-1、iNOS水平分別為(192.75±49.93)ng/mL、(4.47±1.05)μg/L、(71.93±19.75)U/L。不同性別、年齡、病變部位、腫瘤最大徑食管癌患者化療前血清HIF-1α、HO-1、iNOS水平比較,差異無統(tǒng)計學意義(P>0.05);低分化、TNM分期為Ⅳ期、有淋巴結轉移食管癌患者血清HIF-1α、HO-1、iNOS水平高于中、高分化,TNM分期為Ⅱ、Ⅲ期,無淋巴結轉移患者,差異有統(tǒng)計學意義(P<0.05)。見表1。
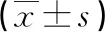
表1 不同臨床特征食管癌患者化療前血清HIF-1α、HO-1、iNOS水平比較
2.2食管癌患者氟尿嘧啶化療療效 102例食管癌患者療效評價結果為CR者11例,PR者69例,SD者16例,PD者6例,其中治療有效者80例,治療有效率為78.43%;治療無效22例,治療無效率為21.57%。
2.3不同療效患者化療前后血清HIF-1α、HO-1、iNOS水平比較 化療有效患者化療前及化療后血清HIF-1α、HO-1水平均低于化療無效患者,且化療有效患者化療前后差值大于化療無效患者,差異有統(tǒng)計學意義(P<0.05);化療有效患者化療前血清iNOS水平高于化療無效患者,化療有效患者化療前后差值大于化療無效患者,差異有統(tǒng)計學意義(P<0.05);化療有效患者與化療無效患者化療后血清iNOS水平比較,差異無統(tǒng)計學意義(P>0.05)。見表2。
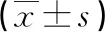
表2 不同療效患者化療前后血清HIF-1α、HO-1、iNOS水平比較
2.4化療前血清HIF-1α、HO-1、iNOS水平對化療療效的預測價值 化療前血清HIF-1α、HO-1、iNOS聯(lián)合檢測預測氟尿嘧啶化療療效的曲線下面積(AUC)為0.859,明顯高于3項指標單獨檢測的AUC(P<0.05)。見表3、圖1。

圖1 化療前血清HIF-1α、HO-1、iNOS水平預測化療療效的ROC曲線

表3 化療前血清HIF-1α、HO-1、iNOS水平對化療療效的預測價值
2.5不同臨床特征患者療效比較 不同性別、年齡、病變部位、腫瘤最大徑、病理分級、TNM分期、淋巴結轉移狀態(tài)患者療效比較,差異無統(tǒng)計學意義(P>0.05);化療前血清HIF-1α、HO-1高表達及iNOS低表達患者有效患者比例分別低于化療前血清HIF-1α、HO-1低表達及iNOS高表達患者,差異有統(tǒng)計學意義(P<0.05)。見表4。
2.6化療近期療效的影響因素分析 將上述差異有統(tǒng)計學意義的因素納入多因素無序多分類Logistic回歸模型,以患者氟尿嘧啶化療敏感性作為因變量,以上述差異有統(tǒng)計學意義的因素作為自變量,并進行賦值,化療前血清HIF-1α<200.60 ng/mL=0,≥200.60 ng/mL=1;HO-1<4.70 μg/L=0,≥4.70 μg/L=1;iNOS<69.00 U/L=0,≥69.00 U/L=1。無序多分類Logisitic回歸分析顯示化療前HIF-1α≥200.60 ng/mL、HO-1≥4.70 μg/L是氟尿嘧啶化療耐藥的獨立危險因素(P<0.05),iNOS≥69.00 U/L是氟尿嘧啶化療敏感的保護因素(P<0.05)。見表5。

表5 化療近期療效的影響因素分析
3 討 論
化療是食管癌綜合治療的重要手段,然而,不同臨床特征食管癌患者對化療藥物的敏感性存在明顯差異,如何有效預測食管癌患者對化療藥物的敏感性,指導針對性化療方案制訂,對患者預后改善具有重要意義[9]。
HIF-1α高表達狀態(tài)有利于腫瘤細胞對于缺氧環(huán)境的適應,從而促使腫瘤細胞增殖和轉移[10-12]。本研究結果顯示,食管癌患者血清HIF-1α水平呈高表達,且不同TNM分期、病理分級與淋巴結轉移狀態(tài)患者血清HIF-1α水平比較,差異有統(tǒng)計學意義(P<0.05)。金磊等[13]研究表明,HIF-1α誘導表達具有抗腫瘤細胞凋亡、降低化療敏感性的作用。本研究中氟尿嘧啶化療有效患者化療前及化療后血清HIF-1α水平均低于無效患者,HIF-1α≥200.60 ng/mL是食管癌患者氟尿嘧啶化療耐藥的獨立危險因素(P<0.05),與上述研究結果一致,分析原因可能在于HIF-1α調(diào)控某些參與DNA修復過程的因子表達,化療藥物對腫瘤細胞損傷無法限制,并通過促進無氧代謝使殘留腫瘤細胞得到必要生存條件,通過抗凋亡促進腫瘤血管生成,降低化療敏感性[14]。本研究中化療前患者血清HIF-1α水平預測氟尿嘧啶化療療效的AUC為0.749,具有較高的預測價值,臨床血清HIF-1α檢測可在一定程度上推測患者對氟尿嘧啶化療的敏感程度。
HO-1作為抗氧化防御酶,具有抗感染、抗氧化應激、抗凋亡等一系列生理功能[15-16]。本研究中TNM分期為Ⅳ期、低分化、有淋巴結轉移食管癌患者血清HO-1水平明顯高于TNM分期Ⅱ、Ⅲ期,中、高分化,無淋巴結轉移患者,表明HO-1可能作為促癌因子參與食管癌發(fā)生、發(fā)展。動物實驗研究表明,使用HO-1抑制劑ZnppIX可增強肺癌、結腸癌細胞化療敏感性,減緩腫瘤生長速度[17]。本研究中化療后患者血清HO-1水平較化療前降低,提示氟尿嘧啶化療可能通過抑制HO-1表達,減少腫瘤侵襲與轉移。與此同時本研究結果顯示,氟尿嘧啶化療有效患者化療前及化療后血清HO-1水平均低于化療無效患者,說明HO-1高表達可降低氟尿嘧啶化療敏感性。分析HO-1參與影響腫瘤耐藥的機制:(1)HO-1高表達常伴隨多藥耐藥蛋白及相關蛋白表達增加,降低癌細胞化療敏感性;(2)氟尿嘧啶化療誘導生成大量活性氧殺傷癌細胞,同時誘導產(chǎn)生的HO-1具有活性氧清除作用,這也是細胞獲得性耐藥的重要原因之一;(3)HO-1可激活多種抗凋亡通路[18]。本研究中化療前患者血清HO-1水平預測氟尿嘧啶化療療效的AUC為0.738,具有較高的預測價值,臨床血清HO-1檢測可在一定程度上推測患者對氟尿嘧啶化療的敏感性。
iNOS主要高表達于缺血、缺氧及損傷狀態(tài)下,通過催化NO合成發(fā)揮重要生理功能。本研究結果顯示,食管癌患者血清iNOS高表達與TNM分期高、病理分級低、有淋巴結轉移關系密切。PEREIRA等[19]的研究顯示,NO抑制劑可加強缺氧誘導的腫瘤耐藥性,其原因可能在于內(nèi)源性NO合成被抑制,對于多種化療藥物,NO均被認為是化學敏感性增強關鍵因子。本研究中氟尿嘧啶化療有效患者化療前血清iNOS水平高于無效患者,說明iNOS高表達可增強氟尿嘧啶化療敏感性,原因可能在于iNOS高表達狀態(tài)下,NO生成增多,促使SIRT1蛋白半胱氨酸巰基S-亞硝基化,降低對抑癌基因p53的去乙酰化能力,促進p53乙酰化,促進細胞凋亡[20]。本研究中化療前患者血清iNOS預測氟尿嘧啶化療療效的AUC為0.739,臨床血清iNOS檢測可在一定程度上反映患者對氟尿嘧啶化療的敏感性,臨床可通過iNOS表達增加,提髙食管癌細胞對氟尿嘧啶化療的敏感性,實現(xiàn)耐藥逆轉。
本研究無序多分類Logistic回歸分析結果顯示,化療前HIF-1α≥200.60 ng/mL、HO-1≥4.70 μg/L是氟尿嘧啶化療耐藥的獨立危險因素(P<0.05),化療前iNOS≥69.00 U/L是氟尿嘧啶化療敏感的保護因素(P<0.05),化療前血清HIF-1α、HO-1、iNOS聯(lián)合檢測預測氟尿嘧啶化療療效的AUC為0.859,高于3項指標單獨檢測的AUC,預測效能較高,可在一定程度上指導臨床食管癌采用氟尿嘧啶化療。
本研究不足之處在于僅從血清層面分析血清HIF-1α、HO-1、iNOS表達及與氟尿嘧啶化療敏感性的關系,此外未對HIF-1α、HO-1、iNOS水平調(diào)節(jié)結合化療是否會獲得更佳的食管癌腫瘤治療療效做進一步研究,后續(xù)可進一步進行相關探討。
綜上所述,食管癌患者血清HIF-1α、HO-1、iNOS高表達與TNM分期、病理分級、淋巴結轉移有關,化療前HIF-1α、HO-1低表達,iNOS高表達患者具有更強的氟尿嘧啶化療敏感性,可在一定程度上用于指導臨床化療。

