男性乳腺包裹性乳頭狀癌合并肉芽腫性乳腺炎1例及文獻復習
吳 念,傅 敏
1.重慶市第五人民醫院甲狀腺乳腺外科,重慶 400062 2.重慶市東南醫院產科,重慶 401336
男性乳腺癌(MBC)在臨床較少見,占所有乳腺癌的0.5%~1.0%,發病率正逐漸上升[1]。乳腺包裹性乳頭狀癌(EPC)是一種少見的膨脹性生長的低級別浸潤性癌,乳頭狀病變的周圍無肌上皮包繞。肉芽腫性乳腺炎(GM)是一種少見的、局限于乳腺小葉的良性肉芽腫性病變。乳腺癌合并GM病例報道極少,國內外報道不超過10例[2-3],而男性EPC合并GM病例更是極為罕見,目前鮮有報道。本研究將報道1例男性EPC合并GM病例,并進行文獻復習,以期對此類疾病的危險因素、臨床病理特征和發病機制、診斷、治療進行深入分析,現報道如下。
1 臨床資料
患者,男,62歲,以“發現左乳包塊4個月”在重慶市第五人民醫院門診就診。偶有左側乳腺觸痛或刺痛,無乳頭溢液表現,無乳腺紅腫及外形改變。既往否認乳腺癌家族史,否認慢性肝病、糖尿病、睪丸炎等疾病。無長期口服藥物病史。查體:雙側乳頭增大,雙乳對稱,形態正常,無紅腫及皮紋改變,未見“橘皮征、酒窩征”。左乳外上象限距乳頭約1.5 cm乳暈區可觸及1.0 cm×1.2 cm大小的腫塊,質韌,邊界不清,活動度差,有觸痛,其余雙側乳腺未觸及明顯包塊,雙側腋窩及雙側鎖骨上下未觸及腫大淋巴結。在局部麻醉下進行左側腫物切除,術中腫物邊界不清,與周圍乳腺組織無明顯界限,灰白色實性腫瘤,無包膜。病理檢查結果:乳腺導管內乳頭狀瘤伴部分導管上皮不典型增生,不排除導管原位癌形成。免疫組化法檢測結果提示:EPC(核低、中級別),CK5/6(-),P63(-),calponin(-),CK8/18(+),ER(80%+++),PR(50%+),Her-2(+),Ki-67(15%+),見圖1A。完善胸部CT檢查,未見明顯異常。腫瘤標志物檢測結果提示:糖類抗原(CA)125、CA153、癌胚抗原(CEA)、CA199、甲胎蛋白(AFP)均為陰性。后續進行左乳切除、左側前哨淋巴結活檢術,病理檢測結果提示:左乳腺病伴GM,見圖1B,間質纖維及膠原纖維組織增生。另送“上切緣、外上切緣、下切緣組織”進行病理檢測,未見腫瘤浸潤。左側腋窩藍染前哨淋巴結3枚,非藍染淋巴結7枚,均呈淋巴組織反應性增生,免疫組化法檢測結果提示:CK-P(上皮+),Ki-67(5%+)。術后恢復良好。術后口服他莫昔芬治療,20 mg,每日1次。術后1年余患者自行發現“左側腋窩包塊”再次來院,查體雙乳區未觸及明顯包塊,左側腋窩可觸及2.0 cm×2.5 cm大小的包塊,質韌,邊界欠清,活動度較差。可疑左乳腺癌腋窩淋巴結轉移。完善胸部CT檢查,結果提示:左側腋窩有兩處腫大淋巴結,肺部呈現慢性炎癥病灶,見圖2。完善乳腺彩超提示左側腋窩異常淋巴結。腫瘤標志物正常。腹部彩超,頭顱MRI檢查均未見明顯異常。再次進行左側腋窩腫大淋巴結切除活檢。術中冰凍切片病理檢測結果提示左腋窩淋巴結反應性增生。術后病理檢測結果提示淋巴組織反應性增生。術后繼續口服他莫昔芬治療,目前恢復良好,正常隨訪中。

注:A為腫瘤具有膨脹性浸潤的組織學特征,與周圍組織有明顯界限,通過一個寬基底附著于囊壁,乳頭數量明顯增多,大小形態不同,上皮成分明顯超過間質,增生成分僅為腫瘤性上皮細胞;B為以小葉為中心的GM,主要細胞成分是上皮細胞、多核巨細胞、中性粒細胞。
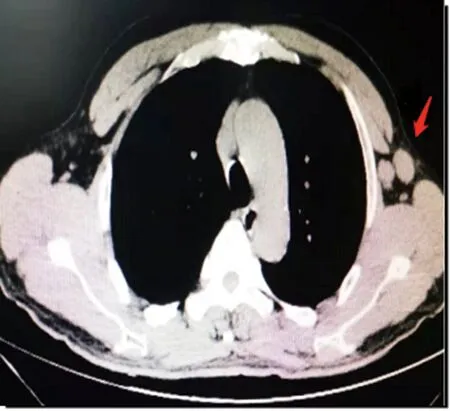
注:左側腋窩可見兩枚腫大淋巴結,表面欠光滑,質地欠均勻,可疑融合,最大約為2.0 cm×1.8 cm。
2 討 論
2.1病因和危險因素 EPC是一種非常少見的乳腺癌,可能與內分泌因素、遺傳因素、營養狀態等相關。GM病因不清,可能與自身免疫反應、乳汁超敏反應、棒狀桿菌感染、口服避孕藥等相關。也有病例報道慢性GM可能是乳腺癌的癌前病變,并且很難區分二者[4]。有乳腺炎病史的女性患乳腺癌的風險略有增加,但也沒有發現炎癥和乳腺癌發展之間的因果關系[5]。非哺乳期乳腺炎作為非炎癥性乳腺癌或導管原位癌(DCIS)的表現是罕見的,這些病例的真實發生率尚不清楚,但有研究證實,高達1.81%的非哺乳期乳腺炎女性最終可在乳腺炎1年后發展為非炎癥性乳腺癌,癌灶可能位于炎癥病變的遠處,非哺乳期乳腺炎可能是乳腺癌的一個危險因素[6]。本病例中,患者為1例62歲老年男性,有乳頭增大表現,無慢性疾病病史及免疫性疾病病史,無口服藥物病史,所以無典型的病因及危險因素。
2.2臨床病理特征與發病機制 男性EPC患者常見的臨床表現多為乳暈區無痛性包塊,部分患者有乳頭溢液、乳頭回縮或皮膚潰瘍等表現。GM患者常無誘因出現疼痛性包塊,病變多為單側,乳腺外上象限出現包塊,位于乳腺實質內,無痛或輕微疼痛,腫塊質硬,邊界不清,可合并同側腋窩淋巴結腫大,部分患者合并下肢紅斑等風濕免疫性疾病。本研究中病例以乳腺乳暈區腫塊為主要表現,偶有刺痛表現。符合男性乳腺癌合并GM的表現,與文獻報道相符[2-3]。
男性EPC發病年齡更大,腫瘤分級、分期更高,雌激素受體陽性比例更高,愈后較好。通常ER、PR陽性,Her2陰性,免疫組化法檢測肌上皮細胞標志物(calponin、P63、SMMHC)結果提示乳頭狀病變的周圍無肌上皮包繞。GM的病理特點多表現為以小葉為單位的慢性炎癥反應,以淋巴細胞為主,可見少量漿細胞,提示出現肉芽腫反應。本研究中病例病理特征為乳腺導管內乳頭狀瘤伴部分導管上皮不典型增生,不能排除導管原位癌形成。免疫組化法檢測結果提示:EPC(核低、中級別),CK5/6(-)、P63(-)、 calponin(-)、CK8/18(+)、 ER(80%+++)、PR(50%+)、Her-2(+)、Ki-67(15%+)。術后病理檢查結果顯示:合并左乳腺病伴GM,間質纖維及膠原纖維組織增生。本病例具有典型的EPC合并GM的典型病理特征。
GM和乳腺癌的并發引起了關于乳腺炎、感染和乳腺癌之間關系的經典和廣泛的討論。 有人提出了炎癥和慢性感染可能與乳腺癌有關的理論。盡管有乳腺炎病史的女性患乳腺癌的總體風險似乎略高,但炎癥和腫瘤病變發展之間的因果關系尚未得到很好的證實[2,7]。國內外報道大約15%的微生物感染與癌癥有關。小鼠乳腺癌病毒可引起跨物種感染,且可引發乳腺癌[8]。可能是宿主的防御機制在應對有害微生物的感染時產生自由基,自由基通過氧化應激和DNA堿基的置換作用導致DNA損傷,引起細胞發育不良,并發展為癌癥。高級別DCIS與圍繞導管管腔的肌上皮細胞層和基底膜的損傷有關[9]。DCIS的非典型表現為乳腺炎可能與DCIS內壞死區域的反復感染有關[10]。
2.3診斷和鑒別診斷
2.3.1男性乳腺癌合并GM的診斷和鑒別 MBC的診斷主要依據臨床表現、乳腺X線鉬靶或乳腺彩超及空心針穿刺組織病理學檢查。最終確診需要組織病理學檢查,同時進行免疫組化法檢測(ER、PR、HER-2等),根據患者情況選擇其他輔助檢查,排除其他疾病,確定腫瘤臨床分期。GM超聲圖像表現為彌漫性低回聲區域、混合性包塊或均質結節型包塊。GM的X線檢查影像表現缺乏特異性,可為邊界不清或不對稱的致密影,或表現為毛刺樣浸潤,腺體結構扭曲。動態增強磁共振成像在臨床非炎癥肉芽腫性小葉乳腺炎和非鈣化導管原位癌鑒別中有一定的優勢[11]。患者血清白細胞介素(IL)-22和IL-23水平在特發性GM中顯示出異常,提示IL-22和IL-23可能是特發性肉芽腫性乳腺炎(IGM)自身免疫性病因學的新發現,有利于鑒別乳腺癌[12]。術前C反應蛋白、清蛋白、纖維蛋白原(Fib)、Fib/Alb、白細胞計數、中性粒細胞、血小板淋巴細胞比值、單核細胞和2 h紅細胞沉降率有相當大的潛力成為炎癥引起的IGM的早期和敏感的生物標志物。這些參數對疾病的復發也有明顯影響,提示它們可能作為鑒別診斷乳腺癌和IGM的實用指標[13]。剪切波彈性成像(SWE)在鑒別IGM與乳腺癌時具有較高的靈敏度和特異度,且IGM的SWE評分和剪切波速(Vs)值較低。在臨床實踐中采用這種方法可以減少不必要的活檢[14]。本例患者血清學指標及腫瘤標志物均未見特殊異常,影像學檢查缺乏特異性表現,診斷主要依靠病理組織學檢查和免疫組化法檢查結果。
2.3.2其他乳腺腫塊的鑒別診斷 (1)男性乳腺發育癥是由于各種原因引起的男性體內雌激素和雄激素比例失調,乳腺導管組織、間質或脂肪增多而導致男性乳房體積增大的疾病,表現為雙側或單側的乳腺乳房結節狀或盤狀增生、肥大,大部分患者可自行消退,大多數患者表現為特發性男性乳房畸形,預后良好。(2)導管周圍乳腺炎(PDM)是一組發生在非哺乳期病原學依據不明的非特異性炎癥或病原學明確的特異性炎癥,指乳腺導管擴張,且擴張后期大量漿細胞浸潤的慢性乳腺非細菌性炎癥。臨床特征表現為伴有或不伴有相關腫塊的乳暈周圍炎癥、乳暈周圍膿腫和乳腺導管瘺管,確診需手術活檢[15]。(3)導管內乳頭狀瘤是由于卵巢內分泌失調、雌激素分泌過多引起的發生在乳腺導管上皮的良性腫瘤,具有惡變潛能,導管上皮細胞可發生不同程度的增生,細胞無異型性。導管乳頭狀瘤可發生在各級導管,主要表現為乳頭溢液、乳腺腫塊,被認為是癌前病變,惡變率為5%~12%,彩超結合病理可確診。(4)導管內乳頭狀癌指乳腺導管內乳頭狀瘤合并早期原位癌,病變局限于乳腺導管或腺泡內,未突破基底膜,臨床以乳頭溢液為主要表現,病變累及管腔周圍肌上皮細胞,EPC的管腔周圍無肌上皮細胞。肌上皮細胞標記物(p63、平滑肌肌球蛋白重鏈、CD10、calponin等)可用于鑒別[16]。(5)浸潤性乳頭狀癌是一種罕見的惡性乳頭狀乳腺腫瘤,當浸潤性病灶出現在纖維包膜時,可以確診為浸潤性癌,P63蛋白和肌球蛋白重鏈等肌上皮細胞標記物陰性,Ki-67指數、腋窩轉移、PR和HER2表達及病理特征等有特異性[17]。
2.4治療
2.4.1手術治療 手術治療是MBC的主要手段。隨著乳腺癌綜合治療研究的不斷深入,診療技術的不斷提高,外科治療模式發生了很大的變化。乳房切除聯合前哨淋巴結活檢是MBC的標準治療模式,國外亦有較多男性乳腺癌保乳的案例[18]。如有高危風險的患者,也可進行改良根治術,腫瘤與胸壁粘連,也可進行根治或擴大根治術,配合放化療、內分泌治療。腫塊型GM的手術沒有固定的手術方案,以徹底切除病灶為原則,病變廣泛者術前可以使用類固醇激素治療以縮小病變,手術切除病灶,減少復發。部分膿腫或竇道型炎癥較為頑固,需用抗結核棒狀桿菌治療或氨甲蝶呤治療,亦有報道頑固復發的GM采用阿達莫單抗靶向治療有效[19]。本研究中這一罕見病例采用左側乳腺切除、左側前哨淋巴活檢術,術后輔助他莫西芬治療,術后未復發轉移。
2.4.2輔助化療 隨著乳腺癌是全身性疾病的觀念逐漸被接受,臨床逐漸達成共識,即規范的輔助化療有助于降低乳腺癌復發轉移風險。由于MBC發病率低,大樣本的隨機對照研究可能性較小,目前治療原則仍借鑒女性乳腺癌的治療指南。蒽環類藥物聯合他莫昔芬輔助治療能有效提高無病生存期(DFS)和總生存期(OS),輔助化療對于有內臟危象、腫瘤快速生長、淋巴結陽性和分化差的患者可能更能獲益[20-21]。
2.4.3輔助放療 放療是降低乳腺癌局部復發的重要手段。參照女性乳腺癌治療原則,當腋窩淋巴結陽性,腫瘤最大徑大于5 cm,切緣陽性時推薦進行放療。MBC分子分型以Luminal A型及Luminal B型為主,根據分子分型選擇對腋窩淋巴結轉移患者進行放射治療,以提高療效,避免或減少無效治療和過度治療。輔助低分割放療和激素治療能明顯改善MBC患者的DFS和OS[22]。
2.4.4內分泌治療 MBC治療中內分泌治療尤為重要,目前推薦單獨采用內分泌治療或聯合其他治療手段。對于大部分ER陽性的MBC,他莫西芬是研究最多、療效最確切的一種非類固醇類抗雌激素藥物,適用于任何年齡的患者,可明顯提高DFS和OS。對于局部復發或遠處轉移的MBC患者,他莫昔芬已作為首選的內分泌治療藥物[23]。目前對芳香化酶抑制劑研究有限,聯合藥物去勢或睪丸切除可能會獲得更好的效果。本研究中病例術后口服他莫西芬近兩年,耐受性良好,目前愈后良好。
盡管男性EPC病理特征各異,男性EPC患者預后較好[24],合并GM,仍需定期復查,術后出現腋窩淋巴結腫大,臨床特征與乳腺癌術后腋窩淋巴結轉移相似,不一定是癌轉移,仍可能是炎癥。術后腋窩淋巴結腫大空心針穿刺和切除活檢是明確病變性質的主要手段。本研究中病例是目前國內第一例報告男性EPC合并GM的病例。對于有IGM背景的乳腺癌患者,必須謹慎鑒別和診斷。由于IGM的慢性進展或同時合并乳腺癌,必須同時進行臨床、放射和病理檢查。在未來幾年,期待多基因檢測技術的改進,可以更精確地預測復發的風險,這可能會導致治療的選擇和時間發生重大變化[25]。

