基于Aβ病理學特征探討固本健腦液對APP/PS1睡眠障礙小鼠的作用①
毛劍琴 袁德培 張譽丹 曾楚華(湖北中醫藥大學,武漢 430000)
阿爾茨海默病(Alzheimer′s disease,AD)俗稱老年癡呆癥,其發病癥狀呈持續性腦部神經系統衰退,患者逐步出現認知功能障礙、記憶功能障礙及行為功能障礙,屬于癡呆癥的一種,統計顯示,AD患者人數占全球癡呆癥患者人數的50%~75%,且發病人數持續增長[1-2]。AD 發病隱匿、不可逆,目前臨床缺乏有效的治療方法,因此尋找具有防治AD 效果的藥物十分必要。AD 發病機制復雜,一方面已知其發病與遺傳有關,另一方面睡眠障礙可能是導致AD 的原因之一。研究發現,不同程度的晝夜節律紊亂多發生于AD 患者或動物,國外學者也指出AD 病情發展進程與睡眠障礙相關,推測睡眠障礙可能是導致AD的重要病因[3-6]。中醫將AD歸于“癡呆”“善忘”一類,主治以“固本健腦”為原則[7-8]。固本健腦液是代表方劑,具有補腎健脾、健腦安神功效,能夠通過多靶點保護AD 小鼠神經元不受損傷[9]。本實驗以APP/PS1 雙轉基因癡呆小鼠為研究對象,觀察固本健腦液對其睡眠障礙的干預效果,并分析可能的作用機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物 30 只雄性SPF 級6 月齡APP/PS1 小鼠及10 只雄性SPF 級6 月齡正常小鼠均由南京生物醫藥研究院提供,生產許可證號:SCXK(蘇)2015-0001,小鼠適應性喂養1周,APP/PS1小鼠隨機分為模型組及實驗組(固本健腦液低、高劑量組)。本研究經湖北中醫藥大學倫理學委員會批準(HUCMS202011010),實驗操作均符合醫學倫理學要求。
1.1.2 藥物及試劑 固本健腦液方劑為15 g 板橋黨參、15 g枸杞、15 g茯苓、12 g酸棗仁、12 g山楂,加入藥材6 倍量冷水浸泡30 min 后武火煎煮30 min,轉文火煎煮30 min,濾出藥液(該過程重復2 次)。將2 次濾出的藥液混勻,高溫加熱濃縮制成0.625、2.5 g/ml 藥液,低溫保存備用[10]。HE 染液(貨號:G1120,北京索萊寶科技有限公司);尼氏染液(貨號:E607316-0100,上海生工生物工程股份有限公司);TNF-α、IL-1β、β 樣淀粉蛋白1-42(Aβ1-42,貨號:AD20104、AD20079、AD21893)ELISA 試劑盒(武漢艾迪抗生物科技有限公司)。
1.1.3 實驗儀器 GS-15R 型離心機(美國Beckman 公司);BIOBASE-EL10A 型酶標儀(山東博科再生醫學有限公司);CX23 型生物顯微鏡(日本Olympus 公司);CytoFLEX 流式細胞儀(美國Beckman Coulter公司)。
1.2 方法
1.2.1 建模及給藥 采用多平臺水環境法建立小鼠模型,用自制睡眠剝奪箱對除對照組外的其他組進行睡眠剝奪,剝奪時間為每天12 h,連續剝奪4 周[11]。模型組及實驗組(固本健腦液低、高劑量組)均為APP/PS1 雙轉基因小鼠,對照組為正常小鼠。實驗組(固本健腦液低、高劑量組)分別灌胃0.625、2.5 g/ml 固本健腦液,劑量為10 ml/(kg·d),對照組及模型組灌胃等量生理鹽水。
1.2.2 小鼠行為學檢測 采用Morris 水迷宮檢測小鼠行為,使用虛線將水迷宮水池分為4 個象限,第三象限內放置1 個有機玻璃平臺,加水至水面超過平臺2 cm,滴加牛奶將水池染白。提起小鼠尾部將其面朝4 個象限固定位置的池壁放入水池,記錄其找到平臺所用時間(即逃避潛伏期),時間越短表示小鼠學習記憶能力越強(實驗前持續訓練小鼠5 d,第6天開始實驗)。
1.2.3 小鼠晝夜節律檢測 觀察小鼠自主活動時間,將小鼠置于12 h/12 h 光暗循環條件下培養(光照時間為早8:00 至晚8:00,黑暗時間為晚8:00 到第2 天早8:00),每3 h 記錄1 次小鼠自由活動時間(記錄時間為3 min),記錄各組小鼠光照活動時間、黑暗活動時間及總自由活動時間。
1.2.4 小鼠血清TNF-α、IL-1β 水平檢測 取小鼠尾靜脈血5 ml,3 000 r/min 離心10 min,取上清,采用ELISA 試劑盒檢測小鼠血清炎癥因子TNF-α、IL-1β水平。
1.2.5 小鼠海馬組織Aβ1-42水平檢測 處死小鼠,取出完整腦組織,分離得到海馬組織,使用PBS緩沖液制成海馬組織混懸液,4 ℃、3 000 r/min離心10 min,取上清,采用ELISA 試劑盒檢測小鼠海馬組織Aβ1-42水平。
1.2.6 小鼠海馬組織細胞凋亡水平檢測 取部分海馬組織加入胰蛋白酶消化,反復吹打制成單層細胞懸液,3 000 r/min離心10 min,棄上清,PBS緩沖液清洗2 次,Annexin X 染色,流式細胞儀、flowcytometry軟件檢測分析。
1.2.7 小鼠海馬組織病理學特征檢測 取小鼠腦部海馬組織,4%多聚甲醛固定,脫水后石蠟包埋,切5 μm片,脫蠟,HE、Nissl染色觀察病理學情況。
1.3 統計學處理 使用SPSS20.0軟件進行統計學分析,符合正態分布的計量資料以xˉ±s 表示,單因素方差分析用于多組間比較,LSD 分析用于組間兩兩比較,P<0.05為差異有統計學意義。
2 結果
2.1 各組小鼠逃避潛伏期時間比較 相較于對照組,模型組小鼠逃避潛伏期時間明顯延長(P<0.05);相較于模型組,固本健腦液各劑量組小鼠逃避潛伏期時間均不同程度縮短(P<0.05,表1)。
表1 各組小鼠逃避潛伏期時間比較(,n=10)Tab.1 Comparison of latency time of escape of mice in each group(,n=10)
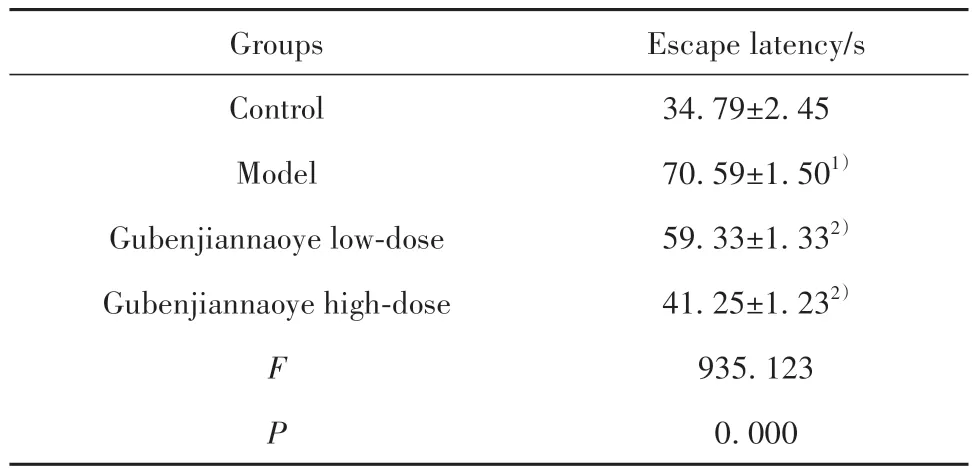
表1 各組小鼠逃避潛伏期時間比較(,n=10)Tab.1 Comparison of latency time of escape of mice in each group(,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.2 各組小鼠自由活動時間比較 相較于對照組,模型組小鼠光照活動時間、黑暗活動時間及總活動時間均明顯延長(P<0.05);相較于模型組,固本健腦液各劑量組小鼠光照活動時間、黑暗活動時間及總活動時間均不同程度縮短(P<0.05,表2)。
表2 各組小鼠自由活動時間比較(,n=10)Tab.2 Comparison of free movement time of mice in each group(,n=10)
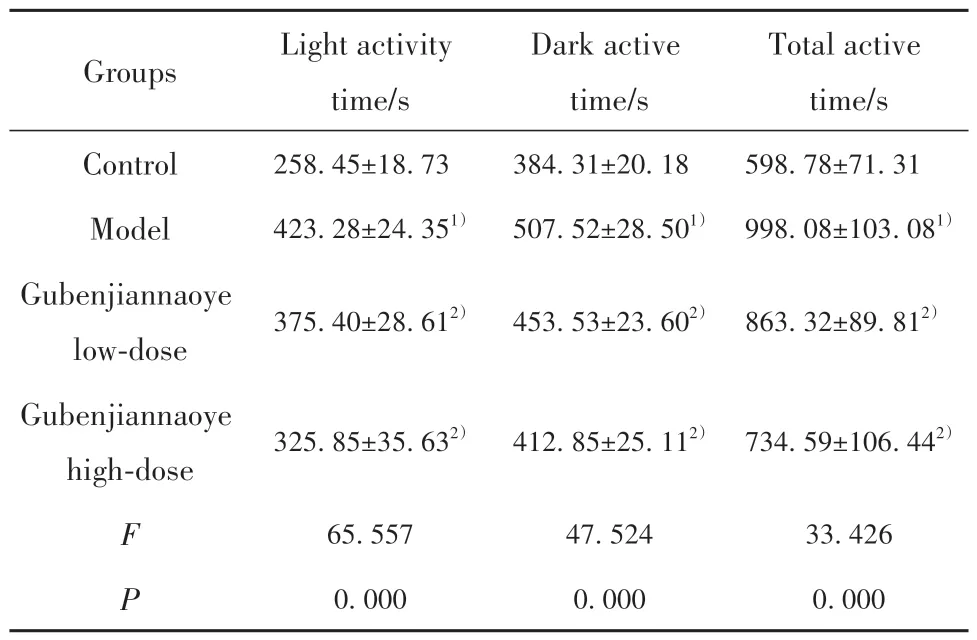
表2 各組小鼠自由活動時間比較(,n=10)Tab.2 Comparison of free movement time of mice in each group(,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.3 各組小鼠血清TNF-α、IL-1β 水平比較 相較于對照組,模型組小鼠血清TNF-α、IL-1β 水平均明顯升高(P<0.05);相較于模型組,固本健腦液各劑量組小鼠血清TNF-α、IL-1β 水平均不同程度降低(P<0.05,表3)。
表3 各組小鼠海馬組織TNF-α、IL-1β 水平比較(,n=10,pg/L)Tab.3 Comparison of TNF-α and IL-1β levels in hippocampal tissues of mice in each group(,n=10,pg/L)
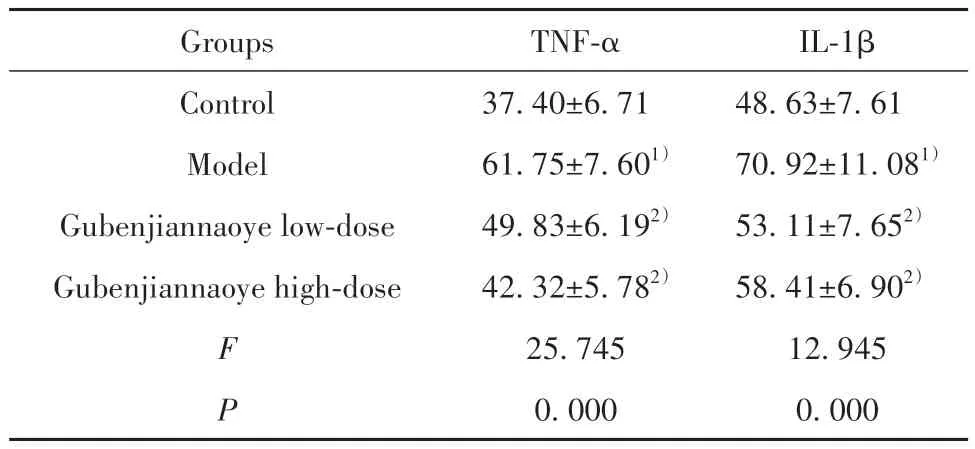
表3 各組小鼠海馬組織TNF-α、IL-1β 水平比較(,n=10,pg/L)Tab.3 Comparison of TNF-α and IL-1β levels in hippocampal tissues of mice in each group(,n=10,pg/L)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.4 各組小鼠海馬組織Aβ1-42水平比較 相較于對照組,模型組小鼠海馬組織Aβ1-42水平明顯升高(P<0.05);相較于模型組,固本健腦液各劑量組小鼠海馬組織Aβ1-42水平均不同程度降低(P<0.05,表4)。
表4 各組小鼠海馬組織Aβ1-42水平比較(,n=10)Tab.4 Comparison of Aβ1-42 level in hippocampal tissues of mice in each group(,n=10)
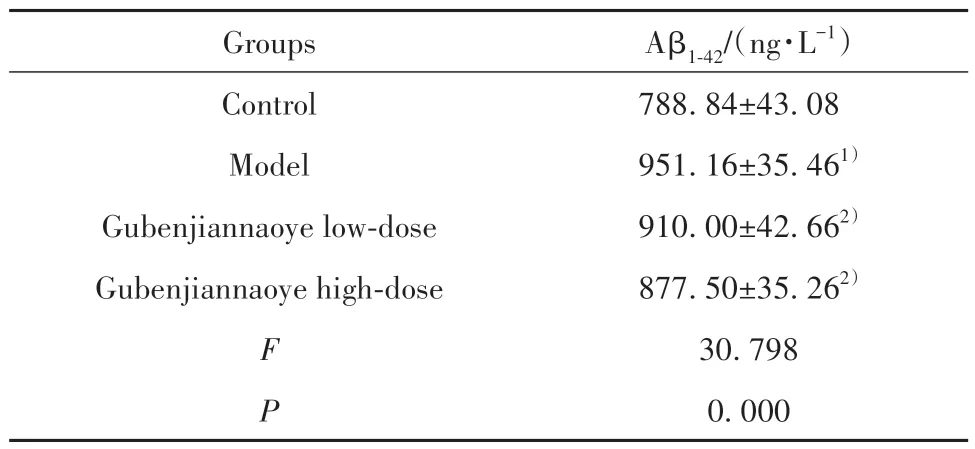
表4 各組小鼠海馬組織Aβ1-42水平比較(,n=10)Tab.4 Comparison of Aβ1-42 level in hippocampal tissues of mice in each group(,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.5 各組小鼠海馬組織細胞凋亡率比較 相較于對照組,模型組小鼠海馬組織細胞凋亡率明顯升高(P<0.05);相較于模型組,固本健腦液各劑量組小鼠海馬組織細胞凋亡率均出現不同程度降低(P<0.05,表5、圖1)。

圖1 各組小鼠海馬組織細胞凋亡率比較Fig.1 Comparison of apoptosis rate in hippocampal tissues of mice in each group
表5 各組小鼠海馬組織細胞凋亡率比較(,n=10)Tab.5 Comparison of apoptosis rate in hippocampal tissues of mice in each group(,n=10)
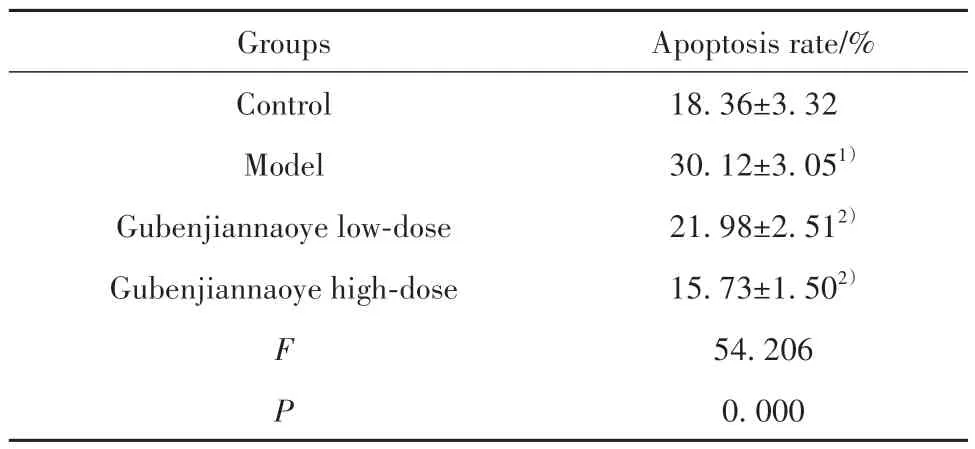
表5 各組小鼠海馬組織細胞凋亡率比較(,n=10)Tab.5 Comparison of apoptosis rate in hippocampal tissues of mice in each group(,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.6 各組小鼠海馬組織病理學特征比較 對照組小鼠海馬組織神經細胞排列整齊,形狀完整且數量較多,細胞內尼氏體數量密集豐富;模型組小鼠海馬組織神經細胞排列混亂,細胞體積皺縮且數量減少,細胞內尼氏體數量減少;相較于模型組,固本健腦液各劑量組小鼠海馬組織神經細胞及尼氏小體均明顯改善(圖2)。

圖2 各組小鼠海馬組織病理學特征比較(×400)Fig.2 Comparison of histopathological characteristics of hippocampus in each group of mice(×400)
3 討論
隨著社會老齡人口不斷增加,AD 患病率也逐漸升高,目前仍普遍認為其發病機制為腦組織Aβ異常沉積,因此臨床可通過調節Aβ 沉積影響AD 發病進程[10-11]。另有研究表明,睡眠是調節學習記憶和情緒的重要腦部活動,而睡眠障礙會導致記憶功能減退、認知能力降低,從而增加患AD 的可能性,且大部分AD 患者均存在不同程度的睡眠節律紊亂[12-14]。固本健腦液是具有健腦安神功效的一種方劑,早期研究提示其湯劑能夠明顯改善AD 模型小鼠睡眠障礙及學習記憶能力[15]。本研究在此基礎上進一步分析其作用機制。
腦組織Aβ 沉積是目前已知的AD 主要發病機制之一,研究表明通過慢性睡眠剝奪能夠促進AD模型小鼠腦組織Aβ 沉積,進一步損害AD 小鼠記憶功能,推測睡眠節律紊亂可能造成腦組織內Aβ 異常沉積,促發AD[16]。AD 患者腦組織內存在大量炎癥反應,腦組織炎癥反應能夠抑制神經元新生、加速神經元丟失,進一步加重腦組織損傷[17];AD 腦組織炎癥反應主要由神經膠質細胞及星形膠質細胞在病理條件下過度激活引發[18]。以上兩種細胞被腦組織內Aβ 等毒性物質過度激活促進炎癥因子表達,包括TNF-α、IL-1β 等,TNF-α、IL-1β 一方面加速神經細胞凋亡,另一方面降低神經細胞增殖分化能力,兩方面作用共同造成腦神經損傷[19]。
本研究表明,與正常小鼠相比,AD 模型小鼠逃避潛伏時間、光照活動時間、黑暗活動時間及總活動時間、血清TNF-α、IL-1β 水平、海馬組織Aβ1-42水平及細胞凋亡率均明顯升高,通過HE、Nissl 染色觀察其海馬組織病理情況,對照組小鼠海馬組織神經細胞排列整齊,形狀完整且數量較多,細胞內尼氏體數量密集豐富,而模型組小鼠海馬組織神經細胞排列混亂,細胞體積皺縮且數量減少,細胞內尼氏體數量減少。提示相較于正常小鼠,AD 模型小鼠睡眠節律紊亂、學習記憶能力下降、炎癥反應加劇、海馬組織神經細胞凋亡增加且Aβ1-42含量增多,與既往研究結果相符。與AD 模型小鼠相比,固本健腦液灌胃給藥后小鼠睡眠障礙、學習記憶能力、炎癥反應、海馬組織神經細胞凋亡水平及病理情況均明顯改善,海馬組織Aβ1-42含量比較發現實驗組小鼠Aβ1-42含量明顯降低,推測可能由于固本健腦液抑制了AD 腦組織Aβ1-42沉積,在一定程度對AD 小鼠發揮了治療作用。
綜上,固本健腦液對APP/PS1 睡眠障礙小鼠的神經功能具有一定保護作用,其作用機制可能與抑制AD 腦組織Aβ 沉積、進一步抑制腦組織炎癥反應及神經細胞凋亡有關。固本健腦液對AD 患者的臨床治療作用未來還需進一步驗證。