HCST作為1型糖尿病潛在分子標志物的篩選和機制探究①
侯永旺 楊志聰 史 麗(河北北方學院附屬第一醫院,張家口 075000)
1 型糖尿病(type 1 diabetes mellitus,T1DM)是兒童最常見的慢性病之一,最常見的發病年齡為4~6歲和青春期早期(10~14歲)。T1DM的發病率和患病率一直穩步上升,占糖尿病患者的5%~10%。在世界范圍內,發病率也存在相當大的地域差異。據報道,發病率最高的是芬蘭和其他北歐國家,其發病率約是報告發病率最低的中國和委內瑞拉的400倍[1-3]。在T1DM中,胰島中的β細胞在數月或數年內被免疫破壞,導致胰島素絕對缺乏。目前研究人員認為該病存在遺傳傾向,與特定HLA(DR 和DQ)等位基因密切相關,且T1DM 具有家族遺傳傾向[4-8]。目前公認的T1DM 與自身免疫應答密切相關,最近有學者發現miR-150 缺失通過細胞免疫應答促進T1DM 發生,TNFSF14在STZ 誘導的T1DM 中發揮重要作用,其可能通過下調CD4+FoxP3+Treg 分化介導T1DM 發生,這些研究說明免疫應答異常與T1DM 密切相關[9-10]。現有的預測T1DM 的主要血清標志物包括抗β細胞自身抗體、抗胰島素的自身抗體(IAA)、抗胰島素瘤相關抗原-2 的自身抗體(IA-2)、抗谷氨酸脫羧酶的自身抗體(GAD)、抗鋅轉運蛋白8的自身抗體(ZnT8)和胰島細胞抗體(ICA),但有些抗體的陽性率不是很高[11-13]。因此探尋新的分子標志物對于T1DM的預測和診斷治療具有重要意義。
本文主要通過生物信息學手段篩選出T1DM 患者中的71 個差異表達基因(differentially expressed genes,DEGs),最終確定免疫相關基因造血細胞信號轉導子(hematopoietic cell signal transducer,HCST)為T1DM 的關鍵基因。研究發現HCST 可以編碼跨膜信號適配器,并與C型凝集素樣受體NKG2D 形成免疫識別受體復合物,該復合物可能通過激活樹突狀細胞(dendritic cells,DCs)、自然殺傷(natural killer,NK)細胞和T 細胞在細胞的存活和增殖中發揮作用[14-15]。因此,HCST 可能是T1DM 的有效分子標志物。
1 資料與方法
1.1 資料 從GEO 數據庫搜索T1DM 和健康人群的外周血單個核細胞微陣列表達數據。通過篩選得到GPL570 平臺的GSE55098 數據集。該數據集中各包含10例健康人群和12例T1DM。
1.2 方法
1.2.1 篩選DEGs 從GEO 數據庫下載矩陣文件,借 助GEO2R 分 析DEGs(P<0.05,log2|FC| ≥1)。RStudio 軟件加載“gplots”“heatmap”“ggplot2”做熱圖和火山圖可視化分析。
1.2.2 蛋白互作(protein-protein interaction,PPI)網絡和關鍵基因篩選 利用String(https://string-db.org/)對DEGs 進行PPI 分析,設置combined sore>0.4對分析結果進行篩選,并利用Cytoscape 軟件(v3.8.0)進行可視化。采用MCODE 插件對PPI 進行加權網絡分析,篩選關鍵的子網絡和基因,并對子網絡做富集分析。利用cytoHubba 插件對PPI 網絡進行關鍵基因篩選,對4 種計算方式[MCC(maximun clique centrality)、DMNC(maximum neighborhood component)、MNC(maximun neighborhood component)和Degree]得到的前5 個關鍵基因進行Venn分析,確定最終的關鍵基因。
1.2.3 富集分析 借助DAVID 在線分析工具對PPI子網絡基因進行GO(gene ontology)分析[包括生物過程(biological process,BP)、細胞組分(cellular component,CC)、分子功能(molecular function,MF)]和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析。富集分析的結果通過在線網站(http://www.bioinformatics.com.cn)進行可視化。
1.3 統計學處理 使用GraphPad Prims 9 軟件對兩組關鍵基因表達量進行統計分析和受試者工作特征曲線(receiver operating characteristic curve,ROC)分析,兩組間比較采用t檢驗,P<0.05 表示差異具有統計學意義。
2 結果
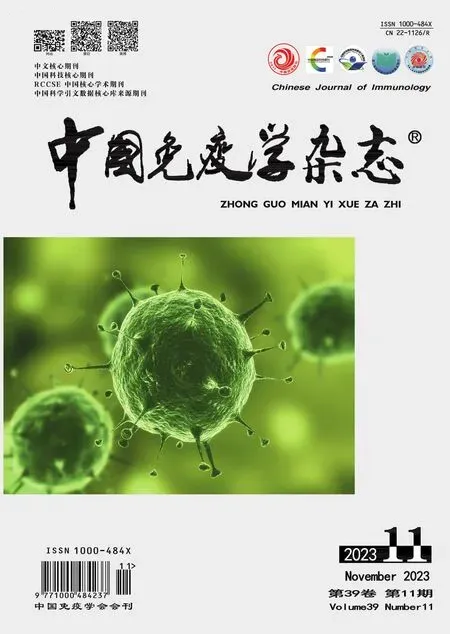
2.1 篩選DEGs 通過P<0.05 和log2|FC|≥1 的條件對GSE55098 數據集進行篩選,T1DM 與對照組相比共得到71 個DEGs,其中有上調基因22 個,下調基因49個(圖1)。
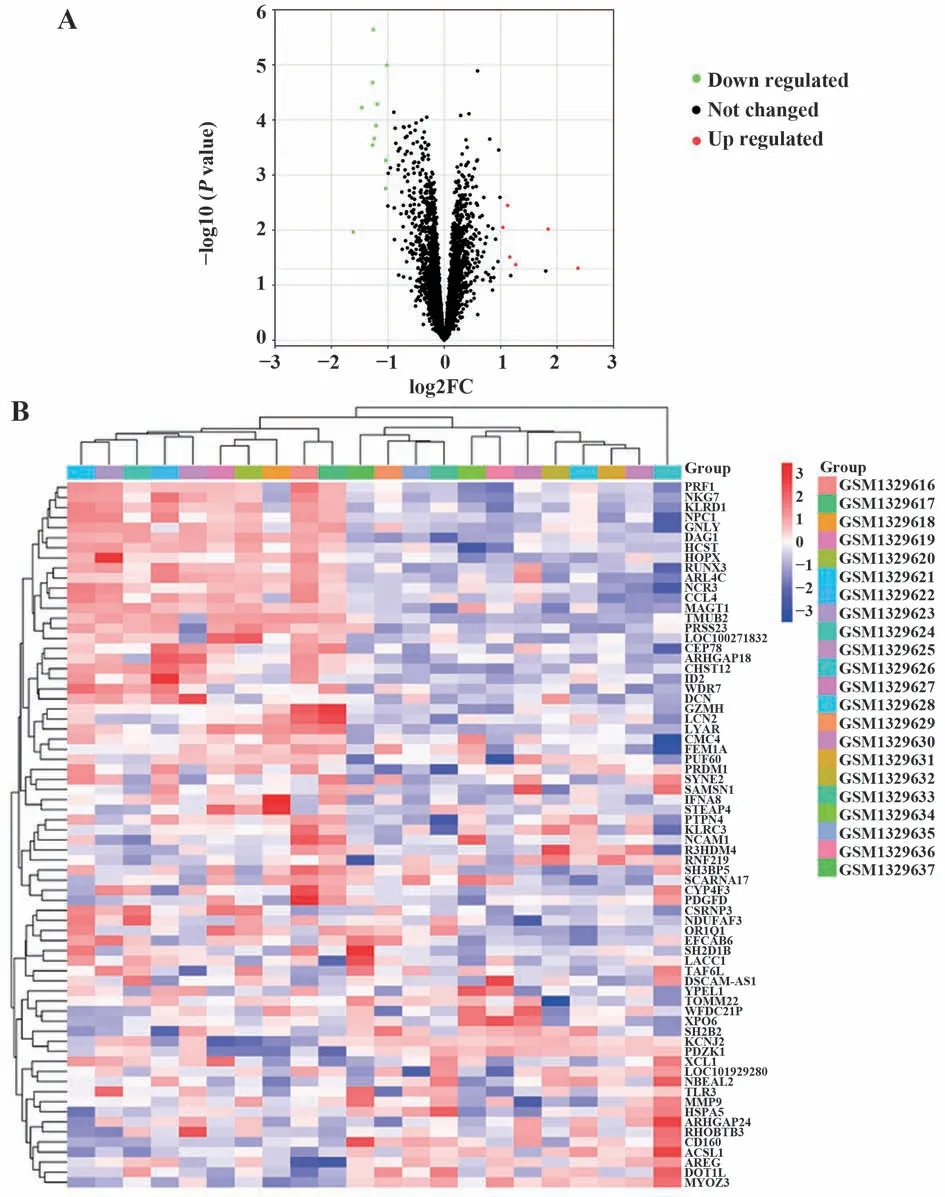
圖1 DEGs的篩選Fig.1 Screen of DEGs
2.2 PPI 網絡構建及子網絡功能富集 PPI 分析結果顯示,String 設置0.4 的PPI 信任值,且僅顯示27 個節點,58 個互作關系(圖2A)。利用MCODE 插件篩選1 個關鍵子網絡,得分7.5,共有9 個節點和30 個互作關系(圖2B)。通過對子網絡的9 個基因進行GO 和KEGG 富集分析發現,這9 個基因主要參與調節免疫反應、細胞的防御反應、免疫應答及細胞溶解的生物過程,涉及的主要信號通路是NK 細胞介導的細胞毒作用的信號通路(圖2C、表1)。
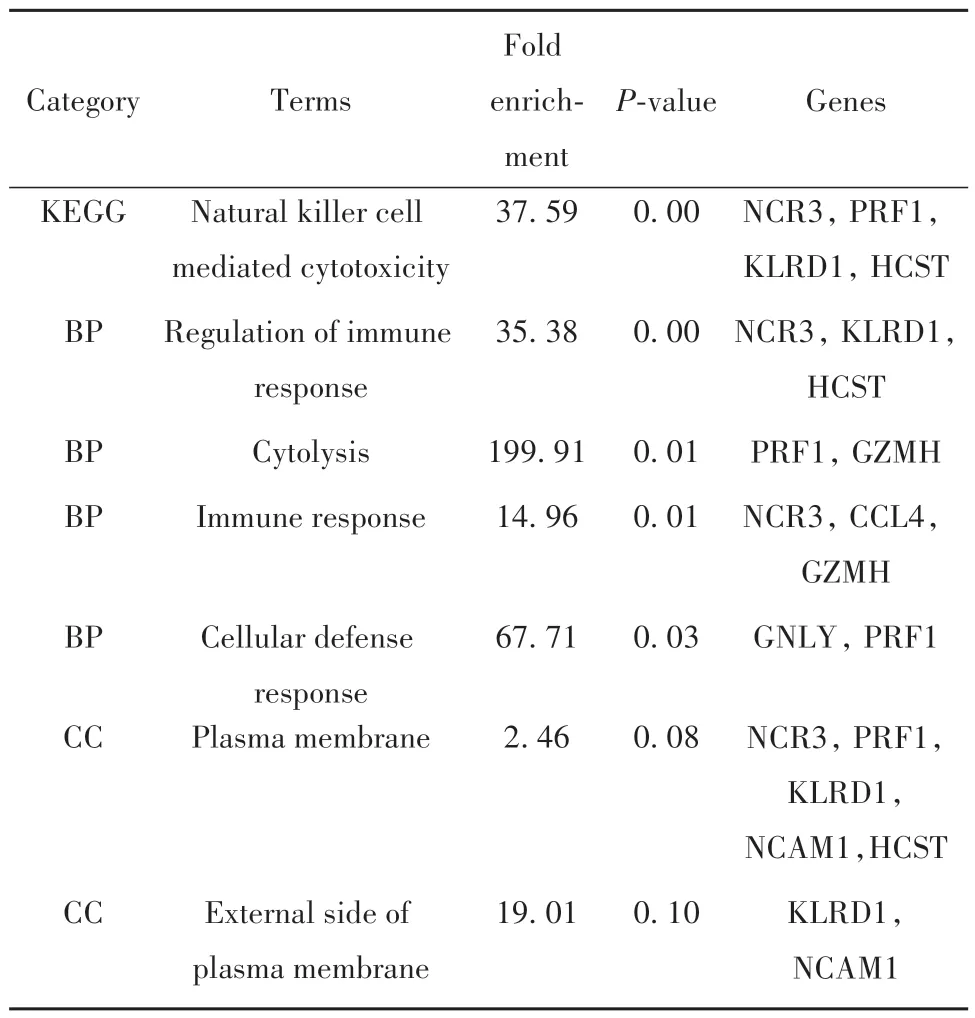
表1 GO和KEGG富集分析Tab.1 GO and KEGG enrichment analysis
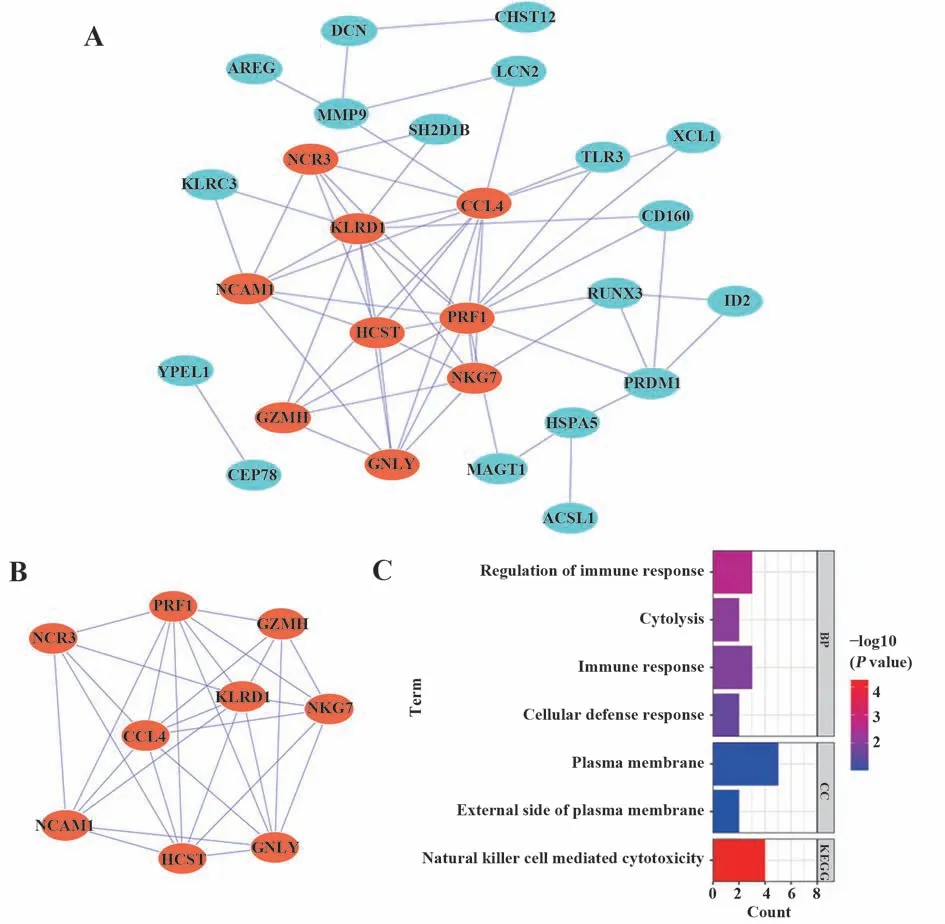
圖2 PPI網絡構建及子網絡功能富集Fig.2 PPI network construction and subnetwork function enrichment
2.3 關鍵基因篩選 MCC 算法得到前5 個關鍵基因為有PRF1、CCL4、KLRD1、HCST 和GNLY;DMNC算法得到的前5 個關鍵基因為HCST、GNLY、GZMH、NKG7 和NCAM1;MNC 算法得到的前5 個關鍵基因PRF1、KLRD1、CCL4、NKG7 和HCST;Degree算法得到的前5 個關鍵基因為PRF1、CCL4、KLRD1、NKG7 和HCST(圖3A)。4 種算法得到的關鍵基因通過Venn 分析最終篩選出1 個關鍵基因,即HCST(圖3B)。
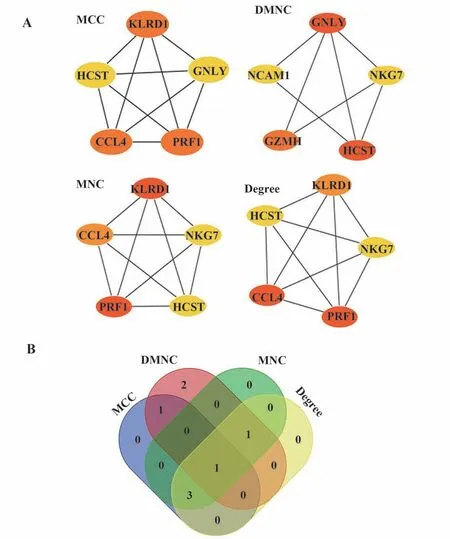
圖3 關鍵基因篩選Fig.3 Screen of hub genes
2.4 HCST 在T1DM 中的表達量及ROC 曲線 對GSE55098 數據集中10 例健康人群和12 例T1MD 患者的HCST 表達量進行對比分析,結果顯示HCST 在T1DM 組的表達量明顯低于健康對照組,差異有統計學意義(圖4A)。HCST 的ROC 曲線分析結果顯示曲線下面積為0.983 3,P=0.0001,差異有統計學意義(圖4B)。
3 討論
T1MD 是由胰腺β 細胞與免疫系統間的復雜相互作用所引起。但是機體中針對β細胞的免疫反應是隨機的還是存在誘發因素尚存在爭議[16-17]。一種長期存在的假說認為,病毒感染是T1DM 自身免疫反應的潛在觸發因素。在病毒中,腸道病毒是研究最多的。糖尿病預測與預防研究證實了腸道病毒感染與第1個自身抗體出現間的關系[18]。但目前大多數對于T1DM 免疫功能障礙的研究集中在下游T細胞和B 細胞的適應性反應,而忽視了上游先天參與者如NK細胞的作用。研究發現,與T1DM 有關的許多病毒是慢性潛伏或溶原性感染,它們通過類似于妊娠耐受的機制降低NK細胞的反應和數量。NK細胞對感染的抑制反應導致不正確的信號傳導,這種不適當的抗原呈遞導致了CD8+淋巴細胞的增殖和細胞毒性[19-20]。
NK 細胞對病原體做出反應并直接將其殺死,此外,NK 細胞還參與了適應性免疫反應的強度和精細控制。最近的研究表明,NK 細胞控制下游反應的效應和抑制活性,包括激活或殺死抗原提呈細胞和Treg、細胞毒性T 淋巴細胞(CTLs)、T 輔助細胞(Th)和B 細胞[21-23]。NK 細胞的作用是調節細胞毒性CD8+T 淋巴細胞反應,從而控制異常或慢性炎癥反應,避免未識別的細胞和組織遭到破壞[24]。EB病毒被證明能有效抑制NK 細胞,從而抑制NK 細胞對細胞毒性CD8+T 淋巴細胞反應的調節[25-26]。研究發現,在NOD 模型中,NK 細胞介導CD8+細胞毒性T 淋巴細胞的破壞可改善自身免疫性糖尿病[27]。
本文通過篩選GSE55098 數據集中T1DM 的差異基因并構建PPI網絡,借助MCODE 插件篩選關鍵子網絡,通過對子網絡基因功能富集分析發現HCST及相關基因主要富集在NK 細胞導致的細胞毒信號途徑,并參與調節免疫反應、細胞的防御反應、免疫應答及細胞溶解的生物過程。同時,本研究結果表明HCST 在T1DM 中表達量顯著降低。因此課題組認為HCST 基因的降低引起了NK 細胞參與的固有免疫及相關信號通路的功能發生紊亂,這使得在發生病毒感染或存在其他誘導因素的情況下,NK 細胞的錯誤遞呈作用導致了異常的細胞毒作用,最終胰島β 細胞遭到慢性損傷并導致T1DM 發生。這些結果與BAYER 等[19]的觀點相似,進一步證實了本研究結果。ROC 曲線結果表明,HCST 可以成為診斷T1DM的潛在分子標志物。
綜上所述,HCST 在T1DM 中表達量降低,或可成為診斷T1DM 的潛在分子標志物。此外,HCST 引起了NK 細胞參與的固有免疫及相關信號通路的功能紊亂,導致T1DM 發生,因此HCST 可能成為治療T1DM的潛在靶點。