植物多酚調控腸道微生態改善炎癥性腸病的研究進展①
閆成花 況文東 廖永翠 丁 堅 靳 亮 萬紅嬌 馬廣強
(江西中醫藥大學中醫學院/生命科學學院,南昌 330004)
炎癥性腸病(inflammatory bowel diseases,IBD)是一種回腸和結腸中含有大量炎癥因子導致的自身免疫病,也是一種病因較為復雜的胃腸道紊亂性疾病,主要包括潰瘍性結腸炎(ulcerative colitis,UC)和克羅恩病(Crohn′s disease,CD)[1-2]。UC 主要表現為結腸及直腸內壁長時間的炎癥和潰瘍,而CD 主要表現為整個消化系統存在大量炎癥。無論是UC還是CD,患者都伴有嚴重腹瀉、腹痛、便血和體重減輕,且慢性長期炎癥也是癌癥,如消化系統癌癥的主要誘因,臨床發現腸炎患者結直腸癌發病率高于健康人[3-4]。一直被視為西方世界疾病的IBD 目前已經全球化,發病率不斷升高[5-6]。IBD 是一種慢性進展性疾病,需長期治療,且治療藥物昂貴,給社會帶來了沉重的經濟負擔。
IBD 難以治愈且易復發,其病因尚不清楚,既具有遺傳傾向,又與環境因素、免疫因素、腸道菌群等密切相關[7]。目前常用治療手段主要為手術切除炎癥組織或采用抗炎藥物。重癥患者治療主要依賴于腫瘤壞死因子(tumor necrosis factor α,TNF-α)等中和性抗體或免疫抑制劑,盡管TNF-α 拮抗劑在治療IBD 方面療效顯著,但10%~30%患者對該藥物不敏感,30%~50%應答患者用藥1 年后產生耐藥性[8-9]。這種治療手段僅能進行病癥緩解而無法根治,且很多藥物使用后會出現明顯副作用[10]。手術治療也有并發癥風險,如盆腔炎、大出血和腸穿孔,且受患者年齡和身體狀況限制[11]。因此,IBD 目前仍無有效治療手段。植物多酚化合物具有抗炎、抗菌及抗氧化等多種生物學活性,在多種疾病中發揮重要作用,尤其是炎癥性疾病,本文旨在探討植物多酚調節腸道菌群在IBD中的研究進展。
1 IBD的發病機制
IBD 發病機制復雜,主要受腸道菌群、遺傳及環境等因素影響。人體腸道微生物群由1 000 多種微生物組成,主要分為4個門:厚壁菌門、擬桿菌門、變形菌門和放線菌門。健康個體的腸道微生物群對宿主有益,可促進機體消化吸收、合成維生素,為機體提供營養物質,還可輔助清除病原微生物,保護腸黏膜[12]。腸道微生物群失調包括有益菌減少、有害菌增加以及微生物多樣性減少,將改變宿主-微生物相互作用,影響宿主免疫系統及營養物質吸收代謝,進而破壞腸道上皮黏膜屏障,促進腸道炎癥[13-14]。隨著GWAS 技術和二代測序技術發展,已確定了240 多個與IBD 相關的非重疊遺傳風險位點,其中約30 個基因位點是CD 和UC 共有的[15-16]。與IBD 相關的易感基因包括IL-23R、NOD2、自噬相關基因ATG16L1和IRGM、IL12B、JAK2、STAT3、CARD15等[17]。IL-23R是第一個通過GWAS 鑒定出的IBD 相關基因,GWAS 分析發現IL-23R中存在多個與CD 和UC 高度相關的單核苷酸多態性(single nucleotide polymorphism,SNP)[18]。核苷酸結合寡聚結構域2(nucleotide-binding oligomerization domain 2,NOD2)是NOD 家族成員之一,約1/3的CD 患者會發生NOD2突變[19]。NOD2 突變后,NF-κB 信號通路異常激活,從而誘導大量炎癥因子產生。自噬相關基因在IBD 中也具有重要作用,ATG16L1編碼的T300A 突變促進SQSTM1/p62 積累,TRAF6 及RIPK2多泛素化增強,使細胞具有異常的TLR 信號[20]。除NF-κB 信號通路和自噬相關信號通路外,JAK/STAT和TGF-β1/SMADs 信號通路也參與IBD 發生發展[21]。研究表明,許多環境因素與IBD 發病密切相關。調查顯示,空氣污染物排放總量與成人 IBD 住院人數直接相關[22]。大數據分析發現,與從不吸煙者相比,吸煙者患CD 風險增加,患UC 風險降低[23]。此外,扁桃體切除術、闌尾切除術、抗生素使用、口服避孕藥、維生素D缺乏、不良飲食等也是與IBD 發生密切相關的環境因素[24]。高脂肪、高蛋白、高糖、低纖維飲食與IBD發病率呈正相關。角叉菜膠和表面活性劑等食品添加劑可能增加患IBD風險。飲食中的軟飲料、飽和脂肪、紅肉和麩質含量也有助于IBD發展[25]。
2 腸道菌群在IBD中的作用
越來越多的證據表明,腸道微生物群失調與人類IBD 發展有關。與健康受試者相比,IBD 患者腸道中微生物群組成發生改變,主要為厚壁菌門和擬桿菌門比例降低,變形桿菌比例升高[26]。乳酸桿菌等有益菌可減少結腸中的氧化應激,IBD 患者腸道中有益菌比例降低導致活性氧過度產生,進一步加劇腸道菌群失調[27]。CD和UC患者中黏附侵襲型大腸桿菌比例分別為75%和69%,遠高于健康人,侵襲型大腸桿菌等有害菌通過與腸道腸腔內免疫細胞相互作用促進IBD,甚至導致結直腸癌[28]。除腸道微生物組成及比例變化影響IBD 外,微生物多樣性也參與IBD 調節。與健康個體相比,IBD 患者腸道微生物群多樣性顯著降低,多樣性降低主要來自厚壁菌門,CD 患者中僅有13 個厚壁菌門,而健康受試者中有43 個[29]。此外,微生物代謝產物在IBD 中也具有重要作用。研究發現,IBD 患者中產生短鏈脂肪酸(short-chain fatty acid,SCFA)的菌株減少,SCFA 作為結腸上皮細胞的主要能量來源,可調節免疫細胞,減少促炎因子,緩解IBD[30]。梭狀芽孢桿菌參與色氨酸代謝,將色氨酸分解為吲哚衍生物,UC患者色氨酸代謝失調,產生的吲哚衍生物明顯減少[31]。次級膽汁酸主要為膽汁酸在腸道微生物作用下轉變而來,IBD 患者中次級膽汁酸產生明顯減少[32]。
腸道中有大量CD4+T 細胞定居,腸道微生物群通過調節CD4+T 細胞亞群分化調控IBD 發生發展。研究發現分段絲狀桿菌(SFB)定植水平與腸道中Th17豐度密切相關,SFB特異性抗原被表達MHC-Ⅱ的CD11c+DCs 識別,作用于下游Th17,促進Th17 分化[33]。梭菌屬Ⅳ簇和ⅩⅣa 簇細菌可提供促進Treg分化的環境,并促進Treg 表達iCOS,分泌IL-10,減輕結腸炎[34]。微生物群衍生代謝物SCFA 中的丁酸鹽刺激CD103+DCs 產生高水平的TGF-β,TGF-β 與DCs(GPR109A)和CD4+T 細胞(GPR43)的GPCRs 結合,促進T 細胞向Treg 分化[35]。IBD 患者腸道組織中色氨酸代謝物受體(aryl hydrocarbon receptor,AHR)表達增加,Th17 向Treg 轉分化一定程度依賴于AHR[36]。腸道膽汁酸及其有效的次級膽汁酸誘導RORγ+Treg對維持腸道免疫穩態至關重要[37]。腸道菌群也是腸道黏膜屏障的重要組成,腸道黏膜屏障具有防止微生物侵入、維護腸道健康的作用,同時為腸道微生物提供營養和棲息地。反過來,腸道微生物群調節黏蛋白產生和分泌影響其功能,如將益生菌菌株鼠李糖乳桿菌CNCM Ⅰ-3690 用于小鼠,可通過增加黏液產生和恢復杯狀細胞群改善結腸屏障功能[38]。腸道菌群失調會增加腸道通透性,影響腸道免疫,最終導致腸道黏膜屏障損傷,引起IBD[39]。
綜上,腸道微生態失調是調控IBD的關鍵因素,腸道菌群失調會改變宿主與微生物相互作用。因此,促進腸道有益細菌、減少有害菌、增加微生物多樣性可有效調節Th17/Treg平衡,促進黏膜屏障完整性,是緩解結腸炎的有效策略。
3 常用的IBD臨床治療藥物
過去幾十年中,人們進行了深入研究闡明IBD發病機制,尋找有效的IBD 治療藥物靶點。常用臨床藥物包括皮質類固醇、氨基水楊酸鹽、免疫抑制劑、黏附分子及整合素拮抗劑、TNF 抑制劑和IL-12/IL-23 抑制劑等,旨在抑制腸道炎癥,修復消化道黏膜組織,從而改善IBD 患者生活質量[40]。但這些治療藥物主要是快速緩解疾病,在療效維持方面效果不佳,且長期使用副作用較大。皮質類固醇(強的松、氫化可的松、布地奈德、地塞米松)主要用于中重度IBD治療,尤其是急性發作期患者,長期使用抑制下丘腦垂體腎上腺軸,導致睡眠和情緒障礙[41]。一些氨基水楊酸藥物,如美沙拉秦、奧沙拉嗪和柳氮磺胺吡啶,主要用于輕度和中度活動期UC 緩解,該類藥物主要不良反應為胰腺炎、腎毒性、肝毒性和性功能障礙等[42]。TNF抑制劑也是最常用治療藥物之一,包括英夫利昔單抗、阿達木單抗和戈利單抗,使用抗TNF-α 藥物治療的患者會增加其他疾病患病風險,如嚴重感染、惡性腫瘤、心力衰竭等疾病[43]。隨著腸道菌群研究深入,口服益生菌及糞便移植等新興治療手段逐步用于臨床,但臨床試驗較少,還需深入研究[44-46]。與西藥相比,植物多酚具有不良反應少、耐受性好、來源廣泛等優點,日漸成為IBD治療藥物的研究熱點。
4 植物多酚調節腸道菌群在IBD中的作用
多酚是植物性食物如水果、蔬菜和谷物中的天然化合物,包括黃酮類、酚酸類、單寧類、木脂素類和芪類。黃酮類進一步分為黃酮醇、黃酮、黃烷-3-醇、異黃酮、黃烷酮、花青素和查耳酮等[47]。研究表明,多酚是一種益生元,可以改善腸道微生物群的多樣性,增加益生菌如乳酸桿菌、雙歧桿菌等,減少有害菌,如侵襲型大腸桿菌、艱難梭狀芽孢桿菌等,進而調控腸道菌的代謝產物,如SCFA、膽汁酸等,也可以通過腸道菌群改變影響T細胞分化以及腸黏膜屏障完整性,從而抑制腸道炎癥,有效預防和緩解IBD[48]。
多酚對腸道菌群的調控作用主要是通過影響細菌代謝和細菌群體感應抑制遺傳物質合成以及干擾細胞膜生物功能等實現。不同微生物新陳代謝不同,梭狀芽孢桿菌等腸道細菌生長需要鐵,而雙歧桿菌和乳酸桿菌生長不需要鐵,多酚通過螯合金屬離子(鐵和鈷)抑制細菌酶活性,從而改變微生物代謝,選擇性增加雙歧桿菌和乳酸桿菌等益生菌生長,促進其在腸道組織定居,并抑制梭狀芽孢桿菌等致病菌增殖[49]。多酚可抑制細菌生物膜形成,是在IBD 患者結腸組織中大量存在的一種共生轉化的病原菌具核梭桿菌。研究發現1.56 μg/ml(6.8 μmol/L)白藜蘆醇可顯著抑制具核梭桿菌生物膜形成,從而抑制其生長繁殖[50]。多酚還可通過產生、釋放和感應被認為是自誘導劑的小信號分子(革蘭陽性菌中的寡肽和革蘭陰性菌中的酰化高絲氨酸內酯)破壞細菌群體感應[51]。多酚也可抑制細菌DNA 和RNA 生物合成,據報道,槲皮素作用于大腸桿菌DNA 促旋酶,黃酮類化合物則抑制金黃色葡萄球菌DNA復制必需的解旋酶,從而抑制細菌DNA等遺傳物質生物合成[48,52]。此外,兒茶素通過產生H2O2、改變微生物細胞膜通透性發揮抗菌作用[53-54]。腸道微生物如產氣莢膜梭菌、糞腸球菌、乳球菌和乳酸桿菌等表達細胞外電子轉移(extracellular electron transfer,EET)相關基因,成為腸道環境中多酚的靶標,多酚通過促進這些細菌的EET 或無氧呼吸促進其生長。此外,多酚還可螯合參與EET 的金屬離子,如鐵和銅,間接影響微生物生長[55]。多酚經微生物群分解產生的代謝物可促進SCFA 合成相關微生物增加,如梭狀芽孢桿菌ⅩⅣa簇細菌及雙歧桿菌等,促進SCFA 合成[56]。研究發現,EGCG 可抑制上消化道中的α-淀粉酶活性,導致淀粉未完全消化,這些未完全消化的底物可供結腸中合成SCFA的微生物使用,從而促進SCFA 合成[57]。綜上,多酚主要通過選擇性影響微生物代謝、生物膜形成及功能、電子轉移等多種途徑調節微生物組成。腸道微生物參與多酚代謝過程,腸道中相對高濃度的多酚可能選擇性地影響細菌生長。這種相互作用導致多酚分解為各種代謝物,調節腸道微生物群,并增加SCFA等合成。
研究發現多酚化合物通過與腸道菌群相互作用在調節T細胞及維持腸黏膜完整性中發揮重要作用。白藜蘆醇通過逆轉TNBS 誘導的腸道菌群失調減少Th17 數量,增加Treg 數量,調節Treg/Th17 平衡,減輕宿主結腸炎。因此,白藜蘆醇補充劑是IBD腸道炎癥的動態調節劑[58]。槲皮素能通過調節腸道巨噬細胞恢復腸道宿主-微生物平衡,抑制T 細胞活化,促進IL-10 表達,顯著降低結腸固有層和腸系膜淋巴結中CD4+T 細胞比例及分泌IFN-γ 和TNF-α的CD4+T細胞比例,最終改善腸炎[59]。此外,槲皮素是AHR 激動劑,通過與AHR 結合抑制炎癥性Th17,促進Treg 增殖[60]。在IBD 中,腸黏膜組織Th17 大量浸潤,Th17 相關細胞因子表達增加,紫肉馬鈴薯含有大量花青素,紫肉馬鈴薯飲食提高小鼠腸道中阿克曼菌相對豐度,并降低結腸中IL-17 mRNA 表達,因此,紫肉馬鈴薯有助于改善UC 癥狀[61]。腸道黏膜層為微生物群提供碳和營養源,促進其共生,黏液層成分改變影響腸道微生物群,微生物刺激又是黏蛋白分泌所必需的。多酚-微生物群相互作用產生的多酚分解代謝物和SCFAs 保護腸道黏膜層完整,減輕腸炎。研究發現,白藜蘆醇上調claudin-4蛋白表達,降低細胞通透性,阻止大腸桿菌易位[62]。芒果增加了腸道乳桿菌屬豐度,促進SCFAs 產生,尤其是丁酸,從而增強黏膜屏障功能[63]。SCFA 通過結合其受體GPR41 和GPR43 提高細胞Ca2+水平,并進一步激活Erk1/2 和Akt 信號,改善上皮屏障功能[64]。已明確報道能夠調節腸道菌群緩解腸炎的常見多酚化合物及其作用機制見圖1。
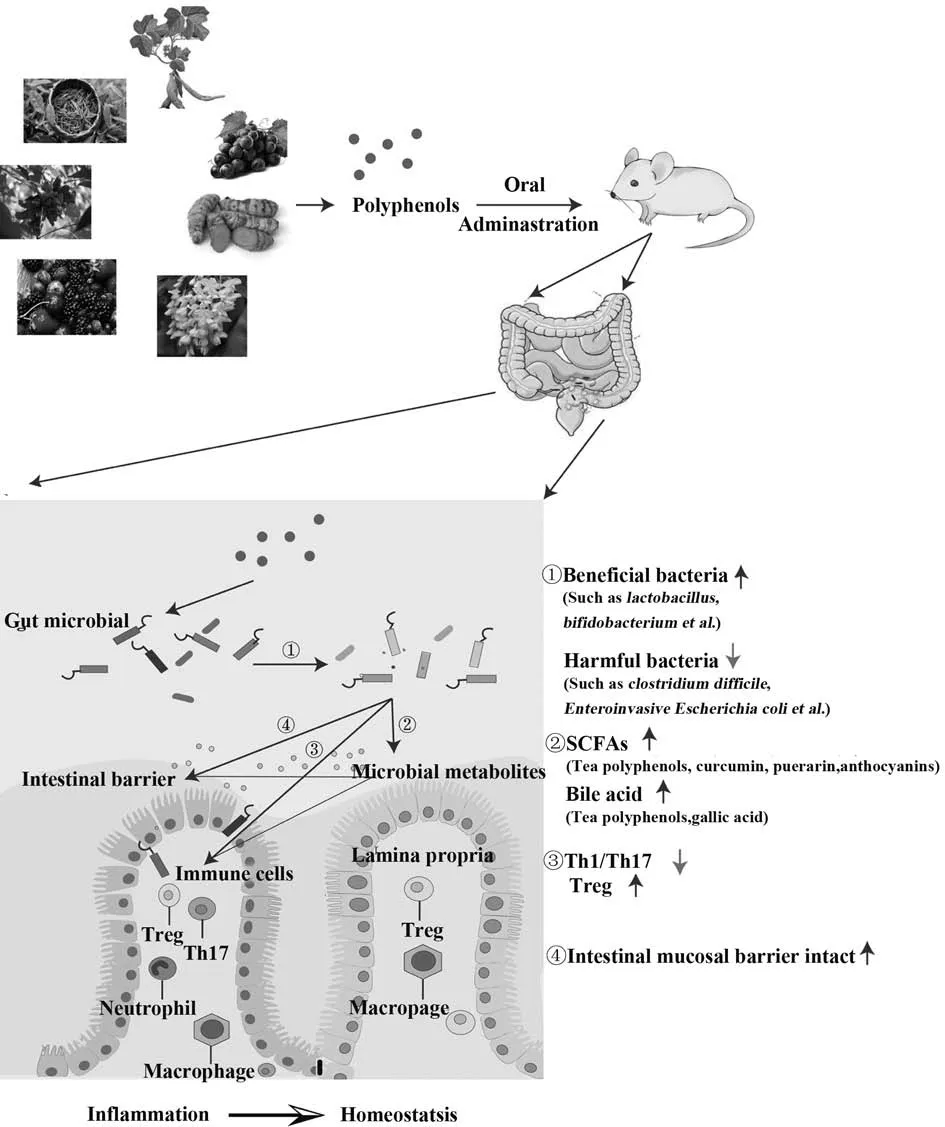
圖1 植物多酚通過調節腸道菌群緩解腸道炎癥的機制Fig.1 Mechanism of plant polyphenols alleviating intestinal inflammation by regulating gut microbiota
4.1 茶多酚(green tea polyphenols,GTPs)GTPs是存在于食品和藥用植物中的天然多酚化合物,是綠茶發揮作用的主要活性成分。GTPs 主要包括類黃酮(兒茶素)、單寧、茶黃素和酚酸。越來越多的研究表明,攝入富含GTPs的食物可預防和治療人類慢性疾病,如IBD。GTPs 通過與腸道菌群相互作用促進有益菌雙歧桿菌生長,促進SCFA 合成,抑制有害的梭狀芽孢桿菌生長,從而維持腸道健康[65-66]。GTPs 也可增加腸道中產生次級膽汁酸的微生物豐度,如擬桿菌屬和雙歧桿菌,促進次級膽汁酸產生,調節免疫細胞,抑制腸道炎癥[67]。IBD 患者腸黏膜中擬桿菌門和厚壁菌門數量顯著減少,而變形桿菌門和放線菌門數量顯著增加,飲食中加入GTPs可顯著改善IBD 模型小鼠結腸炎癥[68]。兒茶素是GTPs的主要成分,也具有調節腸道菌群、善腸道微環境、緩解IBD的作用[69]。研究表明表沒食子兒茶素沒食子酸酯(epigallocatechin gallate,EGCG)可通過與組蛋白樣DNA 結合蛋白結合有效抑制幽門螺桿菌生長[70]。初步臨床研究發現,健康受試者使用GTPs后,糞便中梭狀芽孢桿菌等細菌減少,雙歧桿菌和乳酸桿菌增加[71]。UC 患者口服EGCG 可緩解對5-氨基水楊酸和硫唑嘌呤的耐藥性,且副作用小,有望成為治療輕度至中度活動性UC 患者的新選擇[72]。此外,與常用臨床藥物柳氮磺吡啶相比,EGCG 顯著提高抗氧化水平并緩解結腸炎癥狀,且EGCG 是IBD 和健康個體淋巴細胞中氧化應激的拮抗劑[73]。GTPs 是否通過調節腸道菌群緩解IBD 尚缺乏臨床證據。
4.2 白藜蘆醇 白藜蘆醇(3,5,4′,三羥基反式芪)是一種天然多酚(芪類),主要存在于虎杖、決明子、桑樹等常見藥用植物以及葡萄、花生和石榴等食物中,具有廣譜藥理活性,如抗炎、抗癌和抗氧化等,可用于治療多種疾病,包括糖尿病、組織損傷、炎癥性疾病和癌癥[74-76]。研究表明白藜蘆醇顯著促進乳酸乳球菌生長,并抑制糞腸球菌生長,從而正向調節宿主免疫,降低炎癥反應[27]。白藜蘆醇處理葡聚糖硫酸鈉(dextran sulphate sodium,DSS)誘導的大鼠,可增加大鼠腸道中雙歧桿菌和乳酸桿菌豐度,抑制大腸桿菌增長,并減少一氧化氮合酶表達,使DSS 損傷的腸黏膜屏障得以修復[73]。同樣,補充白藜蘆醇可增加DSS誘導的結腸炎小鼠糞便中的有益菌乳酸桿菌和雙歧桿菌,并減少包括嗜膽菌屬在內的潛在致病菌[77]。白藜蘆醇通過調節腸道菌群與機體免疫系統相互作用誘導Treg 產生,抑制Th1/Th17 產生,保護宿主免受結腸炎影響[78]。白藜蘆醇通過促進有益菌阿克曼氏菌增殖及代謝產物丁酸產生,顯著緩解TNBS 誘導的結腸炎[58]。研究發現,與對照小鼠相比,結腸炎小鼠長期攝入白藜蘆醇后,腸道中厚壁菌門/擬桿菌門比例和乳桿菌屬豐度顯著升高,腸道微生物群組成在控制白藜蘆醇代謝中起重要作用,此外,厚壁菌門/擬桿菌門比例顯著升高,進一步促進二氫白藜蘆醇代謝[79]。臨床研究發現,飲用富含白藜蘆醇的紅酒后,代謝綜合征(肥胖)受試者糞便微生物增加,尤其是有益菌乳酸桿菌和雙歧桿菌顯著增加,而炎癥標志物水平顯著降低[80]。白藜蘆醇與腫瘤治療常用化療藥物一起服用顯著降低常規化療藥物引起的不良反應及耐藥性[81]。一項隨機雙盲臨床試驗表明,50 例活動性輕度至中度UC 患者連續6 周每天補充500 mg 白藜蘆醇,可顯著降低血漿TNF-α 水平,臨床結腸炎活動指數得分顯著下降,表明白藜蘆醇可部分通過調節炎癥因子表達有效緩解UC[82]。另有臨床試驗發現,白藜蘆醇可提高輕度至中度UC 患者抗氧化能力并降低氧化應激,改善UC 患者疾病活動性和生活質量[83]。白藜蘆醇可通過調節腸道微生物群改變抗氧化、抗炎和免疫應答,顯著改善腸道功能,降低結腸炎及結直腸癌風險和發病率。
4.3 姜黃素 姜黃素最早是從植物姜黃中分離到的多酚(黃酮類),廣泛分布于藥用植物姜黃、莪術和菖蒲的根莖中,是一種強抗氧化劑、抗炎劑、抗菌劑和抗病毒劑,常用于常見疾病治療,尤其用于治療膽道疾病、風濕病、糖尿病、腸炎、關節炎等[84-85]。姜黃素具有調節腸道菌群、改變腸道微生物豐富度和多樣性作用,通過維持產生SCFAs 的細菌數量和比例促進SCFAs 合成,保護腸黏膜,抑制腸道炎癥[86]。通過給予結腸炎小鼠模型姜黃素納米顆粒,顯著增加產生丁酸鹽的微生物群,從而誘導Tregs及免疫耐受性T細胞生成,改善腸道屏障功能,減少腸道炎癥[87]。利用IL-10 缺陷小鼠構建結腸炎模型,發現姜黃素處理可防止年齡相關的細菌α多樣性降低,增加細菌豐富度,并防止結直腸癌發展[88]。此外,姜黃素有助于調節一些特定的腸炎高度相關細菌豐度,如阿克曼氏菌、糞腸球菌、羅氏菌屬及F16、腸球菌科等;通過增加緊密連接蛋白如occludin、ZO-1、claudin-3 表達增強腸道屏障;通過抑制caspase-3 通路減輕DSS 誘導的腸道細胞凋亡;通過抑制MAPK/NF-κB/STAT3 通路減輕腸道炎癥[89]。目前姜黃素對人腸道微生物群的影響尚缺乏研究。常規臨床藥物治療患者易復發,一項針對姜黃素預防復發的隨機、雙盲臨床試驗也顯示,接受姜黃素和常規治療藥物治療的43 例患者中,2 例在治療6 個月內復發(4.65%),而安慰劑組39 例患者中有8 例(20.51%)復發,表明服用姜黃素的患者復發率顯著降低[90]。
4.4 槲皮素 槲皮素是一種常用的具有多種生物學活性的天然多酚(黃酮類),通常以糖基形式存在,分布廣泛,100 多種藥用植物(如槐米、側柏葉、高良姜、款冬花、桑寄生、三七、銀杏、接骨木等)均含有此成分。COMALADA 等[91]在實驗大鼠中觀察到槲皮素對DSS 誘導的結腸炎具有保護作用,腸道微生物群分解糖苷類時釋放槲皮素,槲皮素通過抑制NF-κB 信號通路抑制細胞因子產生并誘導一氧化氮合酶表達,減輕DSS 誘導的結腸炎。槲皮素還可調節腸道菌群,增加有益菌如雙歧桿菌和乳酸桿菌數量,顯著降低艱難梭狀芽孢桿菌和腸球菌數量。槲皮素處理DSS 誘導的結腸炎模型小鼠,發現小鼠體質量明顯增加,氧化應激明顯減弱,厚壁菌門細菌數量增加,變形菌門細菌數量減少,表明槲皮素可通過調節氧化應激改善腸道菌群緩解小鼠UC[92]。幼稚T 細胞過繼轉移到Rag1 缺陷小鼠并誘導T 細胞依賴性結腸炎,該小鼠補充槲皮素后擬桿菌門/厚壁菌門比例升高,潛在致病微生物分段絲狀細菌和大腸桿菌相對豐度降低[59]。研究發現槲皮素對檸檬酸桿菌誘導的結腸炎小鼠也具有很好的緩解作用,槲皮素增加擬桿菌屬、雙歧桿菌屬和乳桿菌屬數量,并顯著減少梭桿菌屬和腸球菌屬數量,抑制促炎細胞因子如IL-17、TNF-α 和IL-6 產生,促進結腸組織中抗炎細胞因子IL-10 產生[93]。槲皮素針對各種代謝綜合征(如糖尿病、肥胖和某些類型癌癥)進行了大量臨床試驗,但在IBD臨床研究中尚未見報道。
4.5 葛根素 葛根素是從傳統中藥材葛根中分離的異黃酮類衍生物,具有抗炎、抗氧化、抗腫瘤等多種藥理學活性,廣泛用于心血管疾病、糖尿病和癌癥等多種疾病治療[94-97]。近年越來越多的研究發現葛根素具有調節腸道菌群作用。葛根素顯著抑制毛螺菌科和脫硫弧菌科的相對豐度,進而調節腸道菌群釋放的SCFAs 和修復腸黏膜完整性,改善腸道菌群失衡,從而改善大鼠骨質疏松癥[98]。腸道菌群與腸炎發生密切相關,葛根素處理TNBS 誘導的結腸炎模型,改變了共生微生物群結構,降低擬桿菌相對豐度,提高阿克曼氏菌比例,顯著增加吲哚-3-丙酸含量,增強杯狀細胞增殖及黏液分泌改善腸道屏障功能[99]。相似研究也發現,梭狀芽孢桿菌屬中瘤胃球菌1 和瘤胃球菌UCG-009 在UC 大鼠中豐度較高,隨著葛根素攝入,兩個屬均恢復正常水平;UC大鼠補充葛根素改變了利用黏蛋白的細菌組成,增加SCFAs 產生,從而影響黏膜層滲透性及修復,緩解腸炎[100]。葛根素通過調節腸道菌群及其代謝產物SCFA 促進腸道黏膜屏障修復,但缺乏臨床應用研究。
4.6 花青素 花青素是存在于水果和蔬菜中的天然水溶性多酚,因其具有抑制氧化應激作用而廣泛用于預防氧化應激相關疾病,如心血管、神經退行性和炎癥性疾病。研究表明,花青素也具有調節腸道微生物群作用,可促進有益菌如乳酸桿菌和雙歧桿菌生長[101]。花青素還可與淀粉、SCFA 相互作用間接調節腸道微生物群。而腸道微生物群又可分解花青素產生SCFA 和酚酸,刺激益生菌增殖,增加腸道益生菌數量[102]。另有研究發現花青素能夠通過抑制消化酶如α-淀粉酶影響淀粉消化。難消化的淀粉進入大腸,可作為乳酸桿菌、雙歧桿菌等多種益生菌能量來源,對人體健康有益[103]。臨床研究也發現富含花青素的紅葡萄酒和脫醇紅葡萄酒可增加雙歧桿菌等有益菌[104]。雖然花青素在IBD 中的作用已較明確,但分子機制尚不清楚。目前IBD常用治療藥物存在療效不佳或出現不良反應問題,花青素通過減弱氧化應激和抑制細胞炎癥信號通路顯示出有效的保護和治療功能。輕度至中度UC患者以160 g/d 劑量服用富含花青素的越橘(含840 mg花青素/d),持續6周,發現攝入越橘1周后臨床疾病活動指數顯著下降,6 周后,UC 患者結腸活檢標本中IFN-γ 和IFN-γ R2 表達降低,約50%患者觀察到抗炎細胞因子IL-10 升高[105]。KAMALI 等[106]研究了使用富含花青素的石榴皮作為UC 常規藥物治療的補充療法,一項隨機雙盲人體試驗中,29 例患者每天接受6 g 果皮提取物,持續4 周,安慰劑組33 例患者接受糖漿,與安慰劑組相比,接受果皮提取物的患者結腸炎活動指數(大便失禁、一般健康狀況等)得到改善。花青素在臨床前研究中顯示出有益效果,可緩解IBD,并降低IBD 患者治療費用。此外,富含花青素的膳食補充劑與現有藥物組合可為IBD患者提供新的治療選擇。
4.7 沒食子酸(gallic acid,GA)GA 又稱棓酸,是一種天然植物中提取的酚酸類物質,主要存在于五倍子、山茱萸、牡丹、皮掌葉大黃等中藥中,具有多種藥理學作用,在抗腫瘤及抗炎等方面具有良好效果,對多種人類疾病包括UC 亦具有很好的緩解作用[107-109]。但GA在UC中的作用機制尤其是GA對腸道菌群的調控作用知之甚少。研究發現,GA 可調節DSS誘導的UC大鼠腸道微生物組成,促進益生菌如乳桿菌科和普雷沃氏菌科細菌增加,并減少以厚壁菌門和變形桿菌門為主的病原菌產生。糞便代謝物是宿主和微生物群相互作用的副產物,體內代謝物變化可作為微生物群改變的證據。因此,研究者進一步通過代謝組學分析揭示了GA 誘導的代謝物變化主要表現為增加碳水化合物代謝和膽汁酸代謝及降低氨基酸代謝[110]。該研究從腸道菌群角度提出了GA 緩解UC 的新機制。仍缺乏GA 及其衍生物對人類腸道菌群調控的研究,且GA 在人類胃腸道健康和疾病中的有效性臨床證據非常有限,潛在作用機制仍不清楚。結合宏基因組學及代謝組學分析人類糞便、尿液和血液中的代謝物水平可深入了解GA對人類IBD的影響。
5 展望
隨著世界范圍內IBD 發病率上升以及現有IBD臨床治療藥物的副作用和局限性,急需新的有效治療方法。多酚類化合物具有抗炎、抗腫瘤、抗氧化、調節機體免疫力等重要功能,與傳統治療藥物相比,多酚化合物在治療IBD 方面更安全,副作用更小,有望成為治療腸炎的有效藥物,因此,大量研究集中于多酚化合物對腸炎發生發展的影響。腸道菌群是人類健康的關鍵調節劑,可精細調節腸道微生態平衡,影響宿主代謝功能維持、免疫系統發育以及對腸道病原體入侵的抵抗力。腸道微生態失調與IBD發生發展密切相關。現有證據表明多酚化合物通過與腸道菌群相互作用調節腸道微生態。一方面,多酚化合物調節腸道代謝產物影響細菌生長及腸道菌群豐度。另一方面,腸道微生物可分解多酚產生代謝產物,進而調節微生物群落。雖然人類和動物研究表明多酚化合物可選擇性增強特定的腸道微生物,但這些調節作用的機制尚不清楚。未來需要通過代謝組學、轉錄組學和蛋白質組學方法進行微生物功能分析,進一步描述多酚-腸道微生物群的相互作用。此外,多酚化合物對腸炎緩解作用的研究多在動物模型上開展,臨床試驗較少,后期還需進一步評估多酚化合物的臨床療效以及患者使用的最佳劑量。雖然多酚化合物在治療IBD方面有很大潛力,但多酚類化合物穩定性差,溶解度低,生物利用度低,還需深入研究其安全性、劑量以及吸收利用率等,提高多酚類化合物生物利用度,充分發揮多酚化合物治療腸炎的優勢和特色,開發新的IBD防治途徑。