副黏病毒糖蛋白的結構與功能研究進展
劉志斌,孫 淼,陳延飛,陳 建,李 嶺,呼延洋楠,薛青紅*,孟 賡*
(1.中國獸醫藥品監察所,北京 100081;2.中國農業大學動物醫學院,北京 100193)
副黏病毒科(Paramyxoviridae)隸屬負鏈RNA病毒目(Mononegavirale),包含副黏病毒亞科(Paramyxovirinae)和肺病毒亞科(Pneumovirinae)兩個亞科。其中大量的人畜共患病毒屬于副黏病毒亞科,共含有7個屬,包括呼吸道病毒屬、腮腺炎病毒屬、禽腮腺炎病毒屬、麻疹病毒屬、水生類副黏病毒屬、費爾拉副黏病毒屬和亨尼帕副黏病毒屬,見圖1[1]。其中具有代表性的感染動物和人的副黏病毒有:副流感病毒(Parainfluenza virus,PIV);麻疹病毒(Measles virus,MeV);腮腺炎病毒(Mumps virus,MuV);新城疫病毒(Newcastle disease virus,NDV);小反芻獸疫病毒(Peste des Petits Ruminants Virus,PPRV);犬瘟熱病毒(Canine distemper virus, CDV)以及近年來發現的對人類健康造成巨大危害的亨德拉病毒(Hendra virus,HeV)和尼帕病毒(Nipah virus,NiV)。副黏病毒顆粒具有囊膜,呈多形性,常見圓形和橢圓形,其基因組為單股負鏈RNA,大小約為15~19 kb[2]。病毒基因組共編碼六種主要功能性蛋白,分別是核衣殼蛋白(nucleocapsid protein,N);基質蛋白(matrix protein,M);附著蛋白(hemagglutinin-neuraminidase/hemagglutinin/glyco ̄protein,HN/H/G);融合蛋白(fusion protein,F);磷酸化蛋白(phosphoprotein,P)和聚合酶(large protein,L)。N、M、HN/H/G、F、P和L蛋白作為病毒顆粒的主要組成成分,為病毒結構蛋白(圖2)[3]。其中有兩種糖蛋白,分別是介導病毒與宿主表面受體結合的HN/H/G蛋白和介導病毒包膜與宿主細胞膜融合的F蛋白,這兩種纖突狀蛋白在病毒粒子囊膜上在受基質蛋白(M)束縛的情況下呈網格狀排列,與病毒顆粒成熟和膜融合過程相關[4],如圖3所示[5]。兩種糖蛋白的構象變化及其之間的相互作用是決定這些病毒宿主范圍、毒力和傳播的關鍵,也是中和抗體篩選的重要理論基礎,因此闡述這兩種糖蛋白的結構和功能對于研究副黏病毒入侵機制和疾病的預防具有十分重要的意義。本文通過對幾種代表性副黏病毒糖蛋白結構功能以及它們之間相互作用進行了綜述,以期為治療性抗體和疫苗的合理開發提供理論基礎。
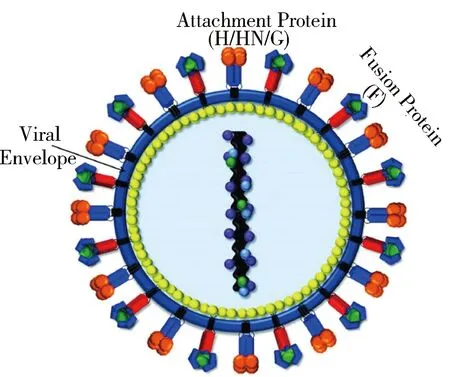
Matrix Protein(yellow)Nucleocapsid(purple)Phosphoprotein(blue)Large Polymerase(green)RNA Genome(black)
1 HN/H/G蛋白的結構及功能
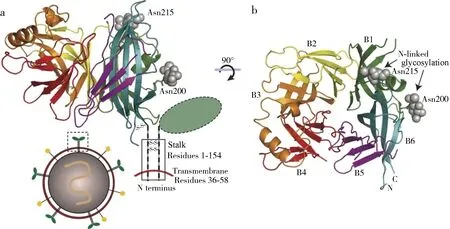
1.1 HN/H/G蛋白的結構 HN/H/G蛋白是副黏病毒進入細胞的關鍵作用蛋白,能夠識別并結合宿主受體。HN/H/G蛋白在不同副黏病毒中的形式不盡相同,功能也有略微差異。其中最常見的形式是血凝素-神經氨酸酶(hemagglutinin-neuraminidase,HN),即同時具有血凝素活性和神經氨酸酶活性。呼吸道病毒屬、腮腺炎病毒屬以及禽腮腺炎病毒屬的附著蛋白常以HN類型存在[6-8];以H(hemagglutinin)類型存在的附著蛋白只有血凝素活性,如麻疹病毒屬[9-10];近年來,HeV和NiV給人類健康造成巨大危害,其附著蛋白缺乏血凝素及神經氨酸酶活性,因此使用糖蛋白(glycoprotein,G)來直接表示[11]。雖然HN/H/G蛋白以不同類型存在,但都是一種Ⅱ型跨膜糖蛋白。其在序列上的功能結構組成分為四部分(圖4),即N末端的胞質尾區(Cytoplasmic tail domain,CT)、N端單跨膜區域(Transmembrane region,TM)、莖部結構域(Stalk domain)和較大的C端球狀頭部結構域(Head domain)。N端的CT、TM以及莖部結構域主要由α-螺旋組成,C端的頭部結構域主要由β-折疊片組成[12]。

圖4 副黏病毒HN/H/G蛋白結構示意圖
對重組表達的HN/H/G蛋白晶體結構及冷凍電鏡結構的解析有利于研究蛋白生化性質及其生物活性。多個副黏病毒家族的HN/H/G蛋白結構已經被解析(表1)[13-32]。下面以MeV、NiV、HeV和NDV為例,闡述HN/H/G蛋白的結構特點。
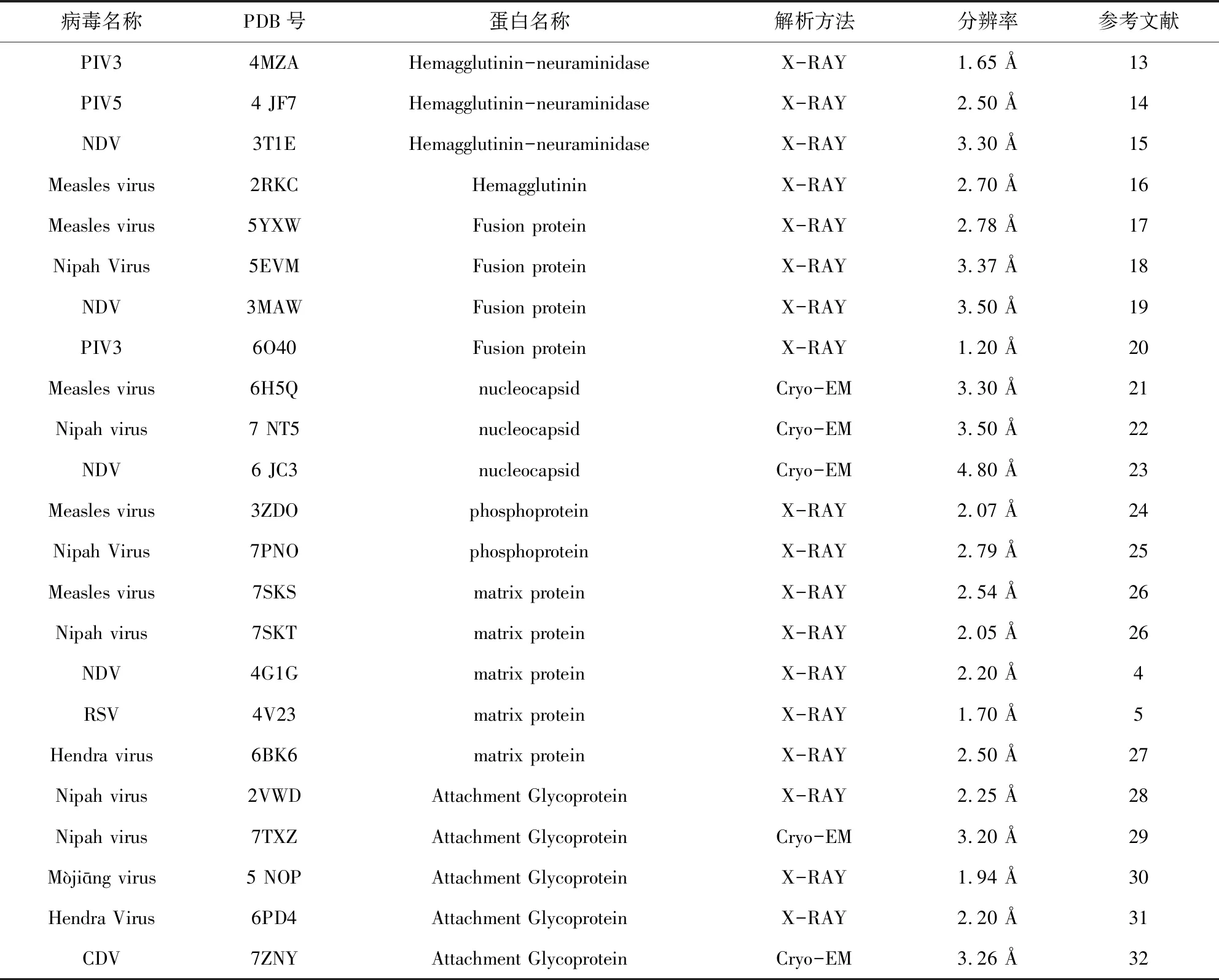
表1 已解析結構的副黏病毒蛋白列表(部分)
MeV的附著蛋白有血凝素活性但沒有神經氨酸酶活性,因此以H類型存在,由34個殘基的細胞質尾,24個殘基的跨膜區,95個殘基的莖部以及頭部組成。其頭部的晶體結構最早在2006年由Garcia課題組解析(圖5)[16],隨后MeV頭部與受體SLAM、CD46及Nectin-4的復合物晶體結構被陸續解析。晶體結構顯示MeV的H蛋白頭部由六個β-片層組成的螺旋槳結構,是參與細胞表面蛋白受體識別的主要區域,其整體的結構呈立方體型,頭部結構域在晶體不對稱單位內以傾斜的形式以二硫鍵連接形成同源二聚體,相鄰兩個不對稱單位的二聚體進而形成不同形式的同源四聚體,但具體在病毒表面究竟以何種形式存在依然未知[33]。MeV-H蛋白和受體復合物晶體結構顯示,其頭部螺旋槳結構中的6個β-折疊片層(圖5),其中β-片層4、5和6主要參與結合了不同的細胞受體,且受體結合面有重合[34]。NiV以及HeV的附著蛋白缺少血凝素和神經氨酸酶活性,以G來表示。2022年通過對NiV病毒胞外區及抗體復合物的結構的冷凍電鏡結構解析,顯示NiV的G蛋白含有N端四聚體螺旋束(Four-Helix Bundle,4HB)的莖部結構(96-147aa),頸部結構域(148-165aa),連接區(166-177aa)和C端頭部結構域(178-602aa)。其莖部與頸部通過形成二硫鍵來保持NiV-G四聚體的穩定,C端頭部形成一個6個β-折疊片組成的螺旋槳型結構,與MeV的頭部結構類似。但不同的是,NiV-G整體結構采用了雙頭向上和雙頭向下構象,這跟NDV-HN蛋白和MeV-H蛋白的四頭向下構象有所不同(圖6)[30]。同樣由于NiV-G的結構是使用抗體鎖定構象的重組蛋白結構,因此其在病毒表面的原位結構依然有待于進一步研究。NDV是典型的動物副黏病毒,其附著蛋白同時具有血凝素活性和神經氨酸酶活性,是經典的HN蛋白。研究學者通過晶體結構電子密度圖觀測到NDV-HN蛋白的莖部區域為一個4HB,包含一個十一肽疏水重復區域[35],其氨基酸殘基83-114位點構成了莖部的疏水性核心,同一區域與PIV5-HN類似。這表明,NDV-HN莖部區域的構象在某些副黏病毒中可能是一種保守的共性結構。NDV-HN球形頭部的晶體結構顯示其以二聚體-二聚體形式排列,在未結合受體前呈現四頭向下構象,其中頭部區域包含受體結合區域和NA活性區域,在其頂部含有唾液酸結合受體,頭部區域末端含有45個氨基酸的延伸[15]。由于晶體結構的多聚狀態可能由于晶體內堆積導致的假象,因此其在病毒顆粒表面是否以晶體結構的四聚體形式存在依然未知。通過總結分析不同副黏病毒HN/H/G蛋白的結構,我們認為副黏病毒HN/H/G蛋白具有以下共性,HN/H/G蛋白的C端頭部區域均含有受體結合位點并且以β-螺旋折疊為特征的多聚體的形式存在;莖部結構域均為四聚體螺旋束結構且含有疏水特性,推測可能是一種保守的共性結構;N端的CT、TM以及莖部結構域多為α-螺旋結構組成,這可能是行使HN/H/G蛋白正常功能的某種必須結構。
A、b:MeV H蛋白的兩個結構示意圖以及麻疹病毒顆粒示意圖
1.2 HN/H/G蛋白的功能 在病毒入侵宿主的初始階段,HN/H/G蛋白通過與宿主受體的識別與結合來介導病毒與細胞的融合。但副黏病毒種類不同,結合的細胞表面受體也有所差異,例如NDV-HN蛋白結合唾液酸受體;MeV-H蛋白與受體淋巴細胞活化分子(SLAM)、補體調節蛋白(CD46)和黏附連接蛋白(Nectin-4)結合;PPRV-H蛋白與受體SLAM和Nectin-4結合,不與CD46結合;而NiV-G蛋白以跨膜蛋白酪氨酸激酶Ephrin B2及Ephrin B3(EB2,EB3)作為受體[36]。不同種類的副黏病毒結合受體的位置也有所不同,復合物晶體結構顯示,MeV-H在頭部區域的側面與受體結合;而對NDV-HN和NiV-G的生化研究數據顯示,其在頭部區域的頂端結合受體[9,11,37]。目前的研究猜測,HN/H/G蛋白與受體結合后引起蛋白構象的改變,從而暴露了在莖部的F蛋白激活位點,進而觸發了F蛋白發生自身的一系列構象變化。有學者通過將NDV-HN蛋白的莖部與NiV-G的頭部區域嵌合,發現HN蛋白只在與HN蛋白莖段同源的F蛋白表達時才會導致融合,企圖證明是HN蛋白的莖部而不是頭部負責與F蛋白的相互作用[38]。有研究者對NiV-G蛋白莖部結構域引入N聯糖基化位點突變,發現突變體不影響與受體結合,也不影響G蛋白與F蛋白之間的相互作用,但卻顯著降低了病毒與細胞膜的融合[39],因而推測NiV的G與F蛋白相互作用并不完全被莖部結構介導[40]。后來Jacquelyn等[41]通過生化方法研究認為NiV-G和F之間存在雙齒相互作用,其中NiV-G的莖部和頭部區域都與F相互作用。但最近幾年對于副黏病毒HN/H/G蛋白的結構研究發現,不同副黏病毒的HN/H/G蛋白頭部區域四聚體采取了完全不同的多聚構象(圖7)[35],所以許多體外蛋白質生化數據還沒有很好的和結構數據吻合。而2023年通過CryoET對PIV3全病毒顆粒的結構解析得到了9?的HN和F原位電子密度圖,其結構顯示PIV3的HN蛋白在病毒表面是通過二聚體與F相互作用的(圖7),且通過HN頭部區域的一個環狀區(loop structure)參與F相互作用(圖8)[42]。但是由于CryoET的分辨率比較低,且計算結果容易出錯,因此在缺乏進一步的高分辨率結構信息前,其結論還有待驗證。
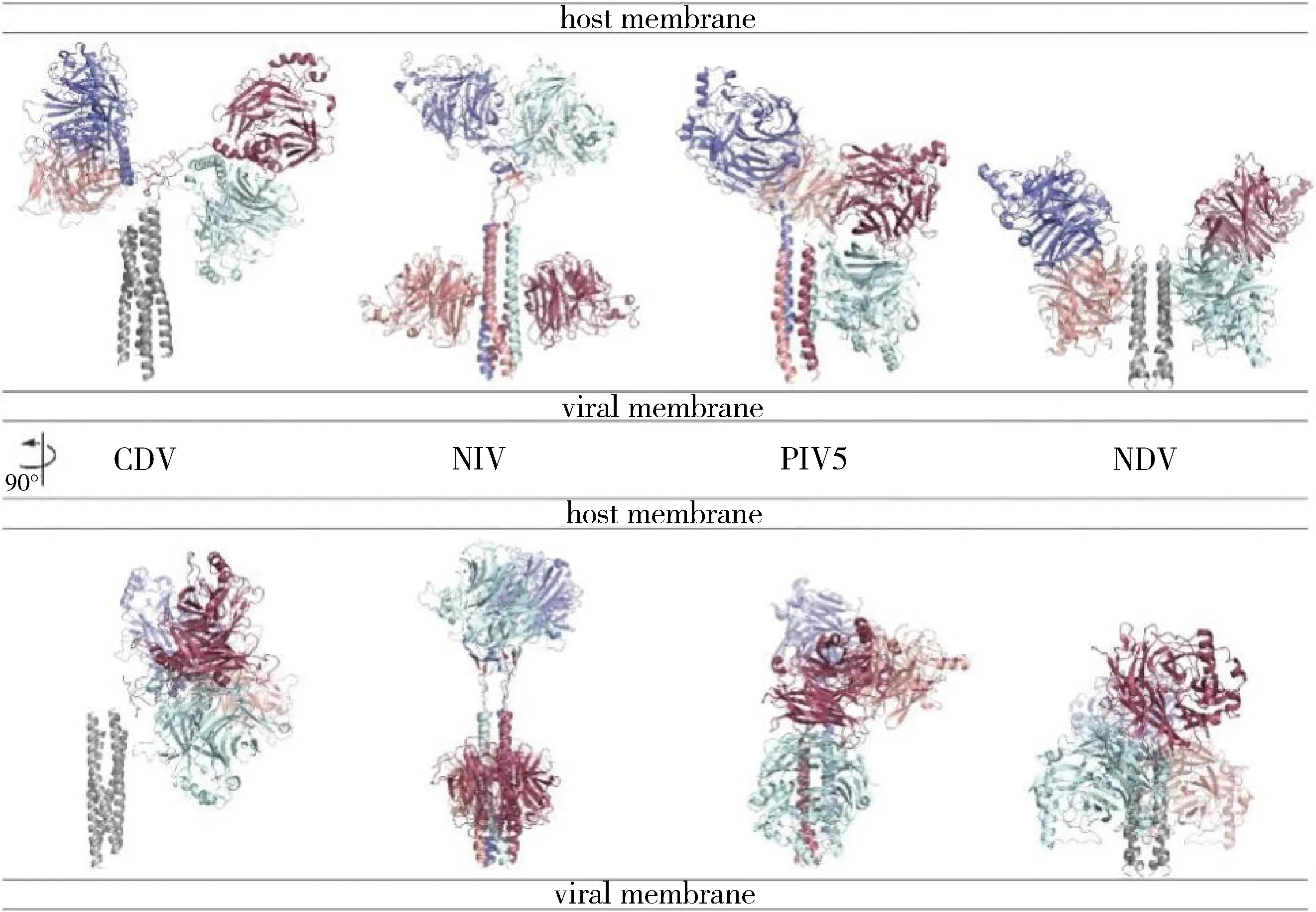
圖7 不同副黏病毒(CDV、NiV、PIV5、NDV)HN/H/G蛋白四聚體結構比較
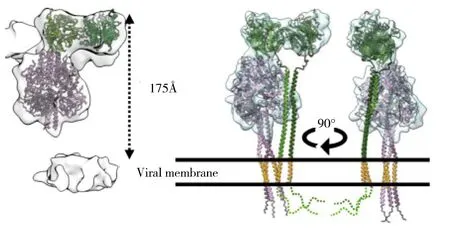
圖8 副黏病毒(副流感病毒3)HN蛋白與F蛋白的相互作用
通過總結分析不同副黏病毒HN/H/G蛋白的研究結果,我們認為副黏病毒的HN/H/G蛋白至少具有三個確鑿的功能:(1)特異性的識別并結合宿主細胞表面受體,促進病毒與宿主細胞結合;(2)與宿主細胞表面受體結合后,HN/H/G蛋白自身構象發生改變,從而暴露F蛋白激活位點,啟動病毒與細胞融合過程;(3)具有神經氨酸酶活性的病毒HN蛋白,催化末端唾液酸糖苷鍵的水解,促進子代病毒顆粒從細胞膜上釋放[14]。另外,基于Battisti和Meng在NDV-M蛋白組裝的研究結果推測[5],由于F蛋白三聚體和M蛋白二聚體網格之間存在著對稱性不匹配,因此附著蛋白通過與F蛋白相互作用,進一步行使介導了F蛋白組裝進病毒顆粒的功能。由于NDV-M蛋白的組裝模型已在NiV和MeV中都得到了驗證,因此這種M-HN-F的組裝模式可能在副黏病毒中是一種保守且通用的模型(圖3)。
2 F蛋白的結構及功能
2.1 F蛋白的結構 F蛋白低聚物是典型的Ⅰ型病毒融合蛋白,由兩個亞基(F1,F2)以二硫鍵結合組成的同源三聚體形式(圖9)。與其他Ⅰ型病毒融合蛋白一樣,副黏病毒的F蛋白包含疏水性融合肽(Fusion Peptide,FP),兩個7肽重復區(Heptad repeat regions A and B,HRA和HRB),一個跨膜結構域(Transmembrane domain,TM)以及C末端的胞質尾區(Cytoplasmic Tail,CT)。F蛋白在合成前以無活性的F0前體形式存在,必須形成二硫鍵連接的F1,F2形式時才具備融合活性。當融合肽被激活后,F蛋白的七肽重復區重新排列,構象發生不可逆的變化,形成穩定的六螺旋束結構(Six-helix bundle,6HB)[3]。具體構象重排步驟如下:(1)緊湊的莖部結構域HRB解螺旋;(2)HRA段的單體折疊成卷曲的螺旋狀,從而允許FP發生遷移并插入到目標段,形成中間過渡體;(3)HRB肽擺動頭部域,形成新的6-螺旋核心結構,最終成為融合后狀態。F蛋白的酶切激活過程是病毒感染致病的關鍵步驟。F蛋白被酶切后,會產生一個新的蛋白質的N末端,FP會處于正確的有利于膜融合的位置。大多數的副黏病毒F蛋白酶切過程發生在病毒向高爾基體的運輸中,是由一類枯草桿菌樣細胞內蛋白酶進行酶切的,如弗林(Furin)蛋白[6]。但并不是所有副黏病毒的F蛋白都是被Furin蛋白酶切激活的,如HeV和NiV的F蛋白是被蛋白酶L酶切激活[43-44];HPIV5的F蛋白是被細胞外源性蛋白酶切割激活,如小纖溶酶(Mini-plasmin)[45]。
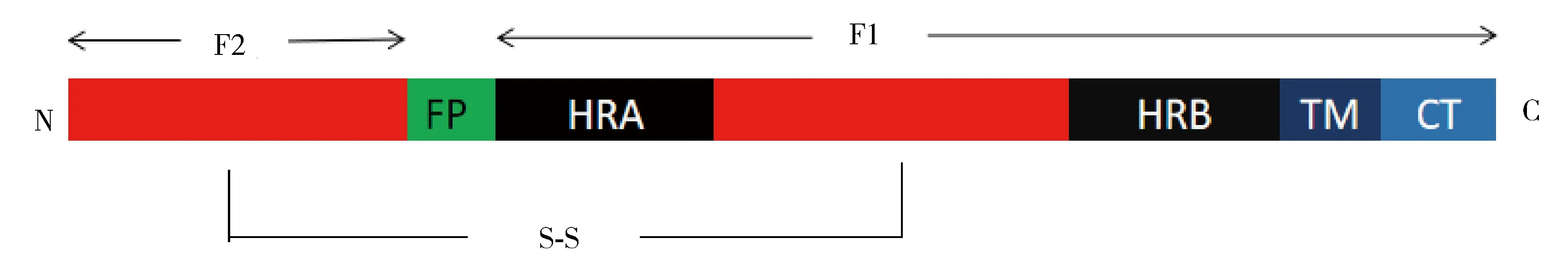
圖9 副黏病毒F蛋白結構示意圖
近年來,F蛋白融合前及融合后狀態的晶體結構也逐步被解析,如PIV5、HeV、MeV和NDV等。副黏病毒F蛋白融合前狀態的晶體結構都呈現為樹狀結構,主要是莖部的HRB區域組成的三螺旋束支撐一個大的球狀頭部區域。頭部區域分成三個部分即DⅠ、DⅡ、DⅢ。DⅠ和DⅡ是形成頭部結構域的基礎,DⅢ部分是由位于頂部的HRA段組成。F蛋白融合前與融合后結構差異主要在DⅢ[46],如圖10所示。
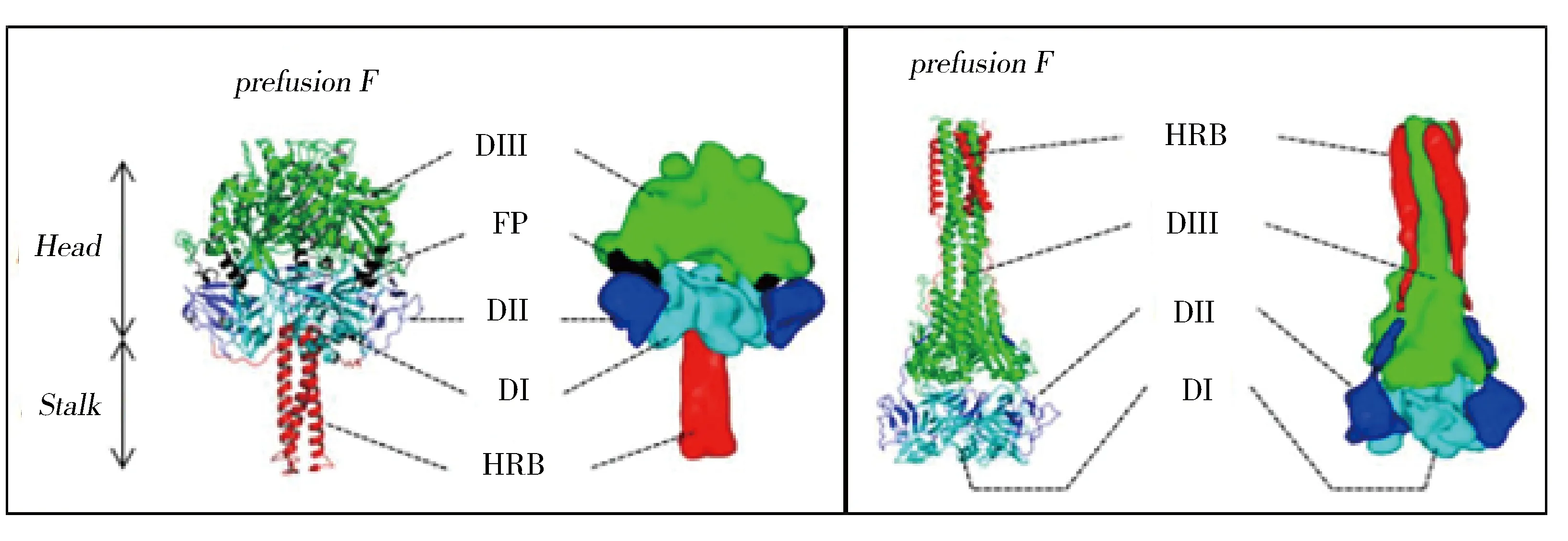
圖10 副黏病毒F蛋白分子結構
雖然已解析的副黏病毒F蛋白胞外域結構都很相似,但其受體依賴的融合觸發機制是否相似還具有爭議,其激活過程也存在一定的差異。以HeV和PIV5為例,其F蛋白的胞外域結構非常相似,但二者在融合肽區域具有較大差異。HeV-F在109裂解位點的環狀結構更長且更窄,這可能是由于HeV-F的特異性激活酶是組織蛋白酶L,而PIV5-F是由弗林蛋白酶激活,進而導致F蛋白結構上的差異[47]。
副黏病毒的F蛋白大多數在預融合狀態都不穩定。MeV-F蛋白的結構顯示其第六葉片的螺旋結構排列不緊密可能是造成其F蛋白預融合不穩定的原因之一。因此在MeV-F的結構研究中,研究者在MeV-F的莖部區域引入二硫鍵以穩定重組表達的MeV-F蛋白的預融合狀態,并且發現在HRB的C末端引入4個半胱氨酸是最合適的[17]。而這種在副黏病毒F蛋白結構中插入二硫鍵來穩定其預融合構象是常用的副黏病毒F蛋白結構研究的策略。
2.2 F蛋白的功能 副黏病毒的F蛋白是行使病毒和細胞膜融合的功能蛋白,各種證據顯示其預融合狀態不穩定,需要HN/H/G蛋白維持。HN/H/G蛋白與受體結合后,激活F蛋白開始膜融合。作為膜融合機制作用蛋白,F蛋白與病毒的毒力密切相關,是作為疫苗研究的主要靶點,如在RSV的疫苗研究中主要就是圍繞著如何穩定RSV-F蛋白三聚體預融合狀態而開展的[20]。同時,副黏病毒感染過程中發生的組織壞死可能與F蛋白作用相關:副黏病毒F蛋白在宿主細胞膜上的表達介導了相鄰的細胞發生融合,形成合胞體,最終導致細胞病變而進一步發生組織壞死。
3 副黏病毒糖蛋白之間的相互作用
3.1 蛋白互作的模型假說 副黏病毒的糖蛋白對其生物學活性具有重要作用,關于F與HN/H/G蛋白之間的相互作用有很多相關研究報道。學術界曾提出了兩種模型來解釋它們之間的相互作用,夾鉗模型和破壞模型[1]。夾鉗模型認為,F蛋白同HN/H/G蛋白在細胞內就已經存在相互作用,二者以復合體的形式轉運到細胞表面,HN/H/G蛋白夾鉗住F蛋白,使得F蛋白處于亞穩定的狀態,當HN/H/G蛋白與受體結合后會釋放F蛋白,激活F蛋白的構象發生改變,從而啟動膜融合過程。大部分副黏病毒的生化研究支持這種模型[30,48],同時所有的結構研究支持這種模型。破壞模型認為,F蛋白與HN/H/G蛋白開始并不存在相互作用,二者獨立轉運至細胞表面,當HN/H/G蛋白結合受體后將激活信號傳遞給F蛋白,從而引發F蛋白的構象發生改變,完成融合。對NDV的部分生化研究支持破壞模型,但相關證據有可能是Co-IP實驗導致的假象[49],這種模型至今還未得到結構上實際觀察的驗證。
3.2 蛋白間互作區域研究 在兩者之間的特異性作用的具體區域研究中,在沒有足夠的結構信息前,學者更多的使用生化方法驗證蛋白及多肽間的相互作用。有學者將NDV-F和PIV-F的跨膜部分和莖部交接處進行片段切割交換后,并不影響其細胞融合功能,進一步將F2片段進行交換后也不影響各自的細胞融合功能,而將F的頭部進行交換后,F蛋白的融合功能消失。這說明F蛋白分子上與同源HN蛋白分子相互作用的特異性區域位于F1的胞外區域[50]。而副黏病毒HN/H/G蛋白上與F蛋白相互作用的區域卻依然未知。在NDV的研究中發現,HN莖部第49-143位氨基酸之間存在一個能增強F蛋白融合活性的區域,推測NDV-H的跨膜區和莖部區域共同決定融合作用的特異性[51]。而另一些研究表明NDV-HN的球狀頭部具有抑制F促進融合的作用,與HN頭部區域對膜融合過程中F蛋白具有促進作用的理論存在矛盾[52]。在PIV-2的研究中,PIV-2的HN蛋白頭部區域以及F蛋白HR1、HR2三個蛋白被重組表達純化,經體外結合試驗及質譜與圓二色譜分析,結果表明PIV-2的HN頭部區域與 HR1和HR2都能結合,并且結合后的蛋白構象及多肽構象都發生變化,進而推測PIV-2的HN頭部區域可能是與F蛋白的結合作用域[53]。對PIV3全病毒顆粒的9?結構解析顯示PIV3的HN蛋白是通過頭部區域的一個環狀區(Loop structure)參與F相互作用(圖8),且穩定了F三聚體的融合前構象[42]。針對目前的研究現狀,未能對于兩者蛋白相互作用區域作出一個確切又合理的解釋,推測這可能是由于蛋白不同結構域之間存在聯合作用機制或者兩種蛋白相互作用后構象改變引起功能的變化所導致的。
3.3 構象變化與蛋白互作的關系 基于已有的生化證據表明,副黏病毒的HN/H/G蛋白和F形成的復合物在與受體結合前后存在著構象變化,這種構象變化提供了F蛋白介導膜融合所需的條件。一般認為,在HN/H/G蛋白與受體相互作用之前,HN/H/G蛋白如同夾子一樣握住 F 蛋白,使其以穩定的融合前體存在;當HN/H/G蛋白與受體結合發生作用時,蛋白構象發生改變,從而使F蛋白脫離HN/H/G蛋白并發生重排,以中間體和融合后形式存在[54]。Porotto等[55]基于細胞表達NDV-HN、NIV-G、PIV3-H和PIV3-F的研究發現,在膜融合的全過程中HN/H/G蛋白對F蛋白不斷地激活,這表明可能存在更復雜的相互作用,但實驗證據并不確鑿。由于副黏病毒HN/H/G蛋白功能及構象差異較大,受體及受體結合位點也不一樣,因此不同副黏病毒HN/H/G蛋白及F蛋白復合物的受體結合后構象變化可能并不相同。
關于MeV-H和F蛋白在病毒入侵階段的相互作用以及其相互誘導的構象變化一直是學術界研究的熱點,同時由于其受體為蛋白,因此相關實驗數據較為豐富。張鵬在試驗中通過在細胞中轉染含H和F以及受體SLAM基因的表達質粒,對它們的相互作用及其功能進行了初步研究。單獨表達F和H蛋白時,在細胞表面呈分散狀態。同時表達F、H及SLAM受體時出現明顯的極化,呈帽子狀[56]。這一結果表明,H蛋白和F蛋白以及受體SLAM蛋白之間存在很強的相互作用,以形成一個功能化的復合體引發病毒入侵過程。有學者發現MeV-H蛋白兩個面對面的二聚體頭部相對移動可以向F蛋白傳遞信號,從而引發F蛋白構象發生改變,這表明H蛋白頭部介導了融合觸發信號的傳遞[54]。然而,Brindley等[57]通過構建無頭的MeV-H蛋白,發現穩定的無頭的MeV-H蛋白也能有效的觸發膜融合過程,這與先前的研究存在一些不同,值得進一步探討和驗證。
3.4 受體介導的F蛋白激活假說 學術界普遍認為副黏病毒HN/H/G蛋白由于受體的參與而發生的一些構象變化最終引起F的激活,目前基于副黏病毒受體介導的F蛋白激活存在五種模型假說,分別是滑動、莖部暴露、安全捕獲、雙齒和寡聚模式,如圖11[46]。滑動模型認為:當與受體結合后,HN/H/G蛋白頭部構象從平面側向滑動到更交錯的構象,因此,莖部結構會從緊密閉合的4HB結構移動到解離構象,進而導致F蛋白從HN/H/G蛋白中解離,該模型推斷,當與受體結合后,頭部會產生特定的信號,這些信號向下傳遞到莖部以激活F蛋白;莖部暴露模型認為:受體結合可能誘導HN/H/G蛋白的構象變化,從四頭朝下的構象變為二頭朝上二頭朝下的構象,這種頭部向上的構象會暴露附著蛋白中的莖部結構域與F蛋白相互作用;安全捕獲模型認為:HN/H/G蛋白頭部會在四頭向下的構象中折疊成一個自動抑制的構象,提前鎖定其莖部激活F蛋白的能力,這種鎖定能力將在受體結合后通過頭部的移動而解除。該模型表明,由于HN/H/G蛋白的自抑制構象,F蛋白可以在受體結合之前與HN/H/G蛋白相互作用而不會提前觸發。該模型可以看作是上述莖部暴露模型的一個變種;雙齒模型最初是針對NiV提出的,該模型提出F蛋白與HN/H/G蛋白的頭部和莖部都有相互作用,受體結合后與融合蛋白的主要相互作用從頭部切換到HN/H/G蛋白的莖部,該模型也在不斷被證實;寡聚化模型則認為受體結合可能會導致附著蛋白寡聚化增加,進而激活F蛋白。但是,由于現階段觀察到的不同副黏病毒的HN/H/G蛋白結構有多種構象,因此模型之間可能并非相互獨立,兩個或者多個模型可以適用同一種副黏病毒[58]。
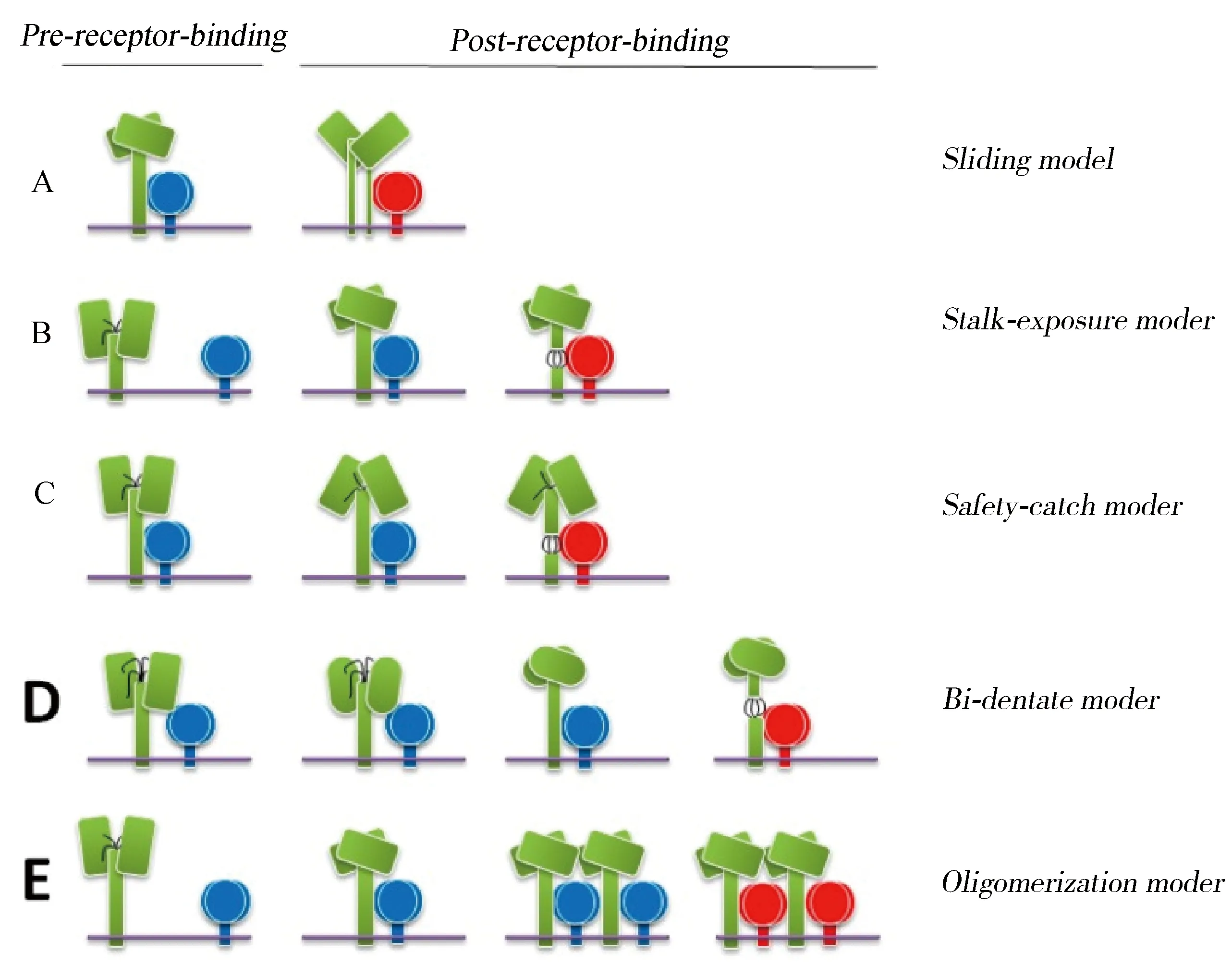
圖11 副黏病毒HN/H/G蛋白激活F蛋白的模型
4 展 望
副黏病毒在世界范圍內的流行傳播對人類健康與畜牧業發展造成重大影響,其家族包含了眾多的人畜共患病毒,關于副黏病毒入侵機制的研究也一直是學術界的熱點。副黏病毒糖蛋白的吸附和融合作用是病毒入侵宿主細胞的關鍵步驟,在研究病毒入侵機制以及疾病防治環節都處于非常重要的地位。本文總結了近年來副黏病毒糖蛋白的相關研究,其分子結構及相互作用機制研究已經較深入,通過對副黏病毒糖蛋白的相關闡述,以期為揭示病毒入侵宿主細胞機制提供參考,同時希望對于未來新型疫苗的研發以及疫病的防治奠定理論基礎。目前研究成果初步說明了,各病毒成員之間的糖蛋白結構、HN/H/G蛋白頭部受體結合位點以及它們之間的相互作用等方面均存在差異,但也有許多的共性。不同病毒糖蛋白的具體相互作用機制是一項較為復雜的研究,功能性蛋白多聚體、整體復合物的詳細結構以及介導它們相互作用的蛋白殘基的分子性質在很大程度上還是未知的,這些問題阻礙了基于結構的新型特異性抗體的開發。為了解決這些問題,可能需要對完整的、天然的病毒糖蛋白復合物進行低溫電子層析,并在相關結構位點進行進一步精細的功能和生化分析,這將對研究病毒的入侵以及新型特異性抗體和疫苗的研發提供有力支撐[59]。目前副黏病毒的研究大多與人類疾病相關,而副黏病毒絕大多數是人畜共患傳染病,加強對動物副黏病毒入侵機制的深入研究,對未來人獸共患疫病的防治同樣具有重要意義。

