黃芩素介導自噬經由miR-449a/HDAC1 軸抑制喉癌細胞增殖及遷移的機制研究
王 劍孫永東周興瑋劉 雷童興科陳 龍何 嫻*
(1.西南醫科大學附屬中醫院,耳鼻咽喉頭頸外科,四川 瀘州 646000;2.西南醫科大學中西醫結合學院,四川 瀘州 646000)
喉癌起源于喉黏液上皮組織的惡性腫瘤,多為鱗狀細胞癌。 發病率占全身性癌癥的1.5%[1]。 盡管對早期喉部鱗狀細胞癌進行手術干預有很好的治療效果,但對晚期和轉移性腫瘤患者來說臨床治療效果較差,放療和化療是晚期病例的主要治療方法,但有許多患者對放療敏感或耐藥[2],導致晚期喉癌5 年生存率僅有51%左右[3]。 喉癌具有易復發、易轉移等特點,嚴重危害著人類的生命健康,因此確定喉癌的進展和分子調控機制,尋找新型治療藥物,并為喉癌患者制定新的治療策略迫在眉睫。
自噬是一種溶酶體降解的途徑,可以阻礙早期癌癥的發生,又可以促進晚期腫瘤的發展[4]。 當細胞自噬發生異常的時候,會打破平衡導致癌癥的發生,將自噬抑制劑與已建立的癌癥治療相結合可以提高癌癥細胞的耐受性,起到更好的治療作用[5]。microRNAs(miRNAs)是一類內源性非蛋白質編碼小分子RNA,長度約為20 ~24 個核苷酸,通過與mRNA 互補結合,在轉錄后水平抑制靶基因的表達[3]。 由于miRNA 發揮著類似于癌基因或抑癌基因的作用,因此通過外源補充miRNA 或miRNA 抑制物可以調控mRNA 及其蛋白的表達,從而控制腫瘤惡性增殖和促進細胞凋亡[6]。 其中miR-499 被檢測出有多重靶標,可以通過調控基因表達對多種惡性腫瘤發揮抑癌作用[7]。 根據生物信息學在線軟件預測發現,HDAC1 與miR-449a 有靶向結合位點。最新研究發現,miR-449a 能夠通過靶向抑制HDAC1的表達,抑制肺癌細胞的增殖、侵襲和轉移[8]。 多項研究表明,HDAC 可以調節各種癌癥的晚期惡性腫瘤和化療耐藥性,其在喉癌細胞中表達上調[9]。
黃芩素是我國傳統中藥黃芩的主要有效成分。黃芩素對多種惡性腫瘤有抑制作用,包括肝癌、結腸癌等[10-12]。 同時,近年來的多項研究發現,黃芩素對喉癌細胞的增殖、遷移和侵襲也具有明顯的抑制作用,且可以誘導其發生凋亡和自噬[13-15]。 基于上述研究背景,本實驗將miR-449a 的表達情況與黃芩素抑制喉癌細胞的作用聯系起來,探究了miR-449a 的靶點,以此深入探究黃芩素的抑癌機制。 即探究黃芩素是否能通過介導自噬經由miR-449a/HDAC1 軸抑制喉癌細胞增殖及遷移,為臨床喉癌治療提供充分實驗依據和理論基礎。
1 材料和方法
1.1 細胞
人喉癌細胞(Hep-2)(貨號:HTX2247)購于深圳豪地華拓生物科技有限公司。
1.2 主要試劑與儀器
黃芩素(C12455217)、6-氨基-3 甲基嘌呤(C12621613)購自上海麥克林生化科技有限公司;DMEM 高糖培養基(G4510)購自武漢賽維爾生物科技有限公司;胰酶(+EDTA)(SH30042.01)購自美國HyClone;胰酶(-EDTA)(0420A21)、RNA TRIzol Reagent(BM1144)購自合肥博美生物科技有限責任公司;胎牛血清(P20522)購自北京鼎國生物技術公司;MTT(1334GR001)購自德國BioFRoxx;二甲基亞砜(DMSO,A610163) 購自美國Sigma;AnnexinVAPC/PE 凋亡試劑盒(KGF003-20 T)購自江蘇凱基生物技術股份有限公司;micrON hsa-miR-125b-5p mimic(miR10000423-1-5)、micrOFF hsa-miR-125b-5p inhibitor (miR20000423 - 1 - 5)、 Bulge-LoopTMmiRNA qRT-PCR Primer(R10031.7)、Bulge-LoopTMmiRNA qRT-PCR Starter Kit(R11067.2)購買于中國銳博生物;Beclin-1 抗體(A7353)、HDAC1 抗體(A19571)、 LC3B 抗 體( A19665)、 P62 抗 體(A11250)、β-actin 抗體(AC026)及生物素化山羊抗兔IgG(ab6721)均購自武漢愛博泰克生物科技有限公司。
實時熒光定量(RT-PCR)儀(PIKORed 96,美國ThermoFisher 儀器有限公司);電泳儀(JY200C,北京君意東方電泳設備有限公司);倒置生物顯微鏡(DMI1,上海徠卡顯微系統貿易有限公司);臺式低速離心機(TDZ4-WS,長沙湘儀離心機儀器有限公司);流式分析儀(cytoflex,美國Beckman);化學發光凝膠成像儀(5200,上海天能科技有限公司);透射電子顯微鏡(JEM-1400FLASH,日本電子JEOL)。
1.3 實驗方法
1.3.1 細胞培養
HEP-2 細胞接種于含有10% 胎牛血清的DMEM 高糖培養基中,放入37℃,含5% CO2的孵箱培養。 選取狀態良好的對數生長期的Hep-2 細胞進行傳代,加入胰蛋白酶體積3 倍的新鮮培養基終止消化,消化后的細胞加入新鮮培養基,以1 ∶3 傳代培養。 進行細胞計數并按要求稀釋細胞懸液,胰蛋白酶消化收集細胞,吸取上清液后丟棄并加入1 mL凍存液(55% FBS+40% FBS+5% DMSO),混勻后轉移至凍存管中密封。
1.3.2 MTT 法檢測細胞增殖抑制率
取對數生長期的Hep-2 細胞,進行細胞計數后調節細胞密度為5×104/mL,每孔100 μL 接種于96孔板中,37℃、5% CO2條件下進行恒溫培養。 待細胞貼壁后,設置組別:正常組、黃芩素組(200 μmol/L)、黃芩素(200 μmol/L)+3-MA(4 mmol/L)組、3-MA 組(4 mmol/L),加入相對應濃度的藥物。 藥物作用24 h 后,吸棄上清,每孔加入200 μL 終濃度為0.5 mg/mL 的MTT 溶液,37℃、5%CO2恒溫繼續培養4 h。 使用酶標儀在570 nm 波長處測定各孔的吸光值。
1.3.3 細胞劃痕實驗
取對數生長期的Hep-2 細胞,進行細胞計數后調節細胞密度為1×105/mL,每孔2 mL 接種于6 孔板中,37℃、5% CO2條件下恒溫培養。 待細胞貼壁后,設置組別同1.3,培養24 h。 待細胞長滿至單層,吸除上清液,移液槍取200 μL 槍頭垂直于背后橫線劃痕。 PBS 輕輕洗滌2 次以去除劃下細胞,放入37℃、5% CO2培養箱培養。 在0 h 及24 h 時間點分別取樣,50 倍鏡下在各水平直線標記處跟蹤拍攝細胞劃痕狀態。 測量劃痕距離,計算0 h 和24 h內遷移距離的平均值與標準差。
1.3.4 流式細胞儀檢測細胞凋亡率
取對數生長期的Hep-2 細胞,每孔2 mL 接種于6 孔板中,37℃、5% CO2恒溫培養。 待細胞貼壁后,按1.3 所述方法設置組別加入不同濃度藥物培養。根據閆婷婷[5]的試驗方法處理細胞并獲得細胞沉淀。 用500 μL 的Binding Buffer 重懸細胞后,加入5 μL Annexin V APC 輕輕吹勻,再加入5 μL 的PE 混勻;室溫避光反應15 min,上機檢測分析。
1.3.5 Western blot 實驗
收集黃芩素或3-MA 處理過或經miR-449a mimic 轉染的喉癌細胞Hep-2,加入預冷的RIPA 裂解緩沖液200 μL,碎冰上裂解10 min,收集裂解液,在4℃、12 000 r/min 下離心15 min。 取出上清液,用BCA 蛋白檢測試劑盒對蛋白質進行定量。 樣品加載到10%聚丙烯酰胺進行SDS-PAGE 電泳,并轉移到硝酸纖維素薄膜上(PVDF 膜)。 將PVDF 膜放入用TBST Buffer 稀釋的5%脫脂奶粉并在室溫下搖晃并孵化2 h,加入一抗(Beclin-1 1 ∶2000;HDAC1 1 ∶2000;LC3B 1 ∶2000;p62 1 ∶2000;β-actin 1 ∶100 000)。 在4℃下孵育過夜后,TBST 將膜洗滌3次,每次5 min。 然后加入相應的二抗(1 ∶5000),在室溫下孵育2 ~3 h,TBST 膜洗3 次共30 min,進行化學發光反應顯色。 用Image-J 圖像分析軟件分析目標蛋白的表達水平,以同一泳道的目標蛋白與β-actin 的灰度值比作為測量結果進行比較分析。
1.3.6 RT-PCR 檢測
按照試劑盒的說明,分別用TRIzol 試劑提取轉染、黃芩素或3-MA 處理后的Hep-2 細胞的總RNA。取5 μg 的總RNA,通過反轉錄反應合成cDNA。 純化的RNA 作為模板,使用試劑盒合成cDNA。 用cDNA、Mir-X miRNA qRT-PCR TB Green?試劑盒和miR-449a 的基因特異引物進行RT-qPCR。 所有引物都是由生工生物技術(上海)有限公司合成。miR-449a 的 引 物 序 列, 正 向: 5 ’-ACTTTTATTGGTCTCAAGTCAGTGTACAG-3’, 反 向由Mir-X miRNA qRT-PCR TB Green?Kit 提供。 U6的引物序列由Mir-X miRNA qRT-PCR TB Green?Kit 提供。 反應結束后,計算機自動分析每個樣品的Ct 值,miR-449a 以U6 為內參對照,通過2-△△Ct計算相對mRNA 表達量。
1.3.7 生物信息學分析及雙熒光素酶試驗
為了確定miR-449a 與HDAC1 之間的調節關系,本研究使用專門設計的熒光素酶載體進行了熒光素酶試驗。 含有miR-449a 結合位點的HDAC1 的完整3’UTR 序列被擴增并亞克隆到pSI-Check2 載體中,生成HDAC1 的野生型載體(h-HDAC1-3UTRwt)。 設計不含有miR-449a 結合位點的HDAC1 的3’UTR 序列被擴增并亞克隆到pSI-Check2 載體中,生成HDAC1 的突變型載體(h-HDAC1-3UTR-mut)。根據涂友慧[16]的試驗方法,準備好用于轉染的細胞和目的質粒h-HDAC1-3UTR,將細胞轉染后分為四組:NC mimics+h-HDAC1-3UTR-wt、hsa-miR-449a+h-HDAC1-3UTR-wt、NC mimics +h-HDAC1-3-UTR-mu及hsa-miR-449a+h-HDAC1-3UTR-mu。 細胞轉染后于37℃,5% CO2條件下培養。 轉染6 h 后換取新鮮培養基,48 h 后收集細胞,使用Promega Dual-Luciferase system 試劑盒檢測。
1.3.8 透射電子顯微鏡觀察自噬小體
Hep-2 人喉癌細胞共分為5 組,包括NC 組、黃芩素組、miR-449a mimic 組、黃芩素+mimic NC 組及黃芩素+miR-449a mimic 組。 樣品經3%戊二醛預固定,1%四氧化鋨再固定,丙酮逐級脫水,Ep812 包埋,半薄切片用甲苯胺藍染色作光學定位,用鉆石刀作超薄切片,醋酸鈾和枸櫞酸鉛染色,切片使用JEM-1400FLASH 透射電鏡觀察,每張銅網先于6000倍下觀察,選擇要觀察的區域采集圖片,觀察具體病變。
1.4 統計學方法
2 結果
2.1 黃芩素對喉癌細胞增殖、遷移的影響
MTT 實驗用于檢測細胞存活和生長。 結果觀察到, 黃芩素組細胞增殖抑制率為(27.69 ±5.66)%,正常組增值抑制率為(0.00±0.00)%,黃芩素組對比正常組細胞增殖抑制率增加極為明顯(P<0.001)。 僅加入3-MA 處理的細胞增殖抑制率為(-3.23±4.03)%,低于正常組,即抑制喉癌細胞自噬后會誘導增加細胞的增殖。 同時加入黃芩素后,黃芩素+3-MA 組細胞增殖抑制率為(14.97±4.71)%,相較于3-MA 組細胞極顯著增加(P<0.001)。 以上結果說明黃芩素可以抑制喉癌細胞增殖,且黃芩素聯合3-MA 處理喉癌細胞后可逆轉3-MA 抑制自噬引起的細胞增殖。
細胞劃痕實驗可用來檢測細胞的遷移能力變化。 實驗分別觀察了細胞在0 h、24 h 的劃痕愈合情況,結果如圖1A,各組細胞0~24 h 平均遷移距離如圖1B,其中經黃芩素處理后的細胞遷移距離為(168.91±9.78)μm,極顯著小于正常組遷移距離(284.26±9.66)μm(P<0.001)。 3-MA 組細胞遷移距離較大為(279.32±19.390)μm,而黃芩素+3-MA組細胞遷移距離顯著小于3-MA 組為(214.18±16.33)μm(P<0.001)。 以上結果證明黃芩素可使喉癌細胞遷移能力減弱,加入細胞自噬抑制劑3-MA時同時加入黃芩素處理可以恢復細胞自噬能力,減弱遷移能力。

注:A:細胞劃痕實驗觀察細胞24 h 內遷移情況;B:各組細胞平均遷移距離。 a:正常組;b:黃芩組;c:黃芩組+3-MA 組;d:3-MA 組。 與正常組相比,***P<0.001;與3-MA 組相比, ###P<0.001。圖1 黃芩素抑制喉癌細胞的遷移Note.A, Wound healing test to observe cell migration within 24h.B, Mean migration distance of cells in each group.a, Control group.b, Baicalein group.c, Baicalein+3-MA group.d, 3-MA group.Compared with control group, ***P<0.001.Compared with 3-MA group, ###P<0.001.Figure 1 Baicalein inhibits the migration of laryngeal cancer cells
2.2 黃芩素對喉癌細胞凋亡的影響
進一步采用流式細胞儀檢測經3-MA 或黃芩素處理后Hep-2 細胞的凋亡率變化。 在圖2A 的流式細胞圖中,I 象限呈現晚期凋亡細胞,IV 象限呈現早期凋亡細胞,細胞凋亡率即第一象限和第四象限百分率的和。 細胞凋亡率統計結果詳見圖2B。 結果顯示,與正常組相比,黃芩素處理后的喉癌細胞Hep-2 在I 和IV 象限出現了晚期凋亡和早期凋亡,凋亡率為(17.93±1.5)%,高于正常組細胞的凋亡率(3.71±0.36)%(P<0.05),具有統計學意義,表明黃芩素具有誘導喉癌細胞Hep-2 凋亡的作用。 3-MA 組細胞凋亡率為(3.25±0.15)%,與之相比,黃芩素+3-MA 組細胞在I 象限及IV 象限的凋亡率有顯著增加(P<0.01),為(9.96±0.57)%。 說明加入黃芩素可以逆轉3-MA 對細胞自噬的抑制作用,從而誘導細胞凋亡。

注:A:細胞凋亡率(流式細胞術);B:流式細胞圖。 a:正常組;b:黃芩組;c:黃芩組+3-MA 組;d:3-MA 組。 與正常組相比, *P<0.05;與3-MA組相比, ##P<0.01。圖2 黃芩素誘導細胞凋亡Note.A, Apoptosis rate (flow cytometry).B, Flow cytogram.a, Control group.b, Baicalein group.c, Baicalein+3-MA group.d, 3-MA group.Compared with control group, *P<0.05.Compared with 3-MA group, ##P<0.01.Figure 2 Baicalein induces apoptosis
2.3 黃芩素對喉癌細胞自噬流調控的影響
為探究黃芩素對喉癌細胞自噬的影響,檢測了各組喉癌細胞中自噬相關蛋白的表達水平。 其中,Beclin-1 蛋白是參與自噬的特異性基因之一,在自噬的溶酶體降解途徑中發揮抑制腫瘤的作用。 LC3是自噬體形成過程中的特異性標記蛋白,包括LC3I及LC3II。 LC3II 與LC3I 的比值與自噬體形成的數量和自噬發生的程度成正比[17]。 另外,p62 會通過與LC3 的直接結合并選擇性地結合到自噬體中,最終在自噬溶酶體內有效降解。 因此,LC3II 升高聯合p62 降低可以被認為是自噬水平提高的指標[18]。Western blot 結果如圖3 所示,黃芩素組細胞的Beclin-1 蛋白表達顯著高于正常組(P<0.01),LC3II/LC3I 比值極顯著高于正常組(P<0.001),而p62 蛋白表達水平則顯著低于正常組(P<0.01)。結果表明,黃芩素可以調控喉癌細胞Hep-2 的自噬相關基因表達,誘導喉癌細胞自噬。 經自噬抑制劑3-MA 處理后的細胞,自噬相關基因蛋白表達水平變化顯著,但當黃芩素與3-MA 聯合作用于Hep-2細胞后,其中Beclin-1 蛋白表達高于3-MA 組(P<0.05)和正常組,LC3II/LC3I 比值極顯著高于3-MA組(P<0.001)和正常組,而p62 表達水平顯著低于3-MA 組(P<0.01)和正常組,說明黃芩素可以逆轉3-MA 的細胞自噬抑制作用并誘導細胞自噬。

注:A:Hep-2 細胞中Beclin-1、LC3I、LC3II、p62 蛋白的表達水平;B:Beclin-1 蛋白表達統計;C:p62 蛋白表達統計;D:LC3II/LC3I 蛋白表達比值大小;a:正常組;b:黃芩組;c:黃芩組+3-MA 組;d:3-MA 組。 與正常組相比,**P<0.01, ***P<0.001;與3-MA 組相比, #P<0.05,##P<0.01,###P<0.001。圖3 黃芩素調控自噬相關基因表達Note.A, Expression levels of Beclin-1, LC3I, LC3II, and p62 proteins in Hep-2 cells.B, Statistical graph of Beclin-1 protein expression in Hep-2 cells.C, Statistical graph of p62 protein expression in Hep-2 cells.D, Size of LC3II/LC3I protein expression ratio in Hep-2 cells.a,Control group.b, Baicalein group.c, Baicalein +3-MA group.d, 3-MA group.Compared with control group, **P <0.01, ***P <0.001.Compared with 3-MA group, #P<0.05,##P<0.01,###P<0.001.Figure 3 Baicalein regulates autophagy-related gene expression
2.4 黃芩素對喉癌miR-449a/HDAC1 軸的影響
miR-449a 被發現在多種癌癥中發揮腫瘤抑制作用[8],但在喉癌細胞中的作用尚不清楚。 PCR 結果如圖4A 所示,黃芩素作用下喉癌細胞Hep-2 的miR-449a 表達相比正常組細胞有一定增加(P<0.05),自噬抑制劑3-MA 作用下喉癌細胞Hep-2 的miR-449amRNA 表達減少,但3-MA 與黃芩素聯合處理后,miR-449a mRNA 表達對比正常組細胞和3-MA 組細胞均顯著增加(P<0.01),說明黃芩素可以上調miR-449a 表達,并且可以逆轉3-MA 抑制細胞自噬后引起的miR-449a 表達下調。
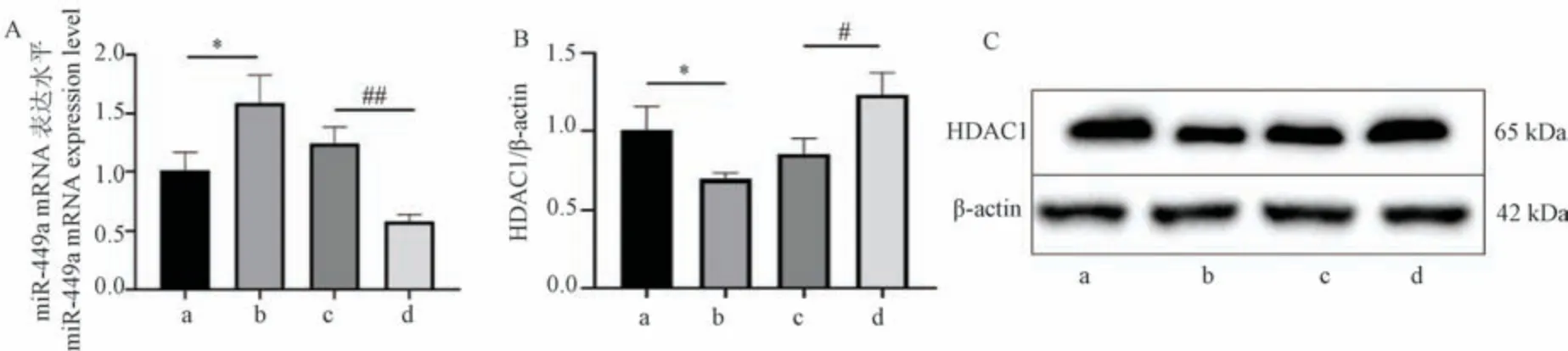
注:A:miR-449a 表達水平;B:HDAC1 蛋白表達統計;C:HDAC1 蛋白表達結果。 a:正常組;b:黃芩組;c:黃芩組+3-MA 組;d:3-MA 組。 與正常組相比, *P<0.05;與3-MA 組相比, #P<0.05,##P<0.01。圖4 黃芩素上調miR-449a 表達水平和下調HDACI 蛋白表達Note.A, miR-449a expression level.B, Statistical plot of HDAC1 protein expression.C, HDAC1 protein expression results.a, Control group.b,Baicalein group.c, Baicalein+3-MA group.d, 3-MA group.Compared with control group, *P <0.05.Compared with 3-MA group, #P <0.05,##P<0.01.Figure 4 Baicalein up-regulates miR-449a expression level and down-regulates HDACI protein expression
HDAC1 經研究發現在喉癌細胞中表達上調[19],而Western blot 結果顯示(圖4B、4C),黃芩素組HDAC1 蛋白表達量低于正常組(P<0.05),黃芩素聯合3-MA 組低于3-MA 組(P<0.05)。 這說明黃芩素可以下調喉癌細胞中HDAC1 表達。
2.5 miR-449a 與HDAC1 的靶向關系驗證
經生物信息學在線軟件預測,發現HDAC1 與miR-449a 的靶位點結合示意圖如圖5A。 雙熒光素酶報告結果如圖5B,與NC 組相比,hsa-miR-449a 能夠顯著下調h-HDAC1-3UTR-WT 的熒光素酶的表達(P<0.001),說明本實驗中兩者間存在結合作用。
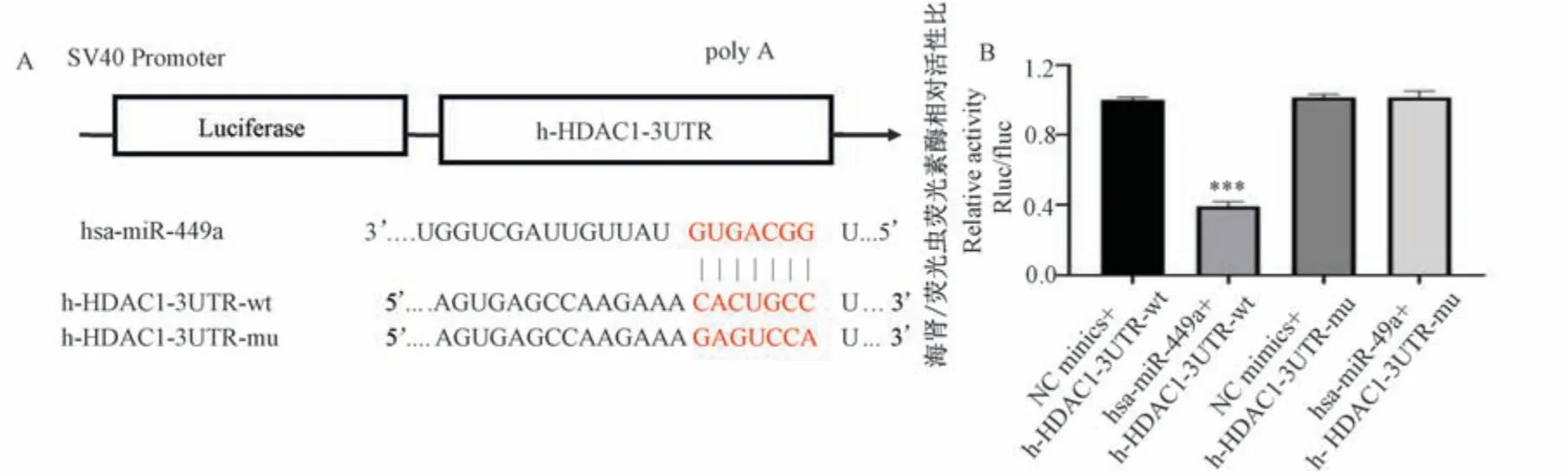
注:A:生物信息學分析hsa-miR-449a 與h-HDAC1-3UTR 靶位點結合示意圖;B:雙熒光素酶報告基因檢測hsa-miR-449a 與h-HDAC1-3UTR相互作用。 與NC minics+h-HDAC1-3UTR-wt 組相比, ***P<0.001。圖5 雙熒光素酶報告基因檢測熒光素酶活性Note.A, Schematic diagram of bioinformatics analysis of hsa-miR-449a binding to h-HDAC1-3UTR target site.B, Results of dual luciferase reporter gene assay for hsa-miR-449a interaction with h-HDAC1-3UTR.Compared with NC minics+h-HDAC1-3UTR-wt group, ***P<0.001.Figure 5 Luciferase activity was detected by Dual-luciferase reporter gene assay
2.6 黃芩素抑制喉癌細胞增殖及遷移的機制研究
MTT 法檢測各組細胞增殖活力,結果如圖6A所示,黃芩素組細胞增殖抑制率相比NC 組顯著增加(P<0.01),Hep-2 細胞轉染miR-449a mimic 后,細胞的增殖抑制率極顯著增加(P<0.001),說明細胞可以通過黃芩素處理或miR-449a 上調抑制喉癌細胞的增殖;黃芩素組與黃芩素+mimic 組結果相近,說明mimic NC 對黃芩素的抑制作用沒有影響;若黃芩素聯合miR-449a mimic 轉染,其增殖抑制率不僅比黃芩素+mimic NC 組細胞顯著增加(P<0.01),同時比僅轉染組的細胞極顯著增高(P<0.001),說明黃芩素聯合miR-449a mimic 處理細胞可以更顯著地抑制喉癌細胞的增殖。
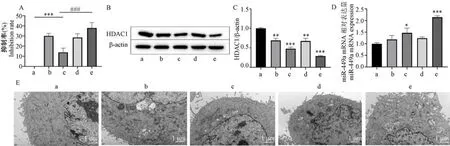
注:A:MTT 法檢測細胞增殖抑制率;B:HDAC1 蛋白表達情況;C:HDAC1 蛋白表達統計圖;D:miR-449a 表達水平;E:透射電鏡(JEM-1400FLASH)觀察細胞自噬小體。 a: NC 組;b: 黃芩素組c: miR-449a mimic 組;d: 黃芩素+mimic NC 組;e: 黃芩素+miR-449a mimic 組。 與NC 組相比, *P<0.05, **P<0.01, ***P<0.001;與miR-449a mimic 組相比,###P<0.001。圖6 黃芩素誘導細胞自噬,經由miR-449a/HDAC1 軸作用喉癌細胞Note.A, Results of cell proliferation inhibition rate by MTT assay.B, HDAC1 protein expression.C, HDAC1 protein expression statistics.D, miR-449a expression level.E, Results of cellular autophagy vesicles observed by transmission electron microscopy (JEM-1400FLASH).a, NC group.b,Baicalein group.c, miR-449a mimic group.d, Baicalein+mimic NC group.e, Baicalein+miR-449a mimic group.Compared with NC group, *P<0.05, **P<0.01, ***P<0.001.Compared with miR-449a mimic group, ###P<0.001.Figure 6 Baicalein induces autophagy and acts on laryngeal cancer cells via the miR-449a/HDAC1 axis
Western blot 結果如圖6B、6C,黃芩素聯合miR-449a mimic 轉染時,喉癌細胞HDAC1 表達水平最低,黃芩素組和miR-449a mimic 組均顯著低于NC組(P<0.01)。 說明細胞通過黃芩素處理或上調miR-449a 表達均可以降低HDAC1 蛋白表達從而抑制喉癌細胞。 PCR 結果如圖6D,黃芩素組相比NC組,細胞miR-449a 表達水平有一定升高但不顯著,聯合miR-449a mimic 轉染后則有極顯著增加(P<0.001)。
為了更直觀地證明黃芩素能夠誘導Hep-2 細胞的自噬,通過透射電子顯微鏡觀察自噬小體數量的變化,結果如圖6E,NC 組細胞內細胞質均勻,經黃芩素處理后的Hep-2 細胞,細胞質中出現囊泡狀雙膜結構,即自噬小體,當自噬發展到后期則形成自噬溶酶體,當黃芩素與miR-449a mimic 聯合作用于細胞,喉癌細胞中自噬溶酶體數量明顯增加,細胞核開始出現皺縮和裂解,細胞狀態變差,更進一步證明了黃芩素可以誘導喉癌細胞Hep-2 自噬。
3 討論
喉癌是最常見的頭頸部惡性腫瘤之一,其病因主要有吸煙、慢性喉炎及空氣污染等,發病率極高且容易復發,這也是其預后效果較差的主要原因[20]。 最近幾年來,有關中藥抗喉癌的研究取得一定進展。 郭俊宇等[21]研究發現,丹酚酸B 能夠抑制喉癌細胞Hep-2 增殖并誘導細胞凋亡;周華群等[22]研究發現姜黃素與白藜蘆醇聯合處理會抑制Hep-2細胞集落的形成并促進凋亡。 實驗前期通過MTT實驗及細胞劃痕實驗,證明了黃芩素對Hep-2 細胞增殖及遷移的抑制作用。
細胞凋亡是程序性細胞死亡的一種表現形態,主要負責移除機體多余的以及受損的細胞[23]。 癌細胞的凋亡在癌癥的惡性進展和轉移中起著關鍵作用[24]。 誘導腫瘤細胞凋亡可用于治療癌癥[25],但由于凋亡的誘發和調節機制不同,各種腫瘤藥物誘發細胞凋亡的機制也不同。 有許多天然化合物被證明可以誘導腫瘤細胞中被阻斷的細胞凋亡通路[26],其中包括黃酮類化合物。 本研究通過流式細胞儀檢測細胞凋亡率發現,黃芩素可以誘導喉癌細胞Hep-2 的凋亡。 并且,黃芩素與3-MA 共同作用于細胞時,可以逆轉由3-MA 抑制自噬引起的凋亡抑制作用。
細胞自噬是一種高度保守的自我降解過程,在細胞應激中起關鍵作用,自噬可以調節腫瘤的形成、增殖、轉移及能量代謝等[27]。 凋亡與自噬之間的關系錯綜復雜,當細胞處于應激條件下,自噬被誘導發生,細胞凋亡被激活,兩者之間可以互相轉換[28]。 自噬和凋亡過程中涉及到的關鍵調節蛋白具有雙重調節作用。 例如,Beclin-1 作為自噬過程中的調節蛋白,同時可以調控凋亡過程。
Beclin-1 是III 類PI3K 復合物的亞基,其與自噬前體的結合啟動自噬體的形成,該蛋白是自噬體形成所必需[29]。 LC3I 會在自噬形成時被酶解,使其與磷脂酰乙醇胺結合轉變為LC3II,因此檢測LC3II 與LC3I 的比值可用來評估自噬水平的高低[30]。 p62 是一種泛素結合蛋白,參與多種細胞信號轉導調控及自噬調控,p62 表達水平高低與自噬負相關[31]。 為進一步確定黃芩素對喉癌細胞自噬的影響,通過Western blot 實驗檢測以上四種自噬相關基因蛋白表達的水平。 結果發現黃芩素在作用于Hep-2 細胞時,同樣可以誘導細胞自噬現象。 并且實驗通過透射電子顯微鏡觀察發現,上調miR-449a 表達與黃芩素處理均可誘導細胞自噬增加細胞內自噬小體數量。
大量實驗證明,miRNA 可以通過多個相關基因調控喉癌的發展和轉移[32],雖然黃芩素對喉癌細胞的作用研究較多,但黃芩素調控miRNAs 在喉癌中扮演何種的角色,這方面的研究仍然未見報道。miRNA 可以通過多種細胞調節通路調節細胞發育、分化、增殖和凋亡[33],其中miR-499a 是miR-499 家族中最常見的亞型,可以調節多種癌癥中的細胞增殖、凋亡、遷移及細胞侵襲[34-35]。 miR-449a 下調會促進乳腺癌細胞遷移和侵襲[36],抑制NCCLC(非小細胞肺癌)細胞的增殖、遷移和侵襲[37],且miR-449a 在喉癌細胞中表達下調[38]。 本研究通過PCR實驗檢測確定,黃芩素可以上調喉癌細胞miR-449a的表達水平,從而達到抑制喉癌細胞增殖等作用。
miR-449 作用機制包括三種,最常見的途徑即通過下調組蛋白去乙酰化酶(HDAC1)和沉默調節蛋白1(SIRT1),誘導腫瘤蛋白p53 依賴性細胞凋亡。 有研究發現HDAC1 促進了喉癌的形成和發展[39],但HDAC1 在喉癌細胞增殖和遷移中的作用尚不明確。 本實驗經過生物信息學軟件預測分析推測miR-449a 與HDAC1 靶向結合參與了喉癌的發生發展,通過雙熒光素酶報告基因實驗鑒定驗證,hsa-miR-449a 能夠顯著下調h-HDAC1-3UTR-WT 的熒光素酶的表達,兩者間的確存在結合作用。 接著通過Western blot 和PCR 實驗檢測發現黃芩素處理或上調miR-449a 均可以下調HDAC1 在喉癌細胞中的表達水平,說明黃芩素作用下過表達的miR-449a抑制了HDAC1 的表達,與軟件預測結果一致。
綜上所述,黃芩素可以介導喉癌細胞Hep-2 自噬,通過上調miR-449a 表達達到下調HDAC1 表達的作用,進而抑制喉癌細胞的增殖及遷移,并誘導細胞凋亡。 中藥單體可以通過調控多條信號通路來影響喉癌的發展,但對于這些通路如何相互影響的研究不多,本研究結果證明miR-449a 與HDAC1在喉癌細胞發展中的結合作用,可對黃芩素成為臨床潛在的新的化療藥物,從而輔助治療喉癌提供理論及實驗依據,黃芩素對于喉癌細胞的作用還需要更加深入研究分子機制,為后期臨床試驗補充依據。

