HDAC6 抑制劑通過保護腎小球內皮細胞線粒體穩態和EMT 改善糖尿病腎病
陳小麗,羅富里,童夢瑤
(1.井岡山大學附屬醫院腎病風濕免疫科,江西 吉安 343000;2.江西中醫藥大學附屬醫院腎病科,南昌 330006;3.江西中醫藥大學第二附屬醫院呼吸科,南昌 330006)
糖尿病腎病(diabetic nephropathy,DN)是全球終末期腎病的主要原因,因為一半以上需要透析的患者患有糖尿病[1]。 盡管目前建議對DN 治療進行早期干預,以最佳血糖和血壓控制來預防主要不良腎結果,但不良腎和心血管結果的殘余風險仍然很高[2]。 因此,理解DN 的發病分子機制、識別可靠的生物標志物,是開發新的治療方法來阻止或逆轉DN 進展的必要途徑。
腎小球內皮細胞由于其持續高水平的能量消耗而含有豐富的線粒體[3]。 腎疾病的早期階段通常發生代謝改變,它們會破壞線粒體穩態,如線粒體功能障礙和能量代謝受損[4],并伴隨著線粒體的一系列變化,包括破碎的形態、活性氧的產生升高和線粒體膜電位的喪失,導致足細胞丟失和脫離以及足突消失,最終出現腎小球濾過屏障破壞和蛋白尿[5]。 最近的研究證明組蛋白去乙酰化酶(histone deacetylases,HDAC)在維持足細胞功能平衡方面發揮著至關重要的作用[6]。 在人類鑒定的18 種HDAC 中,HDAC6 是特異性的HDAC,因為它有兩個活性去乙酰化酶結構域和一個鋅指基序,可優先定位于細胞質[7]。 HDAC6 的亞細胞定位使其與影響細胞遷移、增殖和錯誤折疊蛋白分解代謝的其他細胞質蛋白和多泛素鏈相互作用[8-9]。 最近研究證實,HDAC6 可能是DN 治療的有希望的治療靶點[7]。 此外,HDAC6 抑制通過抑制上皮細胞-間充質轉化(epithelial-mesenchymal transition,EMT)減輕梗阻性腎病的腎纖維化[8]。 還有研究發現HDAC6是線粒體動力學多種機制中的關鍵調節因子,其抑制與減輕線粒體功能障礙密切相關[10]。 然而,目前尚不清楚HDAC6 是否通過破壞腎小球內皮細胞線粒體穩態參與DN 的病理機制。
在本研究中,我們從EMT 以及線粒體介導的細胞凋亡等方面檢測了HDAC6 特異性小分子抑制劑Tubastatin A 對DN 小鼠腎損傷的保護作用。
1 材料和方法
1.1 實驗材料
1.1.1 實驗動物
30 只SPF 級8 周齡雄性C57BL/6J 小鼠(體重18~22 g)購自南京君科生物科技有限公司[SCXK(蘇)2019-0046]。 小鼠喂養于江西中醫藥大學實驗動物中心[SYXK(贛)2019-0002],在標準SPF級動物房飼養,濕度為40% ~70%,溫度為20 ~22℃,12 h/12 h 光/暗循環。 動物實驗經井岡山大學附屬醫院動物實驗倫理委員會審核批準(JGSH2020016),并嚴格遵循3R 原則。
1.1.2 細胞
小鼠腎小球內皮細胞(mice glomerular endothelial cell,mGEC)購自美國ATCC,維持在含有10% FBS 和1%青霉素/鏈霉素的RPMI-1640 中。
1.2 主要試劑與儀器
Tubastatin A、STZ 購自美國Sigma-Aldrich 公司;尿蛋白、血清尿素氮和血清肌酐商業試劑盒購自南京建成生物工程研究所;DHE 染色劑、RIPA 緩沖液、BCA 蛋白質定量試劑盒購自上海Beyotime 公司;5%白蛋白牛V 購自北京Solarbio 公司;HDAC6、KIM1 兔一抗購自英國Abcam 公司;N-cadherin、Ecadherin、Vimentin、α-SMA、β-actin 兔一抗、抗兔IgG二抗均購自美國Proteintech 公司。
BX-51 光學顯微鏡購自日本Olympus 公司;H7650 顯微鏡購自日本日立公司;蛋白質印跡檢測系統購自美國Bio-Rad Laboratories;CytoFLEX S 流式細胞儀購自美國Beckman 公司。
1.3 實驗方法
1.3.1 動物分組
C57BL/6J 小鼠隨機分為3 組(n=10):對照組、DN 組和Tubastatin A 組。 參照文獻方法[11],對DN組和Tubastatin A 組小鼠進行DN 誘導,具體操作為:在異氟醚麻醉下,小鼠進行包膜下腎切除術以切除右腎。 每天對小鼠腹膜內注射STZ(80 mg/kg),持續3 d。 在STZ 注射后,Tubastatin A 組腹膜內注射Tubastatin A,劑量為30 mg/kg[12],每3 d 注射1 次,連續治療8 周。 對照組和DN 組在相同時間注射等體積DMSO。 對照組接受剖腹手術,但不進行腎切除和腹膜內注射STZ。
1.3.2 生化測量
使用商業試劑盒測量小鼠24 h 尿蛋白、血清尿素氮和血清肌酐。
1.3.3 組織病理學分析
對于蘇木精和伊紅(hematoxylin-eosin,HE)染色,腎組織用10%中性甲醛固定,乙醇梯度脫水,二甲苯透明,石蠟包埋并切片(5 μm)。 然后將切片分別用蘇木精和伊紅染色15 min 和5 min。 對于PAS分析,腎切片首先用高碘酸孵育15 min,然后用希夫溶液染色10 min。 洗滌后,切片用蘇木精復染3 min。 對于Masson 測定,在對腎石蠟切片進行常規脫蠟后,用Masson 三原色染料對切片進行染色。 在BX-51 光學顯微鏡下觀察組織學變化。 從每個腎中隨機選擇20 個腎小球,使用Image J 軟件量化系膜面積和Masson 染色的陽性區域。
1.3.4 RNA 測序分析
8 周后,從DN 組和Tubastatin A 組各取3 只小鼠的腎組織中提取總RNA。 RNA 測序由北京基因組研究所按照標準方案進行。 使用BGISEQ-500 平臺對文庫進行測序。
1.3.5 透射電子顯微鏡(transmission electron microscope,TEM)
對小鼠的腎組織進行TEM 分析。 將腎組織切成1 mm3塊并浸入2.5%戊二醛中。 用0.1 mol/L磷酸沖洗腎組織并用鋨酸固定30 min。 然后將切片脫水并包埋在丙酮中。 50 ~60 nm 切片用3%醋酸鈾-檸檬酸鉛鈉染色,并安裝在銅網格上,在H7650顯微鏡下拍照。 將底片數字化,獲得最終放大倍數約為×23 000 的圖像。 畸形線粒體被定義為具有可見嵴的局灶性喪失、在外周線粒體膜處殘留嵴聚集和碎片化(長度<2 μm)的線粒體。
1.3.6 細胞處理
對于高葡萄糖(high glucose,HG) 處理,將mGEC 細胞暴露于補充有20 mmol/L 和40 mmol/L d-葡萄糖的完全培養基48 h[13]。 用5.5 mmol/L d-葡萄糖或40 mmol/L 甘露醇培養的細胞用作對照。為了考察Tubastatin A 對HG 環境下的mGEC 細胞損傷的改善作用,將細胞以5×104/孔接種于6 孔板中,并分為以下4 組:對照+DMSO 組、對照+Tubastatin A 組、HG +DMSO 組和HG +Tubastatin A組。 對照+DMSO 組加 入40 mmol/L 甘 露 醇 和DMSO 處理細胞48 h;對照+Tubastatin A 組加入40 mmol/L 甘露醇和500 nmol/L Tubastatin A 處理細胞48 h;HG +DMSO 組加入40 mmol/L d-葡萄糖和DMSO 處理細胞48 h;HG+Tubastatin A 組加入40 mmol/L d-葡萄糖和500 nmol/L Tubastatin A 處理細胞48 h。 所有分組一式三份。
1.3.7 ROS 水平檢測
使用線粒體超氧化物指示劑測量mGEC 細胞中的線粒體ROS。 細胞用PBS 洗滌兩次以去除培養基,隨后在5 μmol/L MitoSOX Red 中于37℃孵育10 min,用PBS 洗滌3 次。 然后通過流式細胞術檢測細胞。 使用DHE 染色估計腎組織中的ROS 水平。 將冷凍腎切片在丙酮中浸泡30 min,并在37℃下與DHE(5 μmol/L)一起孵育30 min。 使用BX-51 光學顯微鏡捕獲圖像。
1.3.8 蛋白質印跡分析
使用RIPA 裂解緩沖液提取細胞或腎組織中的總蛋白。 使用BCA 蛋白質定量試劑盒測量蛋白質濃度。 通過十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離蛋白質并轉移到聚偏二氟乙烯膜上。 在室溫下用含5%牛血清白蛋白PBS 液封閉1 h 后,將膜與兔一抗(HDAC6,1 ∶800;N-cadherin、E-cadherin、Vimentin、α-SMA,1 ∶500;KIM1,1 ∶500)在4℃孵育過夜。 然后洗滌膜并與二抗(抗兔IgG,1 ∶3000)在室溫下孵育1.5 h。 抗β-actin 抗體(1 ∶1000)作為對照。 用增強的化學發光試劑觀察蛋白質條帶,并使用蛋白質印跡檢測系統量化信號密度。
1.3.9 流式細胞儀檢測細胞凋亡
通過流式細胞術估計培養細胞的凋亡。 將處理后的細胞加入5 μL Annexin V-FITC,在室溫下避光孵育10 min。 然后加入10 μL 碘化丙啶染色液,冰浴避光放置15 min,隨后使用CytoFLEX S 流式細胞儀進行分析。
1.4 統計學方法
所有數據均使用SPSS 18.0 軟件進行分析,并表示為平均數±標準誤差(±sˉx)。t檢驗用于兩組之間的比較,單因素方差分析(ANOVA)和Tukey 多重比較后檢驗用于3 組或更多組的比較。 以P<0.05 為差異具有統計學意義。
2 結果
2.1 HDAC6 在DN 小鼠的腎組織中上調
為了初步評估HDAC6 在DN 中的潛在參與,首先使用免疫印跡分析顯示DN 小鼠腎組織中HDAC6 的上調,這與腎損傷標志物KIM1 水平升高一致(圖1A、1B)。 在不同濃度葡萄糖(20 mmol/L和40 mmol/L)的mGEC 細胞中,HDAC6 表達也上調,伴隨著KIM1 的表達增加(圖1C、1D)。 這些結果表明HDAC6 表達在DN 腎組織中增加,提示HDAC6 可能參與DN 的發病機制。
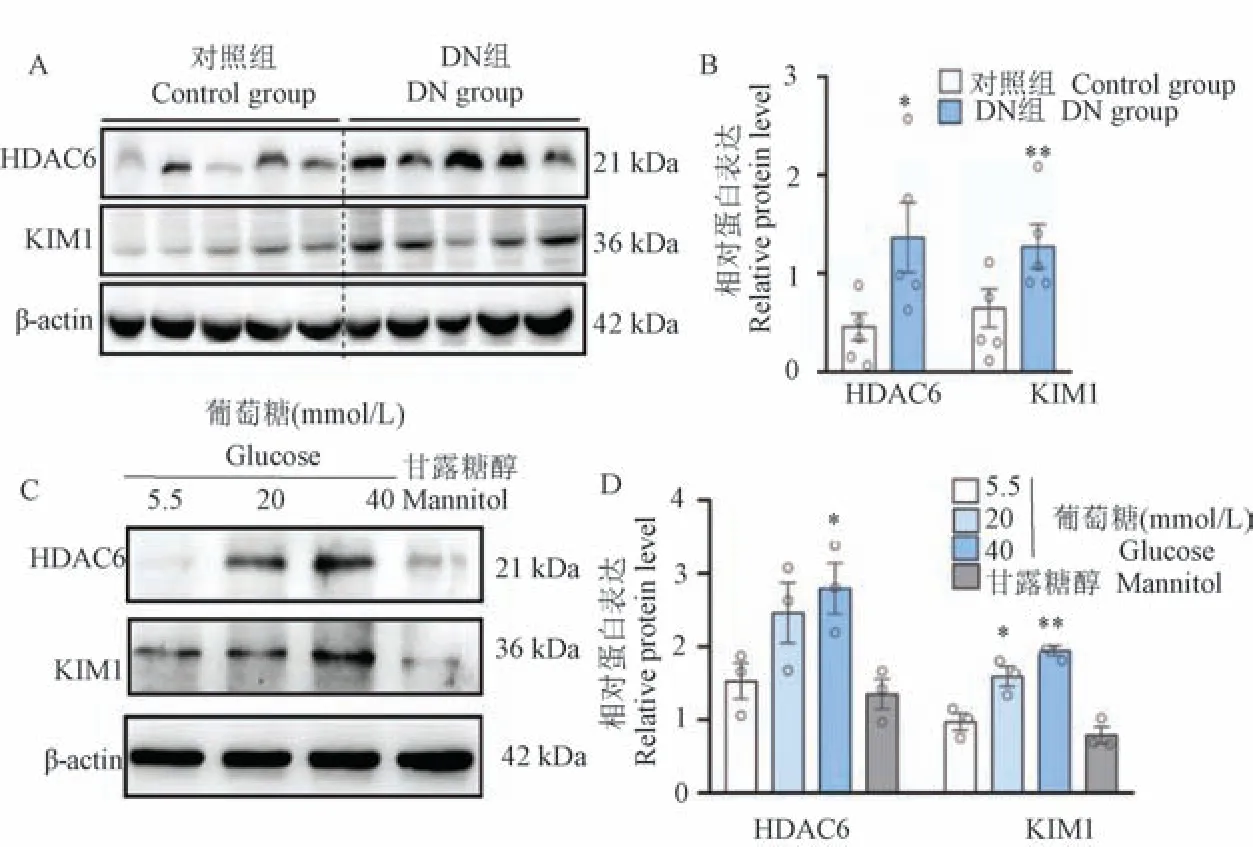
注:A、B:對照組小鼠(n =5)和DN 組小鼠(n =5)腎組織中HDAC6 和KIM-1 表達的蛋白質印跡分析和蛋白相對量。 C、D:用高葡萄糖處理的mGEC 細胞中HDAC6 和KIM-1 的蛋白質印跡分析和蛋白相對量。 與對照組相比, *P<0.05, **P<0.01。圖1 HDAC6 在DN 小鼠的腎組織和高葡萄糖處理的mGEC 細胞中上調Note.A/B, Western blot analysis and optical density quantification of HDAC6 and KIM-1 expression in the kidney tissue of control mice (n=5)and DN group mice (n =5).C/D, Western blot analysis and optical density quantification of HDAC6 and KIM-1 in mGEC cells treated with high glucose quantification.Compared with control group, *P<0.05, **P<0.01.Figure 1 Upregulation of HDAC6 in renal tissue and high glucose treated mGEC cells of DN mice
2.2 Tubastatin A 可減輕DN 中的腎損傷和纖維化
為了進一步評估HDAC6 在DN 進展中的作用,我們向小鼠腹腔注射Tubastatin A 有效降低了腎組織中HDAC6 表達(圖2A、2C)。 HE 和PAS 染色顯示DN 小鼠發生顯著形態學變化,包括腎小球肥大、腎小球系膜基質積聚、腎小球基底膜增厚和腎小管基底膜增厚。 Tubastatin A 治療緩解了這些不良改變(圖2B、2D)。 Masson 染色顯示DN 小鼠出現腎小球和腎小管間質纖維化,Tubastatin A 治療后纖維化程度得到緩解(P<0.05)(圖2E)。 此外,與對照組相比,DN 組腎功能標志物尿蛋白/24 h、血清尿素氮和血清肌酐顯著升高,而Tubastatin A 治療降低了它們的水平(P<0.05)(圖2F ~2H)。 這些數據表明,Tubastatin A 改善了DN 小鼠的腎功能。
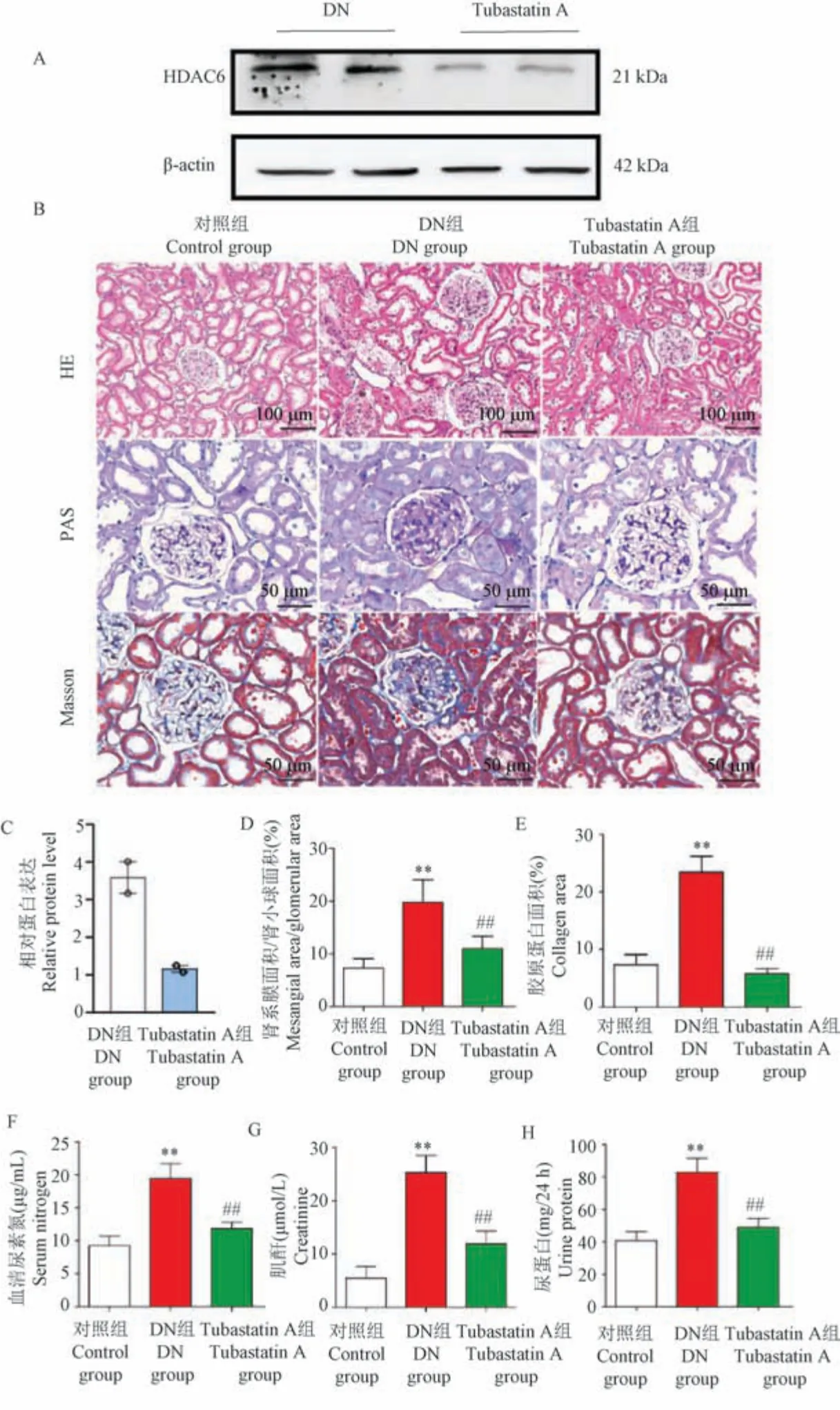
注:A、C:DN 組小鼠(n =5)和Tubastatin A 組小鼠(n =5)腎組織中HDAC6 和KIM-1 表達的蛋白質印跡分析和相對蛋白量;B:對照組小鼠(n =5)、DN 組小鼠(n =5)和Tubastatin A 組小鼠(n =5)腎的HE、PAS 和Masson 染色;D:腎系膜面積/腎小球面積的量化;E:腎膠原蛋白面積的量化;F:血清尿素氮;G:血清肌酐;H:24 h 的尿蛋白。 與對照組相比, **P<0.01;與DN 組相比, ##P<0.01。圖2 Tubastatin A 減輕腎的形態變化并改善腎功能Note.A/C, Protein blot analysis and optical density quantification of HDAC6 and KIM-1 expression in renal tissue kidney tissues of DN group (n =5) and Tubastatin A group (n=5).B, HE, PAS and Masson staining of the kidney in control group (n=5), DN group (n =5) and Tubastatin A group (n =5).D, Quantification of renal tract area/glomerular area.E, Quantification of renal collagen area.F, Serum urea nitrogen.G, Serum creatinine.H, Urine protein at 24 h.Compared with control group, **P<0.01.Compared with DN group, ##P<0.01.Figure 2 Tubastatin A attenuates morphological changes in the kidney and improves renal function
2.3 Tubastatin A 改善HG 環境下的mGEC 細胞損傷和EMT
使用mGEC 進一步證實了HDAC6 參與HG 誘導的腎小球內皮細胞。 與體內數據一致,與對照DMSO 相比,Tubastatin A 在HG 處理下顯著降低了mGEC 細胞中KIM1、HDAC6、α-SMA、N-鈣粘蛋白、波形蛋白表達(P<0.05),并上調E-鈣粘蛋白表達(P<0.05)(圖3)。
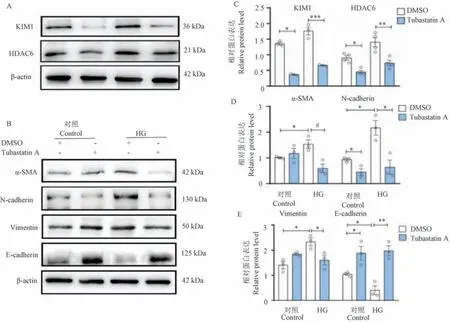
注:A、C:KIM1 和HDAC6 表達的蛋白質印跡分析和相對蛋白量;B、D、E:α-SMA、N-鈣粘蛋白、波形蛋白和E-鈣粘蛋白的蛋白質印跡分析和相對蛋白量。 與Control+DMSO 組相比, #P<0.05;與HG+DMSO 組相比, *P<0.05, **P<0.01, ***P<0.001。圖3 Tubastatin A 改善HG 環境下的mGEC 細胞損傷和EMTNote.A/C, Protein blot analysis and optical density quantification of KIM1 and HDAC6 expression.B/D/E, Protein blot analysis and optical density quantification of α-SMA, N-calcineurin, waveform protein and E-calcineurin.Compared with Control+DMSO group, #P<0.05.Compared with HG+DMSO group, *P<0.05, **P<0.01, ***P<0.001.Figure 3 Tubastatin A ameliorates mGEC cell injury and EMT in HG environment
2.4 Tubastatin A 改善線粒體穩態并減少HG 環境下mGEC 凋亡
TEM 顯示Tubastatin A 組小鼠的腎小球內皮細胞受損線粒體的比例較DN 組顯著降低(P<0.01),表現為線粒體腫脹、內膜和/或外膜斷裂以及線粒體嵴破裂(圖4A、4B)。 此外,DHE 染色顯示Tubastatin A 組小鼠腎組織中ROS 水平較DN 組降低(P<0.01)(圖4C、4D),為了進一步研究HDAC6如何調節HG 誘導的腎小球內皮細胞損傷和EMT進展,我們對DN 組和Tubastatin A 組小鼠的腎進行了轉錄組學分析。 RNA 測序(RNA-seq)揭示了總共1294 個差異表達基因(DEG),包括821 個下調基因和473 個上調基因,I 定義為倍數變化≥2.00,調整后P≤0.001(圖5A)。 基因集富集分析(GSEA)揭示了與DN 組小鼠相比,Tubastatin A 組小鼠腎組織中與ECM-受體相互作用和與三羧酸(TCA)循環相關的基因富集(圖5B、5C),證實了HDAC6 的調節在EMT 過程和線粒體受損中的作用。 在mGEC細胞中,Tubastatin A 處理下調了HG 誘導的mGEC細胞中的線粒體ROS 水平(P<0.01)(圖5D、5E),以及減少了細胞凋亡(P<0.05)(圖5F、5G)。
3 討論
越來越多的研究證實,Tubastatin A 通過抑制HDAC6 表達在許多疾病中發揮保護作用[14],如Chi等[15]報道Tubastatin A 可有效減輕血管緊張素II 誘導的高血壓;Zheng 等[16]發現Tubastatin A 通過改善線粒體功能減輕骨關節炎的進展。 近年來,有學者發現,Tubastatin A 能夠阻止了錯誤折疊的蛋白質聚集體在慢性腎病大鼠模型腎小管上皮細胞中的積累,減輕了蛋白尿的進展,限制了腎小管細胞的死亡和減少了腎小管間質膠原基質的沉積[12]。 此外,最近研究證實,Tubastatin A 抑制腎小管上皮細胞-間充質轉化及腎間質成纖維細胞活化,表明其有希望成為防治腎間質纖維化的新型藥物靶點[17]。 與先前的研究一致,本研究確定了Tubastatin A 對DN小鼠腎損傷的保護作用,提示HDAC6 在調節DN 進展中的關鍵作用。 在HG 條件下,HDAC6 破壞腎小球內皮細胞中的線粒體穩態和誘導了EMT 發生。我們的數據表明,HDAC6 上調是腎小球內皮細胞損傷和EMT 的催化劑,通過Tubastatin A 抑制HDAC6上調,最終減緩了DN 的發展。
近年來腎小球損傷在糖尿病腎病發病機制中的重要性得到強調[18-19]。 據報道,腎小球損傷是DN 進展的獨立預測因子,并且EMT 是腎小球損傷的始動因素之一[20]。 我們的數據表明,HDAC6 表達在DN 小鼠模型的腎組織中顯著上調。 重要的是,通過腹腔注射Tubastatin A 抑制腎組織中HDAC6 表達顯著減弱了STZ 誘導的糖尿病小鼠的腎損傷和纖維化,而且還改善了腎功能(即尿蛋白/24 h、血清尿素氮和血清肌酐顯著降低)。 與體內數據一致,體外結果證實了Tubastatin A 抑制了HG 誘導的mGEC 細胞的EMT 發生,表明Tubastatin A 可能通過減輕EMT 的發生減緩DNDN 的發展。 因此,HDAC6 是DN 腎小球細胞損傷的關鍵調節因子。
腎小球內皮細胞富含線粒體以滿足高代謝能量需求,因此,它們容易受到線粒體生物能量學紊亂的影響[21]。 腎小球內皮細胞線粒體中ATP 產生不足與各種腎疾病有關,包括DN[22]。 越來越多的證據表明,線粒體動力學缺陷和線粒體過度氧化應激是DN 腎小管損傷的主要原因[23]。 因此,目前正在開發許多新的線粒體靶向策略來治療腎疾病[24]。在這項研究中,我們發現Tubastatin A 顯著改善了線粒體形態,同時在HG 條件下降低了線粒體ROS 水平。 因此,HDAC6 的抑制降低了腎小球內皮細胞的凋亡率。 這些數據表明,HDAC6 通過破壞線粒體穩態導致HG 誘導的腎小球內皮細胞凋亡。 先前研究將HDAC6 確定為參與壞死性凋亡和細胞凋亡的候選分子[7]。 據報道HDAC6 通過作用于多種信號通路來調節細胞死亡,例如Rac1 和p53 通路[25]。 本研究擴展了先前的發現,證明了HDAC6 破壞線粒體穩態并導致細胞凋亡,突出了HDAC6 在操縱細胞命運中的多種調節機制。
總之,這項研究表明,Tubastatin A 改善了HG誘導的腎小球內皮細胞損傷和DN 進展,其作用機制與保護線粒體穩態和抑制EMT 發生相關。 這些發現為DN 的治療策略提供新的啟示。 然而,Tubastatin A 通過何種途徑調節線粒體穩態和EMT有待于進一步研究。

