O-GlcNAc轉移酶介導的Kruppel樣因子5 O-GlcNAc糖基化修飾調控細胞周期素D1參與結直腸癌發生、發展實驗研究
彭明沙,黎 爽,周 翼,黃世貴,舒子龍,彭 洪
(川北醫學院附屬南充市中心醫院,四川 南充637000)
結直腸癌(Colorectal cancer,CRC)是消化系統常見惡性腫瘤之一[1]。CRC的標準化治療方案包括手術切除、化療和放療,雖然CRC患者總發病率和病死率正在下降,然而其5年生存率依然低于預期,因為部分患者確診時已經發生遠處轉移[2]。因此揭示CRC發生、發展背后的潛在作用機制,尋找新的診斷和預后生物標志物及治療靶點,就顯得尤為重要。Kruppel樣因子5(Kruppel-like factor 5,KLF5)是一種含有三個鋅指DNA結合結構域的轉錄因子,廣泛表達于各種組織,在腫瘤細胞增殖、凋亡、細胞周期調節、遷移、分化和血管生成方面發揮著重要作用[3-4]。既往研究[5-6]發現,KLF5在CRC中高表達,可促進CRC細胞的增殖并與結直腸癌化療耐藥密切相關。然而KLF5在CRC中發揮促癌作用的具體機制尚不明確。糖基化修飾是重要的蛋白質翻譯后修飾之一,影響蛋白質的功能并調控細胞信號傳導,從而調節各種生物學效應[7]。氧連接N-乙酰葡萄糖胺(O-linked N-acetylglucosamine,O-GlcNAc)糖基化修飾具體表現為僅在蛋白質的絲氨酸/蘇氨酸殘基上加成一個單糖,這種蛋白加工方式能快速、可逆地添加及移除,并與磷酸化修飾競爭性修飾,迅速調節蛋白質的活性和穩定性。O-GlcNAc糖基化修飾幾乎參與了各種細胞代謝途徑和信號轉導通路,在腫瘤和糖尿病等多種疾病中起著非常重要的調節作用[8-9]。但是O-GlcNAc糖基化修飾與CRC發生發展的關系卻報道較少。本研究探討KLF5通過正調控細胞周期素D1(Cyclin D1,CCDN1)促進CRC細胞增殖和細胞進入G1期,以及OGT通過O-GlcNAc糖基化修飾穩定KLF5并上調CCND1表達參與CRC發生、發展的作用機制,以期為CRC的治療提供新的作用靶點。
1 材料與方法
1.1 實驗細胞 FHC(批號:BFN607201253)、SW620(批號:TCHu101)、SW480(批號:TCHu172)和DLD-1(批號:TCHu134)細胞株購自中國科學院細胞庫。FHC和DLD-1在含有10% FBS的1640培養基中培養。SW620和SW480在Leibovitz’s L-15培養基中培養。培養箱溫度為37 ℃,并含有5% CO2。
1.2 主要試劑 1640培養基和L-15培養基(批號:61870036、MD06)購自Gibco公司;Lipofectamine 3000(批號:L3000-001)購自Invitrogen公司;CCK8試劑(批號:CK04)購自Dojindo公司;RNAprep試劑盒(批號:DP441)購自Tiangen公司;HiScript Ⅲ RT Super Mix(批號:R333-01)購自Vazyme公司;SYBR Green(批號:Q111-02)購自Vazyme公司;蛋白酶抑制劑 Cocktail(批號:HY-K0010)購自MCE公司;KLF5抗體(批號:ab137676)購自Abcam公司;山羊抗兔IgG(批號:ab150077)購自Abcam公司;O-GlcNAc一抗(批號:MAB16475)購自Abnova公司。
1.3 生物信息學分析 通過GEPIA2數據庫(http://gepia2.cancer-pku.cn/#index)分析CRC組織中KLF5表達,通過UALCAN portal數據庫(http://ualcan.path.uab.edu/analysis-prot.html)分析CRC組織中OGT表達,并通過UALCAN分析CRC組織中OGT和KLF5蛋白的表達水平。使用GEPIA2數據庫分析OGT與KLF5以及KLF5與CCND1表達的相關性。通過TRRUST數據庫(https://www.grnpedia.org/trrust/)分析KLF5可能的靶基因,進一步通過JASPAR網站查詢CCND1啟動子區與轉錄因子KLF5可能的結合位點。通過YinOYang-1.2(https://services.healthtech.dtu.dk/service.php?YinOYang-1.2)和GlyGen 數據庫(https://www.glygen.org/)分析KLF5蛋白上可能的O-GlcNAc糖基化位點。
1.4 實驗方法
1.4.1 細胞培養與轉染:由Gene Pharma(中國上海)合成并構建KLF5 siRNA,CCND1過表達載體(OE-CCND1)和KLF5過表達載體(OE-KLF5),用Lipofectamine 3000將其轉染到CRC細胞中。KLF5 siRNA序列為5’-GCAGAGAUGCUCCAGAAUUTT-3’。
1.4.2 CCK-8實驗:將處理好的細胞以3×103個/孔的密度接種于96孔板。在24、48、72 h加入CCK-8溶液(10 μl/孔),孵育2 h后在450 nm處測量每個孔的吸光度。分析KLF5對SW620細胞增殖的影響時分為陰性對照組、空白對照組(不進行處理)和KLF5 siRNA組(轉染KLF5 siRNA);分析過表達CCND1對SW620細胞增殖的影響時分為陰性對照組、空白對照組(不進行處理)、KLF5 siRNA組(轉染KLF5 siRNA)和KLF5 siRNA+CCND1過表達組(同時轉染KLF5 siRNA和OE-CCND1)。
1.4.3 實時熒光定量 PCR (RT-qPCR) 實驗:收集處理好的細胞,使用RNAprep試劑盒提取總RNA。使用HiScript Ⅲ RT Super Mix將總RNA反轉錄為cDNA。使用SYBR Green分析目標mRNA的相對表達水平。各組mRNA的相對表達水平通過2-ΔΔCt法進行計算。KLF5正向引物序列為5’-CCTGGTCCAGACAAGATGTGA-3’,反向引物序列為5’-GAACTGGTCTACGACTGAGGC-3’。CCND1正向引物序列為5’-TTCCTGTCCTACTACCGC-3’,反向引物序列為5’-CTCCTCCTCTTCCTCCTC-3’。 分析OGT對SW620細胞CCND1表達的影響時分為空白對照組(不進行處理)、陰性對照組、OGT抑制組(轉染OGT siRNA)和OGT抑制+ KLF5過表達組(同時轉染OGT siRNA和OE-KLF5)。
1.4.4 蛋白免疫印跡(Western blot)實驗:收集處理好的細胞(密度為80%),加入蛋白酶抑制劑Cocktail和RIPA裂解液提取細胞總蛋白。使用BCA蛋白質測定試劑盒定量分析蛋白濃度。分離蛋白質并轉移至PVDF膜。室溫下用KLF5抗體孵育膜1 h,再用山羊抗兔IgG在室溫下孵育2 h。使用ECL化學發光劑對膜進行可視化,蛋白質在凝膠成像儀(Bio-Rad)上進行顯影。
1.4.5 免疫熒光實驗:處理好的細胞接種在培養皿上,使用4%多聚甲醛固定20 min后加入含Triton X-100(0.5%)的PBS滲透5 min,再加入含3% BSA的PBS液封閉1 h。將細胞與O-GlcNAc一抗在4 ℃下孵育過夜。然后加入FITC標記的山羊抗兔IgG(2 μg/ml)在37 ℃下與細胞孵育1 h,然后用DAPI與細胞室溫孵育5 min。使用FV-10 ASW 1.7 Viewer圖像分析軟件處理圖片,使用共聚焦激光掃描顯微鏡FV-3000分析熒光。
1.4.6 流式細胞儀檢測細胞周期:將處理好的細胞以1×105個/孔的密度接種在24孔板中。孵育24 h后,移除培養基并用新鮮培養基替換,48 h收獲細胞并重新懸浮在PBS緩沖液中。用碘化丙啶(PI)對細胞進行染色。分析G0/G1期、S期和G2/M期的細胞百分比。分析KLF5對SW620細胞周期的影響時分為陰性對照組、空白對照組(不進行處理)和KLF5 siRNA組(轉染KLF5 siRNA);分析過表達CCND1對SW620細胞周期的影響時分為陰性對照組、空白對照組(不進行處理)、KLF5 siRNA組(轉染KLF5 siRNA)和KLF5 siRNA+CCND1過表達組(同時轉染KLF5 siRNA和OE-CCND1)。
1.4.7 熒光素酶報告實驗:CRC細胞在24孔板中培養,將熒光素酶報告基因載體pGL3-CCND1或熒光素酶報告基因缺失突變載體pGL3-CCND1-DM與pCMV-Myc-KLF5過表達載體或pCMV-Myc質粒及內參質粒pRL-TK共轉染至細胞,設定熒光素酶報告基因載體、pCMV-Myc-KLF5過表達載體與內參質粒pRL-TK轉染比例為50∶50∶1。孵育48 h后,使用Dual Luciferase Reporter Assay System測量熒光素酶活性。
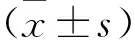
2 結 果
2.1 各細胞中KLF5 mRNA表達情況 GEPIA2和UALCAN portal數據庫顯示,KLF5 mRNA和蛋白在CRC中均為高表達。RT-qPCR結果顯示,FHC、SW620、SW480和DLD-1細胞中KLF5 mRNA相對表達量依次為0.997±0.055、1.843±0.061、2.070±0.046和1.553±0.112。與正常結直腸黏膜細胞株FHC比較,SW620、SW480和DLD-1細胞株中KLF5 mRNA相對表達量明顯增高(均P<0.05)。既往研究[5]發現KLF5在SW620細胞中穩定表達,所以后續實驗選擇SW620細胞。
2.2 KLF5對SW620細胞增殖的影響 見圖1。CCK-8實驗結果表明,與陰性對照組和空白對照組比較,KLF5 siRNA組細胞增殖活性明顯降低(P<0.05)。

注:與KLF5 siRNA組比較,*P<0.05
2.3 KLF5對SW620細胞周期的影響 見圖2。流式細胞儀分析結果顯示,與空白對照組和陰性對照組相比,KLF5 siRNA組G1期細胞比例明顯增高(P<0.05)。

注:與KLF5 siRNA組比較,*P<0.05
2.4 KLF5靶基因篩選及熒光素酶報告實驗結果 通過TRRUST數據庫分析KLF5可能的靶基因,發現CCND1是KLF5可能的靶基因,并且KLF5可正調控CCND1表達。進一步通過JASPAR網站查詢CCND1啟動子區與轉錄因子KLF5可能的結合位點,發現兩者有多個結合位點。因為評分越高,兩者結合的可能性越大,所以后續實驗我們選擇評分最高的結合位點“CCCCCGCCCC”進行研究。為進一步驗證KLF5對CCND1基因轉錄的調控作用及作用位點,本研究分別合成了熒光素酶報告基因載體pGL3-CCND1與熒光素酶報告基因缺失突變載體pGL3-CCND1-DM。將pGL3-CCND1或pGL3-CCND1-DM與pCMV-Myc-KLF5過表達載體及內參質粒pRL-TK共轉染至SW620細胞,轉染48 h后測定熒光素酶活性。結果顯示,與共轉染pCMV-Myc空載體對照組比較,過表達KLF5可以上調CCND1熒光素酶報告基因活性(1.001±0.05與1.856±0.092,t=-12.455,P=0.000)。將KLF5結合位點“CCCCCGCCCC”缺失后,CCND1熒光素酶報告基因活性降低(1.856±0.092與1.340±0.086,t=7.118,P=0.002),說明KLF5能夠通過結合“CCCCCGCCCC”促進CCND1表達。
2.5 KLF5對SW620細胞CCND1表達的影響 通過RT-qPCR分析KLF5對CCND1表達的調控作用,結果表明與空白對照組(1.001±0.080)和陰性對照組(1.040±0.098)比較,KLF5 siRNA組CCND1表達水平(0.615±0.023)明顯降低(t=7.939、7.275,P=0.001、0.002),證實KLF5可正調控CCND1表達。
2.6 過表達CCND1對SW620細胞增殖及細胞周期的影響 見圖3。與KLF5 siRNA組比較,KLF5 siRNA+CCND1過表達組細胞增殖水平增高,細胞G1期比例降低(均P<0.05)。

注:與KLF5 siRNA組比較,*P<0.05
2.7 OGT對SW620細胞O-GlcNAc和KLF5蛋白表達的影響 見圖4、5。YinOYang-1.2和GlyGen數據庫分析結果表明KLF5蛋白Thr159位點進行O-GlcNAc糖基化修飾可能性最大。UALCAN數據庫分析結果表明OGT mRNA和蛋白在CRC組織中的表達水平較癌旁正常組織明顯增高(均P<0.05)。GEPIA2數據庫分析結果提示OGT和KLF5表達呈正相關(r=0.15,P=0.0051)。為進一步觀察OGT對SW620細胞O-GlcNAc和KLF5蛋白表達的影響,設立空白對照組、陰性對照組和OGT抑制(添加20 μmol/L OSMI-1)組,處理48 h后Western blot檢測KLF5蛋白表達,免疫熒光化學觀察O-GlcNAc糖基化蛋白表達,結果表明OGT抑制組O-GlcNAc糖基化蛋白水平和KLF5蛋白水平均明顯降低(均P<0.05)。

圖4 OGT對SW620細胞KLF5蛋白表達的影響

圖5 OGT對O-GlcNAc糖基化蛋白水平的影響(免疫熒光染色,×200)
2.8 O-GlcNAc糖基化修飾對KLF5蛋白穩定性的影響 見圖6。蛋白質半衰期指蛋白降解為原有一半所需的時間,是衡量蛋白質穩定性的關鍵參數,蛋白質半衰期越短蛋白質穩定性越低。主要采用可有效抑制蛋白質合成的放線菌酮(CHX)處理細胞并每隔一段時間檢測蛋白含量以得到半衰期。本研究分DMSO組和OSMI-1組,分別用DMSO和OSMI-1處理SW620細胞,OSMI-1處理48 h后用50 μm的放線菌酮處理1、2、4、6、8 h并檢測KLF5蛋白的表達。結果表明OSMI-1處理后,KLF5在CHX處理4 h后蛋白達到半衰期,而OSMI-1未處理的SW620細胞在放線菌酮處理8 h后KLF5蛋白才基本達到半衰期。

圖6 O-GlcNAc糖基化修飾對KLF5蛋白穩定性的影響
2.9 OGT對SW620細胞CCND1表達的影響 與空白對照組(1.003±0.043)和陰性對照組(1.051±0.109)比較,OGT抑制組中CCND1表達(0.593±0.024)明顯降低(t=7.094、14.476,P=0.002、0.000),但是與OGT抑制組比較,OGT抑制+ KLF5過表達組CCND1表達(0.737±0.051)則增高(t=4.399,P=0.012)。
3 討 論
CRC是全球常見的惡性腫瘤之一。研究[10]表明,細胞周期失調在CRC的發生和發展中起著重要作用。然而CRC進展過程中的具體分子作用機制和關鍵通路之間的調控關系尚不明確,因此對于促進CRC增殖和轉移的分子機制仍需進一步研究。
KLF5是一種干細胞相關轉錄因子,在腫瘤細胞增殖、存活、凋亡和化療藥物敏感性方面發揮著重要作用[11]。通過生物信息學分析我們發現KLF5 mRNA和蛋白在CRC中均為高表達,同時KLF5在CRC細胞株中的表達水平也明顯增高,并且KLF5可促進CRC SW620細胞增殖和促進細胞周期由G1期向S期轉化,證實KLF5在CRC中扮演著癌基因的角色。通過TRRUST數據庫我們篩選了KLF5可能的靶基因,發現KLF5可正調控CCND1的表達,通過JASPAR網站發現CCND1啟動子區與轉錄因子KLF5有多個結合位點。CCND1屬于高度保守的細胞周期家族,在多種惡性腫瘤中高表達,包括CRC[12-13]。CCND1可結合并激活 G1期特有的周期蛋白依賴性激酶CDK4,從而推動細胞周期由G1期進入S期并促進細胞增殖[14]。熒光素酶實驗結果表明,KLF5可與CCND1靶向結合,并且抑制KLF5的表達后可明顯下調CCND1的表達水平,表明KLF5與CCND1屬于正調控關系。進一步的拯救實驗表明,與空白對照組和陰性對照組比較,KLF5 siRNA組SW620細胞增殖活性降低,G1期比例明顯增高,但是和KLF5 siRNA組相比KLF5 siRNA+CCND1過表達組SW620細胞增殖活性和G1期比例有所降低,說明過表達CCND1可逆轉沉默KLF5對CRC細胞增殖活性的抑制和細胞周期G1期的阻滯作用,證實KLF5通過上調CCND1增強細胞增殖活性及促進細胞周期由G1期向S期轉化。
為探尋調控KLF5蛋白表達的上游機制,我們通過YinOYang-1.2和GlyGen數據庫對KLF5蛋白上可能的O-GlcNAc糖基化位點進行預測,發現KLF5蛋白Thr159位點進行O-GlcNAc糖基化修飾可能性最大。O-GlcNAc糖基化修飾異常是腫瘤細胞新的重要特征之一,O-GlcNAc糖基化修飾作為一種營養感受器,能夠對腫瘤細胞代謝進行調控并影響腫瘤細胞的增殖[15-16]。O-GlcNAc糖基化修飾由O-GlcNAc轉移酶(OGT)負責催化,O-GlcNAc水解酶負責水解[17]。OGT通過O-GlcNAc糖基化修飾相關蛋白質從而參與細胞信號轉導、轉錄調節、細胞分化及蛋白質的翻譯和降解等[18]。既往研究[19]發現,OGT在多種惡性腫瘤中高表達并導致腫瘤細胞相關蛋白O-GlcNAc糖基化水平明顯增高。并且O-GlcNAc糖基化與磷酸化及泛素化存在競爭和依賴共存的關系,因此O-GlcNAc糖基化與泛素化的競爭關系使得O-GlcNAc糖基化修飾可增強蛋白質的穩定性[20-21]。通過生物信息學分析我們發現CRC組織中OGT mRNA和蛋白的表達水平均明顯增高,并且OGT和KLF5的表達呈正相關。不僅如此,抑制OGT表達后O-GlcNAc糖基化蛋白水平和KLF5蛋白水平均明顯降低,因此推斷O-GlcNAc糖基化可能影響KLF5蛋白的穩定性。本研究進一步檢測了KLF5蛋白的半衰期,結果發現抑制OGT表達后KLF5蛋白在4 h時達到半衰期,而未抑制OGT表達的SW620細胞KLF5蛋白在8 h達到半衰期,說明抑制OGT表達使得O-GlcNAc糖基化水平降低,導致細胞內KLF5蛋白的穩定性降低,KLF5蛋白的表達水平也明顯降低。最后,拯救實驗結果表明OGT抑制組中CCND1表達水平較空白對照組和陰性對照組明顯降低,但是與OGT抑制組相比,OGT抑制組+KLF5過表達組中CCND1表達水平則有所增高,說明過表達KLF5可逆轉抑制OGT對CCND1表達的下調作用,證實OGT通過O-GlcNAc糖基化修飾上調KLF5表達并促進CCND1表達。
綜上所述,KLF5可正調控CCND1轉錄,CCND1過表達可促進CRC細胞增殖和細胞周期由G1期向S期轉化,而OGT通過O-GlcNAc糖基化修飾上調KLF5表達并最終增強CCND1表達水平,從而參與CRC發生、發展。本研究為CRC的發病提供了新的見解,并為CRC的防治提供了新的作用靶點,但是還需要更深入的體內和體外研究對本結論進行驗證。

