骨髓間充質干細胞來源外泌體對大鼠脊髓損傷的改善作用及對脊髓組織胞漿型磷脂酶A2、水通道蛋白4和水通道蛋白9的影響實驗研究
唐 劍,陳雙華,何 凌
(1.南充市高坪區人民醫院神經外科,四川 南充 637100;2.南充市中心醫院嘉陵院區內二科,四川 南充 637500)
脊髓損傷(Spinal cord injury,SCI)是一種中樞神經系統的嚴重創傷,損傷后數小時至數天內會出現復雜的繼發性損傷,如脊髓局部水腫、炎癥反應、缺血缺氧、脂質過氧化等,這些因素使多種信號通路的級聯反應被激活,擴大了原發性損傷的范圍和程度[1]。一般認為繼發性損傷若治療及時是可逆的。骨髓間充質干細胞(Bone marrow stromal cells,BMSCs)移植成為治療SCI最有希望的方法之一[2]。BMSCs可直接分化、替代脊髓損傷組織,分泌細胞因子、生長因子等介質,幫助傷口修復和血管生成,同時分泌大量外泌體,這些外泌體對炎癥部位有被動靶向性,能激活內源性修復機制,起到促進神經生長的作用[3-4]。相關研究證實,脊髓損傷后水通道蛋白(Aquaporin,AQP)表達增加,引起脊髓水腫,脊髓壓力持續升高,使脊髓微循環出現異常,加重SCI[5]。而胞漿型磷脂酶A2(Cytosolic phospholipase A2,cPLA2)則是影響繼發性炎癥反應和細胞凋亡等多種關鍵機制的重要分子[6]。基于此,本研究探討BMSCs來源外泌體對大鼠SCI的改善作用及對脊髓組織cPLA2、AQP4及AQP9的影響,為BMSCs來源外泌體的臨床應用提供理論依據。
1 材料與方法
1.1 實驗細胞和動物 骨髓間充質干細胞(貨號:A01X1663)購買于上海撫生實業有限公司。雄性SD大鼠30只,SPF級,體重180~200 g,購于西安交通大學實驗動物中心。動物飼養條件:溫度設定為20~23 ℃,濕度設定為60%~70%,明暗各12 h,正常飲水和攝食。
1.2 主要試劑 完全DMEM/F12培養基(貨號:KGM12500S-500)購自江蘇凱基生物技術股份有限公司;外泌體提取試劑盒、DAB顯色試劑盒、反轉錄試劑盒(貨號:39013-50T、3503-100T、D1801XL)購自上海雅吉生物科技有限公司;BCA蛋白濃度測定試劑盒、PBS緩沖液(貨號:R21250、R22379)購自上海源葉生物科技有限公司;RIPA蛋白裂解液、總RNA提取、TRIzol試劑(貨號:LM3201-1、LM-21087R、LM0016)購自上海聯邁生物工程有限公司;HE染色試劑盒、原位末端脫氧核苷酸轉移酶標記法(TUNEL)細胞凋亡檢測試劑盒(貨號:FS-10-17869、FS-79507)購自上海撫生實業有限公司。
1.3 實驗方法
1.3.1 BMSCs培養:細胞復蘇后用含10%胎牛血清、1%青-鏈霉素的完全DMEM/ F12培養基培養,將其混勻,并于培養瓶中按1×109個/L密度進行接種,每2天后換液,鏡下觀察細胞生長狀態,當細胞生長至80%~90%融合度時,按1∶2比例進行傳代。
1.3.2 外泌體提取與鑒定:取生長良好的第3代BMSCs,以10%不含外泌體的DMEM /F12培養基培養BMSCs 24 h,培養至70%~80%融合時收取培養基,參照說明書使用外泌體提取試劑盒提取外泌體,重懸于PBS中,透射電鏡觀察BMSCs外泌體形態,BCA蛋白濃度測定試劑盒檢測外泌體蛋白含量,Western blot法對外泌體特異表面標志物CD63和Alix的表達進行測定。
1.3.3 大鼠分組與模型制備:將大鼠隨機分為假手術組、模型組和外泌體組,每組10只。術前禁食6 h后,以1%戊巴比妥鈉50 mg/kg麻醉,術區消毒,選擇T10為中心,作一2.5 cm正中切口,充分暴露T9至T11節段,利用咬骨鉗將T10棘突和椎板去除,注意硬膜完整。假手術組逐層縫合切口,模型組和外泌體組依次用打器擊打T10,若損傷后局部迅速充血水腫,且雙后肢抽搐,尾巴擺動,則為造模成功。外泌體組造模成功30 min后,予以尾靜脈注射200 μl外泌體,假手術組及模型組大鼠尾靜脈注射等體積PBS。各組大鼠每隔2 d注射1次,共注射3次,術后人工輔助大鼠排尿,3次/d,直至其可自主排尿。
1.3.4 大鼠脊髓損傷行為學(BBB)評分[7]:干預前及干預后3、7 d進行BBB評分。使待測大鼠在空曠平地上自由活動5 min,仔細觀察關節、運動、踩踏和協調性。每只大鼠測試3次,取平均值,無肢體運動或體質量支持為0分,正常運動為21分。
1.3.5 大鼠脊髓組織HE染色:干預7 d后,各組隨機取3只大鼠,以1%戊巴比妥鈉50 mg/kg進行腹腔注射麻醉,固定后剪開腹腔,并暴露心臟部位,將灌注針刺入主動脈內,剪開右心耳后灌注0.9%氯化鈉溶液。當右心耳有透明液體流出時即可停止,再行4%多聚甲醛灌注至四肢僵硬,于T10損傷處取1 cm脊髓組織,經脫水、透明、浸蠟、包埋及切片等后HE染色再封片,光學顯微鏡下觀察脊髓組織變化。
1.3.6 脊髓神經細胞凋亡檢測:將脊髓組織石蠟切片先脫蠟和水化,再用PBS緩沖液沖洗2次,蛋白酶K處理15 min,2% H2O2處理5 min,經PBS沖洗2次,加TUNEL反應液37 ℃避光30 min,PBS清洗3次后,DAB顯色,蘇木精復染后封片干燥。每張切片隨機取5個視野,熒光顯微鏡下觀察,陽性細胞為綠色。
1.3.7 脊髓組織cPLA2、AQP4、AQP9 mRNA表達檢測:采用實時熒光定量PCR(RT-qPCR)檢測。取大鼠脊髓組織,研磨破碎,總RNA以TRIzol法提取,并取2 μg RNA反轉錄后并擴增(常規條件)獲取產物。經PCR反應40個循環后,將擴增產物凝膠電泳,用凝膠成像儀獲取圖片,內參為GAPDH,以2-ΔΔCt法對樣本基因進行表達差異相對定量分析。各基因引物序列見表1。

表1 各基因引物序列
1.3.8 脊髓組織cPLA2、AQP4、AQP9蛋白表達檢測:采用Western blot檢測。取大鼠脊髓組織放入RIPA裂解液中,12000 r/min離心10 min后取上清液,BCA檢測蛋白濃度,蛋白上樣10 μg電泳。將電泳分離得到的樣本移到PVDF膜上固定,并封閉1 h(10%山羊血清),一抗孵育過夜(4 ℃)后加二抗孵育(常溫)1 h。以GAPDH為內參,經洗膜、顯色后成像拍照,做灰度值分析。
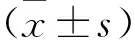
2 結 果
2.1 BMSCs形態 見圖1。倒置顯微鏡下可見傳代細胞呈均勻分布,生長迅速,3~4 d可鋪滿瓶壁,細胞多呈梭形,生長狀態良好。

圖1 培養第4天(左)及培養至第3代(右)
2.2 外泌體鑒定 見圖2。透射電鏡下可見BMSCs外泌體直徑40~110 nm,呈圓形、橢圓形或“茶托樣”囊泡結構,大小不均,膜結構完整。Western blot檢測BMSCs外泌體表面標志蛋白CD63、Alix,結果呈陽性。

圖2 BMSCs外泌體電鏡下結構(×200,左)
2.3 各組大鼠BBB評分比較 見表2。干預前后假手術組BBB評分比較,以及干預前模型組與外泌體組BBB評分比較,無統計學差異(均P>0.05)。干預后3、7 d,外泌體組BBB評分高于模型組(均P<0.05)。

表2 各組大鼠BBB評分比較(分)
2.4 各組大鼠脊髓組織HE染色結果比較 見圖3。假手術組脊髓組織無損傷壞死及出血,結構完整,細胞排列有序,細胞核形態正常。模型組大鼠脊髓結構紊亂,大量炎性細胞浸潤,伴有囊性腔和空泡,神經元和細胞水腫,神經元數量明顯減少。外泌體組脊髓損傷區組織結構紊亂和炎性細胞浸潤減輕,脊髓空洞小,損傷恢復較好。

圖3 各組大鼠脊髓組織HE染色結果(×400)
2.5 各組大鼠脊髓組織細胞凋亡情況比較 見圖4。假手術組脊髓組織凋亡細胞較少。模型組細胞凋亡率較假手術組、外泌體組高,而外泌體組細胞凋亡率低于模型組(均P<0.05)。

注:左圖為各組大鼠脊髓組織TUNEL染色結果(×400)。右圖中,與假手術組比較,*P<0.05;與模型組比較,#P<0.05
2.6 各組大鼠脊髓組織cPLA2、AQP4、AQP9 mRNA表達比較 見圖5。模型組脊髓組織cPLA2、AQP4、AQP9 mRNA表達高于假手術組,而外泌體組cPLA2、AQP4、AQP9 mRNA低于模型組(均P<0.05)。

注:與假手術組比較,*P<0.05;與模型組比較,#P<0.05
2.7 各組大鼠脊髓組織cPLA2、AQP4、AQP9蛋白表達比較 見圖6。模型組脊髓組織cPLA2、AQP4以及AQP9 蛋白表達高于假手術組,而外泌體組cPLA2、AQP4以及AQP9蛋白表達低于模型組(均P<0.05)。

注:上圖為各組大鼠脊髓組織cPLA2、AQP4、AQP9蛋白電泳結果。下圖中,與假手術組比較,*P<0.05;與模型組比較,#P<0.05
3 討 論
SCI是臨床上常見的創傷性疾病,多由高能量作用引起,但在特定人群如老年人,也可由低能量損傷引起,易造成暫時或永久性的感覺喪失,引起運動功能障礙[8]。現階段,相比于間充質干細胞移植治療,BMSCs外泌體顯示出良好的治療潛力,有較高的安全性、更低的免疫原性和無成瘤性等優勢,進入損傷部位后能通過旁分泌機制發揮作用[9-10]。本實驗通過Allen法制作SCI大鼠模型,并提取鑒定BMSCs外泌體用于大鼠尾靜脈注射治療,透射電鏡下可見BMSCs外泌體直徑40~110 nm,呈圓形、橢圓形或“茶托樣”囊泡結構,大小不均,膜結構完整,Western blot檢測BMSCs外泌體表面標志蛋白CD63、Alix呈陽性表達。本研究中,模型組大鼠脊髓結構紊亂,大量炎性細胞浸潤,伴有囊性腔和空泡,神經元和細胞水腫,神經元數量明顯減少。經BMSCs外泌體干預后,上述病理變化顯著減輕,外泌體組干預后BBB 評分高于模型組。推測外泌體有可能通過BMSCs外泌體抑制A1型神經毒性反應性星形膠質細胞活化發揮對神經元的保護效應,也可能通過抑制膠質瘢痕的形成使軸突和髓鞘的再生,最終使運動功能得以改善[11-12]。
脊髓水腫是SCI的重要病理生理學基礎,在AQP1、AQP4、AQP9這3種水通道蛋白中,AQP4對SCI后脊髓水腫影響最大,其次是AQP9[13-14]。相關研究[15]表明,脊髓損傷部位AQP4表達減少后,脊髓灰質后角深層的滲透膨脹率隨之下降,脊髓水腫也明顯減輕。姚海華等[16]報道,前列腺素E2是cPLA2初始產物,其對炎癥反應有促進作用,腦脊髓炎小鼠損傷的間隙中存在前列腺素E2表達,另外cPLA2被激活后細胞膜會代謝生成溶血磷脂并進一步轉化為血小板活化因子,激活小膠質或免疫細胞分泌生長因子和黏附分子引起內皮損害,使細胞膜通透性增加,脆性提高,線粒體數量減少,染色質固縮、斷裂,最終誘導細胞凋亡[17]。本研究中,模型組細胞凋亡率高于假手術組,而外泌體組細胞凋亡率低于模型組;模型組脊髓組織cPLA2、AQP4、AQP9 mRNA及蛋白表達高于假手術組,而外泌體組脊髓組織cPLA2、AQP4、AQP9 mRNA及蛋白表達低于模型組。提示SCI后,脊髓中細胞大量凋亡,AQP4與AQP9很可能參與了脊髓水腫和炎癥反應,BMSCs外泌體注射后,cPLA2、AQP4、AQP9 mRNA及蛋白表達顯著下降,細胞凋亡減少。其作用機制可能是靜脈注射BMSCs外泌體可快速到達脊髓損傷區,通過M2型巨噬細胞特異性結合促使M2活化并分泌抗炎因子,對損傷區免疫反應產生調節,此過程中Wnt/β-catenin、核因子(NF)-κB等信號通路也被激活,使水腫和細胞凋亡減輕[18-19]。曾歡歡等[20]觀察SCI后大鼠脊髓組織水含量發現,術后3 d模型組脊髓組織含水量較假手術組增高,大黃素中、高劑量組脊髓組織含水量低于模型組;模型組AQP4 mRNA較假手術組升高,大黃素低、中、高劑量組AQP4、基質金屬蛋白酶(MMP)-2 mRNA均低于模型組。陳勇等[21]證實,與假手術組比較,AQP4、AQP9在SCI組大鼠脊髓組織的表達升高,經β-七葉皂甙鈉治療后,SCI大鼠脊髓組織AQP4、AQP9蛋白表達下降。但BMSCs外泌體能否通過調控cPLA2、AQP4、AQP9表達對中樞神經系統產生保護作用仍需進一步研究證實。
綜上所述,BMSCs來源外泌體對脊髓損傷有一定改善作用,可下調cPLA2、AQP4、AQP9 mRNA及蛋白的表達,但其具體作用機制尚需進一步研究。

