包被siRNA的葉酸改性聚乙二醇1000維生素E琥珀酸酯納米材料的制備及其表征
朱嫚嫚,程 勇,饒 鵬,張貴陽,劉 昊,肖 雷,劉加濤,
利用RNA干擾(RNA interference,RNAi)的新興療法能夠選擇性沉默目標基因,精準調控信號通路[1],常用于癌癥、遺傳性疾病和病毒感染等疾病的治療。但小干擾RNA(siRNA)為帶有陰電荷的水溶性大分子,易被清除,體內生物利用率低。此外,siRNA還具有易被酶解,跨膜吸收差,并可通過與Toll樣受體的相互作用誘發機體不良反應等缺點[2-3]。因此,為將siRNA運送至特定的靶器官甚至是靶細胞并發揮特異性調控作用,常需對siRNA進行特定修飾。近年來,以毒性和免疫原性低的納米載體作為siRNA遞送系統成為研究熱點。維生素E聚乙二醇1000琥珀酸酯(D-α-tocopheryl polyethylene glycol 1000 succinate,TPGS)載體同時具有親水和疏水性基團,可顯著提高siRNA穩定性和滲透性[4]。此外,活化巨噬細胞表面表達大量葉酸受體[5]。因此,以葉酸修飾TPGS作為載體,通過交聯作用構建包裹X-框結合蛋白1(X-box binding protein 1,XBP1)siRNA的葉酸改性聚乙二醇1000維生素E琥珀酸酯(folic acid modified TPGS, FA-TPGS)復合物并對其進行表征鑒定,觀察其安全性和對內質網應激關鍵轉錄因子XBP1s的敲降作用,以期為探究XBP1s在巨噬細胞表型和功能轉化中的作用并為靶向內質網應激的疾病治療提供新的思路。
1 材料與方法
1.1 主要試劑與儀器羅丹明B異硫氰酸酯、乙二胺、葉酸均購自美國Sigma-Aldrich公司; NaHCO3和硫酸鎂粉末均購自上海碧云天有限公司;TPGS和N-羥基琥珀酰亞胺(N-Hydroxysuccinimide,NHS)均購自上海麥克林試劑公司;對甲苯磺酰氯(p-Toluene Sulfonyl Chloride,PTSC)、二氯甲烷、三乙胺、N,N-二甲基甲酰胺(N, N-Dimethylformamide,DMF)、1-乙基-(3-二甲基氨基丙基)碳二亞胺鹽酸[N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochl-oride,CDC]和1,4二氧六環均購自上海阿拉丁試劑公司。
細胞培養用胎牛血清(fetal bovine serum,FBS)和DMEM高糖基礎培養基均購自美國Gibco公司;青-鏈霉素、DAPI 染核液均購自上海碧云天有限公司;山羊抗兔蛋白激酶小鼠抗β-actin mAb購自北京中杉金橋生物技術有限公司;兔抗XBP1s mAb購自美國CST公司;細胞凋亡試劑盒購自上海貝博生物科技公司。
透射電子顯微鏡(Talos L120C G2,美國Thermo公司);動態光散射儀(Zeta sizer Nano-ZS, Malvern ZS90, 英國Malvern公司);紫外-可見分光光度計(UV-1900)、熒光吸收光譜儀(RF5301PC)(日本島津公司);全波長酶標儀(Infinite M1000 PRO,瑞士Tecan公司);場發射掃描電子顯微鏡(GeminiSEM 300,德國蔡司公司);流式細胞儀(CytoFLEX,美國Beckman coulter公司)。
1.2 細胞培養小鼠巨噬細胞系RAW264.7購自武漢普諾賽生命科技有限公司并在含有10% 胎牛血清和1%青-鏈霉素溶液的Dulbecco改良Eagle培養基,于37 ℃、5% CO2的培養箱內培養,待細胞貼壁生長到80%左右更換培養基傳代。
1.3 羅丹明B修飾siRNA的合成無菌無酶環境下,將羅丹明B(rhodamine B,RhB)異硫氰酸鹽DMSO溶液(0.266 mg/ml,500 ml)加入到siXBP1無酶水溶液(1.65 mg/ml,1 ml,2 ∶1)中并充分搖動混勻后逐滴加入適量NaHCO3澄明上清液(0.1 ml,1 mol/L)以調節溶液的pH值至8.0,室溫下磁力攪拌過夜。將混合物置于截留分子量為1 000的透析袋中(9 L ddH2O)兩端用透析夾夾緊,于37 ℃ 條件下在磁力攪拌器上攪拌透析過夜,每8 h換液1次,并經冷凍干燥48 h得到RhB修飾的siXBP1紅色粉末(RhB-siXBP1)。
1.4 FA改性TPGS的合成將0.19 g PTSC和1 g TPGS加至5 ml CH2Cl2溶液中,室溫下磁力攪拌并逐滴加入1.4 ml 三乙胺,反應12 h后逐滴加入2~3滴濃鹽酸,以中和未反應完全的三乙胺。加入適量硫酸鎂以去除多余水分,經抽濾得濾液,并將濾液于室溫下旋蒸30 min。預冷的無水乙醚滴加到冷凝濾液中析出沉淀后于40 ℃干燥箱中干燥,得白色沉淀。氮氣條件下將白色沉淀充分溶解于2 ml DMF溶液中,然后加入適量乙二胺,40 ℃下劇烈攪拌24 h得到TPGS-NH2配合物。
將等摩爾當量的FA(2.207 mg)和CDC(0.857 mg)溶解于PBS緩沖液中,磁力攪拌30 min后,滴加等摩爾當量的NHS(0.578 mg) 反應3 h以活化FA。將TPGS-NH2(100 mg)充分溶解于2 ml PBS緩沖液中,然后逐滴滴加活化的FA溶液,室溫下磁力攪拌72 h并將混合物置于截留分子量為1 000的透析袋中(9 L ddH2O)于37 ℃條件下在磁力攪拌器上攪拌透析以去除多余反應物。所得樣品經冷凍干燥后得到姜黃色FA-TPGS油狀物。
1.5 FA-TPGS包被siRNA的合成將FA-TPGS和siXBP1按照一定比例混合均勻后(5 ∶1),通過交聯作用合成了FA-TPGS包裹siRNA的納米材料(FA-TPGS@RhB-siXBP1,簡寫為FT@XBP1)。首先,將FA-TPGS(2.24 mg)、RhB-siXBP1和1,4-二氧六環(2 ml)加入青霉素瓶中,超聲處理20 min后借助微型流量計進行組裝(7 ml ddH2O)并于磁力攪拌器上快速攪拌2 h。將得到的樣本置于截留分子量為1 000的透析袋中透析,最后經冷凍干燥得淡紅色粉末。
1.6 FT@XBP1的鑒定及表征
1.6.1TEM(transmission electron microscopy, TEM) 取FA-TPGS和FT@XBP1 100 μl PBS緩沖液[c(FA-TPGS):0.896 mg/ml]溶于ddH2O至適宜濃度,取100 μl左右液體滴至銅網上,空氣中自然干燥后利用透射電子顯微鏡鑒定FA-TPGS及FT@XBP1形態及粒徑大小,并拍照。
1.6.2動態光散射(dynamic light scattering, DLS) 取適宜濃度的FA-TPGS和FT@XBP1各100 μl,超聲波振蕩處理2 min左右后采用動態光散射儀室溫下測定納米載體及納米載體-siRNA復合物粒徑大小及分布情況。
1.6.3紫外可見光吸收光譜 應用紫外吸收光譜儀觀測納米載體包裹siXBP1前后紫外吸收情況。分別取各樣品溶于100 μl PBS緩沖液[c(FA-TPGS):0.896 mg/ml]再用PBS緩沖液稀釋至適宜濃度。用紫外-可見分光光度計在260~280 nm范圍內收集每個樣本的紫外-可見吸收光譜,最后利用Origin 2018軟件進行數據處理。
1.6.4熒光吸收光譜 借助熒光吸收光譜儀觀察FT@XBP1及其對照組FT@NC熒光光譜圖。將 RhB 標記的FT@NC和FT@XBP1溶于100 μl PBS緩沖液[c(FA-TPGS):0.448 mg/ml]再用PBS緩沖液稀釋至適宜濃度。采用熒光光譜儀室溫考察RhB的熒光變化情況。RhB的激發光波長為550 nm,最大發射波長為580 nm, 狹縫寬度設置為5 nm。最后用 Origin 2018軟件進行數據處理。
1.7 相對釋放將FT@XBP1納米顆粒分別分散在1 ml PBS(pH值為5.0和7.4)中并在室溫下置于截留分子量為15 000的透析袋中(9 L ddH2O)進行透析,兩端用透析夾夾緊,于37 ℃條件下在磁力攪拌器上攪拌,分別于0、10、20、30和40 h取樣檢測,每次取透析介質 2 ml,取后用等體積磷酸鹽緩沖液補充。采用全波長酶標儀檢測siXBP1從FT@XBP1納米材料的釋放情況,按照公式[6]以時間為橫坐標,siRNA累積釋放率為縱坐標,做出siRNA的體外釋放研究曲線。實驗重復3次,結果取平均值,相關度為P<0.05。根據公式計算每個取樣點的累積藥物釋放量。
1.8 細胞相容性
1.8.1掃描電子顯微鏡(scanning electron microscopy,SEM) 將RAW264.7細胞以5×104個/孔的接種密度接種于鋪有無菌10 mm圓形玻片的6孔板中,待細胞貼壁生長40%~50%,將FA-TPGS以及FT@XBP1納米材料[c(FA-TPGS):2.4 μg/ml]與小鼠巨噬細胞RAW264.7 共孵育48 h。刺激結束后,棄培養上清液,并用預冷的PBS緩沖液清洗細胞,將樣品用5% 戊二醛(1 ml)固定過夜,并依次加入一系列乙醇(30%、50%、70%、80%、90%和100%)進行樣本脫水處理。樣本經冷凍保存并噴金后借助掃描電子顯微鏡進行拍攝。
1.8.2CCK-8檢測細胞活力 取對數生長期的RAW264.7細胞,計數后按照3×103個/孔接種到96孔板中。待細胞融合度達60%~70% 后,以PBS組為對照,每組分別加FA-TPGS和FT@XBP1[c(FA-TPGS):2.4 μg/ml]繼續培養 48 h后,每孔加入 CCK-8 試液 10 μl,避光孵育2~4 h,最后在酶標儀上檢測OD450數值,計算FA-TPGS和FT@XBP1對RAW264.7巨噬細胞活力的影響。
1.8.3流式細胞術檢測細胞凋亡 為了研究FT@XBP1納米材料對巨噬細胞凋亡的影響,課題組使用FT@XBP1納米材料和對照組刺激細胞48 h后棄掉培養基,以1 200 r/min離心5 min收集細胞,預冷PBS清洗3次后按照說明書加入結合液,混合均勻后避光加入10 μl Annexin V吹打混勻,繼續加入15 μl PI溶液避光孵育15 min,最后通過流式細胞儀獲得數據,并計算凋亡細胞比例。
1.9 激光共聚焦檢測細胞攝取將RAW264.7細胞以5×104個/孔的細胞密度接種在激光共聚焦小皿中培養,約6 h后,加入FT@XBP1[c(FA-TPGS):5 μg/ml]與RAW264.7 細胞共孵育24 h,棄上清液,用預冷的PBS清洗細胞,4% 多聚甲醛 200 μl固定細胞5~10 min, 室溫下在5% BSA溶液中封閉1 h, 最后用含抗熒光淬滅劑的DAPI染色5~10 min后于激光共聚焦顯微鏡鏡下拍攝。
1.10 Western blot實驗應用FT@XBP1納米材料轉染RAW264.7 細胞48 h后通過Western blot技術檢測經FT@XBP1處理后巨噬細胞XBP1s的表達水平。簡而言之,提取細胞蛋白質后通過聚丙烯酸凝膠電泳將目標蛋白(10~20 μg)轉至 PVDF 膜上,封閉后,再用 PBS 清洗 3次,每次8 min, 后與按比例進行稀釋(1 ∶1 000)的特異性一抗(β-actin和XBP1s)4 ℃孵育過夜,次日將條帶與相應種屬的二抗室溫下共孵育1 h, 最后使用發光成像系統檢測熒光信號并拍攝。
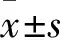
2 結果
2.1 FT@XBP1顆粒大小及粒徑分布構建了包被XBP1 siRNA的葉酸改性TPGS納米載體(FT@XBP1),如圖TEM(圖1A)和DLS(圖1B)所示,FT@XBP1聚合物外觀呈球形,尺寸均勻,與FA-TPGS納米載體的顆粒大小接近,平均粒徑為(200±20)nm。

圖1 FA-TPGS和FT@XBP1的顆粒大小和粒徑分布
2.2 FT@XBP1的特征峰鑒定熒光光譜顯示,FT@NC和FT@XBP1均在550 nm左右處顯現RhB的特征吸收峰(圖2A)。紫外吸收光譜圖表明,FA-TPGS、FT@XBP1在220~300 nm處均有FA-TPGS的特征吸收峰,并且RhB修飾的siXBP1和FA-TPGS聚合交聯后,分別在350 nm和550 nm左右顯示出siRNA的小的吸收峰,這表明FA-TPGS和RhB-siXBP1成功結合(圖2B)。
2.3 FT@XBP1相對釋放將FT@XBP1置于不同pH值的PBS溶液中,由圖3可見,RhB-siXBP1 在pH 5.0的PBS溶液中24 h累積釋放量高達(69.65±3.95)%,并且在36 h保持不變,而在pH 7.4的PBS溶液中時,RhB-siXBP1的相對釋放率穩定在(52.28±4.69)% 左右。上述結果提示,酸性條件有利于RhB-siXBP1從FA-TPGS納米載體中的釋放。

圖3 FT@XBP1的相對釋放(n=3)
2.4 RAW264.7細胞攝取FT@XBP1通過激光共聚焦顯微鏡觀察小鼠巨噬細胞RAW264.7與FT@XBP1共孵育24 h后紅色熒光的分布情況。結果顯示,RhB(紅色)標記的聚合物可以被巨噬細胞成功攝取并吞入細胞質,部分進入細胞核(圖4)。

圖4 激光共聚焦顯微鏡檢測RAW264.7細胞攝取FT@XBP1
2.5 FT@XBP1的安全性通過SEM、CCK-8和凋亡試驗檢測FT@XBP1的細胞毒性。將FA-TPGS和FT@XBP1分別與小鼠巨噬細胞RAW264.7共培養48 h。如圖5A所示,SEM成像顯示與FA-TPGS相比,FT@XBP1對RAW264.7細胞狀態幾乎無影響。分別使用不同濃度的FA-TPGS和FT@XBP1與RAW264.7共培養48 h,CCK-8試驗顯示FT@XBP1在濃度為0.15~4.80 μg/ml范圍內幾乎不降低巨噬細胞的細胞活力(圖5B)。并且凋亡檢測也表明,與PBS組相比,FT@XBP1在2.40 μg/ml的濃度下對巨噬細胞凋亡無明顯影響(F=3.314,P=0.122)(圖5C、D)。結果顯示,FT@XBP1對巨噬細胞具有良好的細胞相容性和安全性。

圖5 FT@XBP1對巨噬細胞的安全性分析
2.6 FT@XBP1的敲降作用通過Western blot方法檢測FT@XBP1對巨噬細胞XBP1s的敲除作用。如圖6所示,與FT@NC組相比,2.40 μg/ml的FT@XBP1刺激RAW264.7細胞48 h后能明顯降低巨噬細胞XBP1s的表達(F=22.601,P<0.001)。

圖6 FT@XBP1對巨噬細胞XBP1s的沉默作用
3 討論
巨噬細胞是機體固有免疫系統的重要組成部分,也是參與炎癥反應和損傷-修復的重要細胞成分,在維持內環境穩定中發揮至關重要的作用。根據經典學說,活化的巨噬細胞通常分為兩種表型,即經典活化的M1型巨噬細胞和替代活化的M2巨噬細胞。研究表明,巨噬細胞表型轉化在多種疾病的發生發展和治療中發揮關鍵作用。如特異性阻斷髓系LDH-A可將TAM向抗腫瘤表型轉變,同時改善腫瘤細胞浸潤[7],IL4/IL13激活的M2樣巨噬細胞有助于組織修復和炎癥消退,從而保護動脈粥樣硬化[8]。因此,靶向調控巨噬細胞表型重編程可能是有效的疾病治療策略。
營養缺乏、低氧、高代謝需求和氧化應激等都會導致內質網蛋白質折疊功能的紊亂,引起內質網應激(endoplasmic reticulum stress,ERS),進而激活UPR反應[9]。該課題組前期研究[10]表明,肝癌細胞可以將ERS信號傳遞給微環境的巨噬細胞,促進巨噬細胞M2轉化。也有研究[11]報道,ERS可能是巨噬細胞M2表型轉化所必須的因素但ERS的腫瘤細胞如何調控微環境中浸潤的巨噬細胞M1/M2型轉化尚不清楚。IRE1α-XBP1是UPR反應中最保守的通路,有文獻[12]報道,IRE1α-XBP1通路在巨噬細胞表型轉化中發揮至關重要的調控作用。如急性肝損傷期間,敲除XBP1損害線粒體自噬激活巨噬細胞中的mtDNA-cGAS-STING信號加劇損傷。此外,XBP1s高表達與腫瘤進展、不良預后和耐藥呈正相關[13]。因此,通過靶向調控IRE1α-XBP1下游關鍵核轉錄因子XBP1s調控巨噬細胞表型重塑,恢復微環境免疫平衡狀態值得深入研究。
靶向調控微環境巨噬細胞及其內質網應激水平,重塑巨噬細胞極化狀態,進而恢復免疫微環境穩態一直是腫瘤及炎癥相關疾病治療中面臨的巨大挑戰。腫瘤細胞和活化的巨噬細胞表面均過表達葉酸受體(folic acid receptor,FRs),且這些受體表現出高親和力、低免疫原性,而FRs在正常的組織中含量較少[14],這提示可以用葉酸(FA)修飾的納米載體荷載藥物或核酸等物質發揮治療作用。TPGS是天然維生素E的兩親性衍生物,包含親脂性部分和聚乙二醇(PEG)的親水性部分,具有高滲透性,已被美國食品藥品監督管理局批準應用于食品和藥物的安全輔助劑。研究[7]表明TPGS不僅可以作為納米顆粒的基質材料,用于疏水藥物的高效封裝,而且它與藥物聚合成膠束的時候,會提高胃腸道的吸收率,因此,可以明顯地提高利用率。更重要的是,TPGS不僅具有小粒徑、低毒性、緩釋性以及轉染效率高等特點,而且對癌細胞有選擇性的細胞毒性活性。因此,TPGS可能是遞送 siRNA的理想載體。該研究通過交聯作用制備葉酸修飾的TPGS納米載體,并在此基礎上構建有效包載、穩定釋放XBP1 siRNA的納米載藥系統FT@XBP1,體外研究表明FT@XBP1可被巨噬細胞有效攝取,在不影響細胞增殖和凋亡的情況下即可顯著抑制XBP1s表達,為開發以巨噬細胞和內質網應激IRE1α-XBP1通路為靶點的治療策略提供依據。

