Toll樣受體4在對乙酰氨基酚誘導的小鼠急性肝損傷早期中的作用
鄭秀良,陳明月,喬亞琴,沈海濤,路 燕
對乙酰氨基酚(acetaminophen, APAP)作為一種解熱鎮痛類藥物,自問世以來,已在全球范圍內得到廣泛應用,并因其易獲取性,往往導致有意或者無意識的超劑量服用,導致肝臟損害,嚴重者可出現急性肝衰竭[1]。隨著人們對APAP致肝臟損害的深入研究,人們對其致病機制了解的越來越透徹,包括線粒體的氧化應激、自噬、無菌性炎癥等[2-4]。在無菌性炎癥的肝損傷中,過量的APAP導致肝細胞廣泛壞死,引起高遷移率族蛋白B1(high mobility group box-1, HMGB1)、組蛋白等內源性損傷相關分子模式(damage-associated molecular patterns, DAMPs)的釋放,從而活化Toll樣受體(Toll-like receptors, TLRs)并與其結合,激活下游的炎癥信號通路,導致炎癥介質釋放引起肝臟損害[4]。Toll樣受體4(Toll-like receptor 4, TLR4)是TLRs家族的一員,可識別包括病原相關分子模式(pathogen-associated molecular patterns, PAMPs)和DAMPs等在內的配體,并活化下游信號通路激活機體自身固有免疫[5]。HMGB1是介導TLR4活化的內源性危險信號分子[6]。TLR4被HMGB1活化后可經髓樣分化因子88(myeloid differentiation factor 88, MyD88)依賴途徑激活核因子-κB(nuclear factor kappa B, NF-κB),產生白細胞介素(interleukin,IL)-1β、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)和IL-6等炎癥細胞因子,從而引起非酒精性脂肪肝、肝缺血-再灌注損傷等[7-8]。但TLR4在APAP致急性肝損傷中的作用研究甚少,因此,該研究擬通過腹腔注射APAP構建急性藥物性肝損傷動物模型,并利用TLR4抑制劑瑞沙托維(resatorvid,TAK-242)初步揭示TLR4在APAP致小鼠急性肝損傷早期中的作用。為今后TLR4是否可以在藥物性肝損傷中成為一個治療靶點而提供理論基礎。
1 材料與方法
1.1 材料
1.1.1實驗動物 58只6~8周齡SPF級雄性ICR小鼠購自浙江維通利華實驗動物技術有限公司[生產許可證編號:SCXK(浙) 2019-0001;使用許可證編號:SYXK(皖) 2017-006]。所有小鼠于實驗前1周放置于溫度22~26 ℃、濕度40%~60%的環境中光/暗交替各12 h,且可自由獲取水和食物。
1.1.2主要藥物與試劑 對乙酰氨基酚(APAP)、TAK-242購自上海MedChemExpress公司;DMSO購自北京索萊寶科技有限公司;ALT檢測試劑盒購自南京建成生物工程研究所;TLR4抗體購自英國Abcam公司;NF-κB抗體購自美國proteintech公司;HMGB1、β-actin抗體購自美國CST公司;RT-qPCR逆轉錄試劑盒購自上海新貝生物科技有限公司;引物由上海生工生物工程股份有限公司合成;免疫組化試劑盒購自北京中杉金橋生物技術有限公司;IL-6 ELISA試劑盒購自武漢伊萊瑞特生物科技股份有限公司。
1.2 實驗方法
1.2.1實驗動物分組與處理 將58只雄性ICR小鼠隨機劃分為7組,其中對照組(正常對照組、溶劑對照組、抑制劑對照組)每組6只,實驗組(APAP 4 h組、APAP+TAK-242 4 h組、APAP 12 h組、APAP+TAK-242 12 h組)每組10只。在禁食12 h后,將APAP(300 mg/kg)腹腔注入到實驗組小鼠體內,TAK-242(3 mg/kg)于APAP注射前3 h進行腹腔注射,其中APAP溶液用生理鹽水配制,TAK-242溶液用0.5% DMSO配制。正常對照組小鼠腹腔注射與APAP組等體積生理鹽水,抑制劑對照組小鼠注射與APAP+TAK-242組小鼠等體積TAK-242溶液,溶劑對照組小鼠注射與抑制劑對照組等體積的溶劑。在APAP處理后不同時間點(0、4、12 h)剖殺小鼠。
1.2.2血清ALT水平的測定 通過血清ALT水平評價小鼠肝損傷情況,根據ALT檢測試劑盒說明書進行血清ALT水平的測量。
1.2.3肝組織病理學檢查 將肝臟組織用石蠟包埋后制成5 μm厚的切片,切片于脫蠟水化后用蘇木精-伊紅染液著色,梯度乙醇脫水,二甲苯透明,中性樹膠封片,顯微鏡下觀察,Image-Pro Plus軟件對其圖像進行組織病理學分析。
1.2.4蛋白質免疫印跡 肝臟組織蛋白用RIPA裂解液提取并采用BCA法檢測其濃度,經SDS-PAGE分離及PVDF膜電轉移。用5%脫脂牛奶封閉后用相應的一抗孵育,并置于4 ℃冰箱冷藏過夜。次日,用相對應的二抗常溫孵育1 h,然后用化學發光顯影儀曝光和拍照,利用Image J軟件對圖像進行分析。
1.2.5RT-qPCR 應用TRIzol試劑對肝組織進行RNA的分離,利用FlexCycler多功能PCR儀使其逆轉錄成cDNA。cDNA在LightCycle-480 PCR儀上進行擴增,擴增程序為95 ℃、30 s,95 ℃、10 s,60 ℃、30 s,循環45次。最后通過分析熔解曲線判斷PCR擴增產物的特異性,2-ΔΔCt法分析目的基因相對比值。相關引物序列見表1。
1.2.6免疫組織化學染色 肝臟組織切片脫蠟水化后進行過氧化物酶的阻斷及抗原修復。然后將其與稀釋后的HMGB1抗體(1 ∶200)孵育過夜。次日,將切片與相對應的二抗進行孵育,DAB顯色,蘇木精染色15 s、PBS返藍、梯度乙醇脫水、二甲苯透明及中性樹膠封片,顯微鏡下觀察并拍照,利用Image-Pro Plus軟件對圖像進行分析。
1.2.7酶聯免疫吸附試驗 ELISA法測定肝臟組織IL-6含量。樣本含量的測量及計算遵循使用說明書進行。
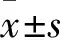
2 結果
2.1 溶劑和抑制劑對正常小鼠肝臟的影響溶劑對照組、抑制劑對照組及正常對照組的小鼠血清ALT水平、肝指數均未見明顯差異(F=0.758、2.211,均P>0.05)。見表2。溶劑對照組和抑制劑對照組與正常對照組相比,HE染色均未見明顯的肝臟組織病理學變化。見圖1。

圖1 溶劑和抑制劑對小鼠肝臟組織的影響 HE×100
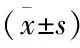
表2 溶劑和抑制劑對小鼠血清ALT、肝指數的影響
2.2 抑制TLR4對小鼠肝臟TLR4的影響與正常對照組相比,APAP 4 h組小鼠肝臟TLR4的表達量上調,差異有統計學意義(t=-2.319,P<0.05)。而APAP+TAK-242 4 h及12 h組小鼠肝臟的TLR4均較同時間點APAP組表達量下調,差異均有統計學意義(t=3.379、3.724,均P<0.01)。見圖2。

圖2 抑制TLR4對小鼠肝臟TLR4的影響
2.3 抑制TLR4對APAP誘導的小鼠肝損傷的影響APAP 4 h和12 h組的小鼠血清ALT水平及肝指數與正常對照組相比均升高,差異均有統計學意義(F=27.674、24.387,均P<0.01);進一步分析顯示APAP+TAK-242 4 h組與APAP 4 h組相比,其血清ALT水平和肝指數均降低,差異均有統計學意義(t=2.419、5.957,P<0.05,P<0.01)。HE染色顯示正常對照組小鼠肝臟組織大小形態均正常,無明顯的炎癥及壞死。APAP 4 h組小鼠肝臟組織出現腫大充血,APAP 12 h組出現典型的小葉中心性壞死。APAP+TAK-242 4 h和12 h組均較同時間點APAP組肝臟組織壞死程度減輕。見表3、4和圖3。

圖3 抑制TLR4對APAP誘導的小鼠肝臟組織的影響 HE×100
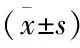
表3 APAP對小鼠血清ALT、肝指數和肝臟組織的影響
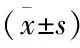
表4 抑制TLR4對APAP肝損傷小鼠血清ALT、肝指數和肝臟組織的影響
2.4 抑制TLR4對肝臟HMGB1和NF-κB蛋白表達的影響肝臟IHC結果顯示APAP 4 h和12 h組的HMGB1蛋白含量均高于正常對照組,差異均有統計學意義(F=83.945,P<0.01);而APAP+TAK-242 4 h和12 h組的HMGB1的蛋白含量均較同時間點APAP組降低,差異均有統計學意義(t=3.561、5.022,均P<0.01)。見圖4A、B。Western blot分析顯示,APAP 4 h組HMGB1、NF-κB的蛋白含量高于正常對照組,兩組間差異有統計學意義(t=-2.445、-2.994,均P<0.05);相較于APAP 4 h 組,APAP+TAK-242 4 h組的HMGB1、NF-κB的蛋白含量在肝臟中的表達均降低,差異均有統計學意義(t=3.113、4.506,均P<0.05);APAP+TAK-242 12 h組的HMGB1的蛋白含量較同時間點APAP組降低,差異有統計學意義(t=3.462,P<0.01)。見圖4C-E。

圖4 抑制TLR4對肝臟HMGB1和NF-κB蛋白表達的影響

圖5 抑制TLR4下調炎癥因子MCP-1、IL-1β、TNF-α、IL-6在肝臟中的表達
2.5 抑制TLR4影響炎癥因子MCP-1、IL-1β、TNF-α、IL-6在肝臟中的表達各組小鼠肝臟MCP-1、IL-1β、TNF-α 和IL-6基因水平用RT-qPCR檢測,ELISA法檢測各組小鼠肝組織IL-6含量。結果顯示,與正常對照組相比,APAP 4 h組的肝臟MCP-1、IL-1β、TNF-α 和IL-6基因水平及肝組織IL-6的含量均升高,差異均有統計學意義(t=-3.935、-8.931、-2.300、-7.307、-6.026,P<0.05,P<0.01);見圖5A-E。APAP 12 h組的肝組織IL-6含量升高,差異有統計學意義(t=-6.168,P<0.01)。見圖5E。與APAP 4 h組相比,APAP+TAK-242 4 h組的MCP-1、IL-1β、TNF-α 和IL-6基因水平及組織IL-6的含量在肝臟中的表達均降低,差異均有統計學意義(t=4.855、11.196、3.071、8.364、2.277,P<0.05,P<0.01);見圖5A-E。APAP+TAK-242 12 h組與APAP 12 h組相比,其MCP-1、IL-1β 和TNF-α 的基因水平在肝臟中的表達均降低,差異均有統計學意義(t=8.941、3.194、3.751,P<0.05,P<0.01)。見圖5A-C。
3 討論
藥物性肝損傷是由藥物本身或其代謝產物所致的肝臟損害。目前許多國內外學者對一些常引起肝損傷的藥物做了大量研究,其中以APAP致肝臟損害的機制研究最為深入。目前研究[5,9]表明,服用過量的APAP可形成APAP蛋白加合物,引起氧化應激、MPTP開放,從而導致肝細胞壞死。壞死的肝細胞釋放DAMPs,并與TLR4結合,從而活化下游的炎癥信號通路,激活NF-κB,導致炎性細胞分泌TNF-α、IL-6等炎癥介質加重肝損傷。
該研究通過腹腔注射APAP成功建立小鼠急性肝損傷模型,肝臟受損導致內源性配體DAMPs的釋放,并與TLR4結合,激活下游的炎癥信號通路,導致炎性介質的釋放,從而引起急性肝損傷。研究表明ICR小鼠經腹腔注射APAP后其血清ALT水平、肝指數升高,肝組織病理學顯示肝小葉中心性壞死。而抑制TLR4可在小鼠肝損傷早期降低血清ALT水平和肝指數,減輕肝組織病理損傷。
APAP誘導肝組織損傷后,壞死的肝細胞釋放內源性配體DAMPs,DAMPs結合TLRs激活先天免疫系統,導致炎癥因子釋放,引起肝損傷[9]。有研究[10]表明抑制TLR4可通過對TLR4/NF-κB、TLR4/HMGB1等信號通路的抑制來降低炎癥反應從而對肝臟具有保護作用;敲除TLR4則可通過對TLR4/MyD88/NF-κB信號通路的抑制,來減少炎癥反應,達到減輕肝損傷的目的[11]。在該研究中,經TAK-242處理后的小鼠肝組織中的TLR4、HMGB1、NF-κB的蛋白含量均降低。這些結果表明TLR4的抑制可減輕APAP所致的急性肝損傷,其機制可能在于抑制了TLR4/HMGB1信號通路的活化。
部分研究[12-14]表明TLR4通路的激活可引起肌肉、骨關節、血管平滑肌等組織產生炎癥細胞,引起IL-1β、TNF-α和IL-6等炎癥因子的釋放,從而對組織造成損傷;而抑制或敲除TLR4則能使組織減少上述炎癥因子的釋放,減輕損傷。在該研究中,APAP活化TLR4信號通路促進炎癥因子(MCP-1、IL-1β、TNF-α 和IL-6)在肝組織中的分泌,而抑制TLR4則能下調上述炎癥因子水平。以上結果表明肝臟損傷的減輕可能是通過抑制TLR4下游的炎癥信號通路來下調炎癥因子,降低肝臟炎癥反應。
綜上所述,該研究通過對ICR小鼠進行體內注射APAP溶液來構建急性藥物性肝損傷模型并利用TLR4抑制劑(TAK-242)初步揭示TLR4在 APAP致小鼠急性肝損傷早期中的作用。結果顯示,抑制TLR4能降低APAP致急性肝損傷早期小鼠的血清ALT活力和肝指數、減輕肝臟組織病理損傷改變。同時,抑制TLR4可以抑制肝臟TLR4/HMGB1通路的激活,使TLR4、HMGB1和NF-κB的蛋白含量降低,并下調炎癥因子(MCP-1、IL-1β、TNF-α 和IL-6)在肝組織中的表達,從而減輕APAP誘導的急性肝損傷。本研究僅初步闡明抑制TLR4可能通過抑制TLR4下游的炎癥信號通路對APAP致小鼠急性肝損傷早期階段有一定的保護作用,但對其在整個肝損傷階段是否具有持續減輕肝損傷的作用還尚未清楚,有待進一步探究。

