帕金森病患者血清AGEs水平與認知障礙的關系
王 煜,胡曉輝,李 婷,崔 鑫,馬小雯
西安市紅會醫院神經內科,陜西西安 710038
帕金森病(PD)為慢性中樞神經退行性疾病,好發于老年人群。PD主要癥狀為運動功能障礙、自主神經紊亂、認知功能障礙等[1]。超過80% 的PD患者伴認知功能障礙,其中30%會發展為癡呆,嚴重影響患者正常生活[2]。所以尋求生物標志物預測PD患者認知功能障礙利于臨床防治。晚期糖基化終末產物(AGEs)是由蛋白質、脂類、核酸的游離氨基與還原糖的羰基之間發生非酶反應而形成的化合物,可經機體內部形成,也可從飲食中獲取。隨年齡增大,人體組織、體液中的AGEs水平升高,并和其他蛋白質交聯,損傷其正常功能[3]。馬宗艷等[4]研究證實,AGEs與阿爾茨海默癥(AD)、PD等神經退行性疾病的發病機制有關,但與PD患者認知功能障礙相關性的研究較少。本研究將觀察PD患者血清AGEs水平及其與認知功能障礙的關系,以為臨床診療提供參考。現將結果報道如下。
1 資料與方法
1.1一般資料 選取2020年3月至2022年3月本院收治的92例PD患者作為研究對象,根據簡易精神狀態檢測量表(MMSE)評分標準[5]將其分為認知障礙組(<27分)和認知正常組(≥27分),另選取50例同期健康體檢者作為正常對照(NC)組。PD患者中男53例,女39例;年齡50~85歲,平均(74.36±6.74)歲;平均體質量指數(BMI)為(27.21±2.11)kg/m2;病程1~4年,平均(3.06±0.35)年;文化程度:小學及以下22例,初中21例,中專29例,大專及以上20例。NC組男29例,女21例;年齡60~95歲,平均(73.04±6.35)歲;文化程度:小學及以下12例,初中14例,中專14例,大專及以上10例。3組性別、年齡、BMI比較,差異無統計學意義(P>0.05),具有可比性。納入標準:(1)符合《帕金森病基層診療指南(2019年)》[5]中PD的診斷標準,Hoehn-Yahr分級為Ⅰ~Ⅳ期;(2)符合中華醫學會運動障礙協會制訂的帕金森病-輕度認知功能障礙(MCI)診斷標準[6];(3)年齡≥60歲;(4)多巴胺治療有效。排除標準:(1)合并嚴重心、肝、肺、腎疾病者;(2)合并惡性腫瘤、甲狀腺疾病、代謝性疾病者;(3)有出血性、缺血性腦血管病史,AD等神經系統疾病者;(4)其他影響認知功能的中樞神經損傷疾病者;(5)近期服用過影響血清AGEs水平的藥物者。本研究患者及家屬知情同意且經醫院醫學倫理委員會批準同意。
1.2方法 PD患者于入院第2天,NC組于體檢當天抽取清晨空腹靜脈血3 mL,放置于冰上,1 h內以3 000 r/min離心10 min,取上清液,采用酶聯免疫吸附試驗(ELISA)檢測血清AGEs水平,試劑盒購自美國Uscnlife公司,嚴格按照試劑盒說明書操作。評估所有研究對象的MMSE評分:包括時間定向力、即刻記憶、地點定向力、注意力及計算力、延遲記憶、視空間、語言等7個方面,回答正確計1分,錯誤或不知道計0分,總分為30分。MMSE評分27~30分為正常,<27分為認知功能障礙,<20~27分為輕度認知功能障礙,<10~20分為中度認知功能障礙,0~10分為重度認知功能障礙。
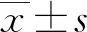
2 結 果
2.13組血清AGEs水平比較 92例PD患者分為認知障礙組42例,認知正常組50例。3組血清AGEs水平比較,差異有統計學意義(F=256.922,P<0.05)。認知障礙組血清AGEs水平[(16.43±2.37)ρ/mg·L-1]和認知正常組[(11.97±1.53)ρ/mg·L-1]血清AGEs水平高于NC組[(8.32±1.11)ρ/mg·L-1],且認知障礙組高于認知正常組,差異均有統計學意義(P<0.05)。
2.23組MMSE評分比較 NC組MMSE中時間定向力、即刻記憶、地點定向力、注意力及計算力、延遲記憶、視空間、語言評分高于認知正常組和認知障礙組,且認知正常組高于認知障礙組,差異均有統計學意義(P<0.05),見表1。

表1 3組MMSE評分比較分)
2.3PD患者血清AGEs與MMSE各項評分的相關性 Pearson相關分析顯示,PD患者血清AGEs與MMSE評分中時間定向力、即刻記憶、地點定向力、注意力及計算力、延遲記憶、視空間、語言評分呈負相關(r=-0.672、-0.648、-0.705、-0.465、-0.568、-0.767、-0.667,P<0.05)。
2.4血清AGEs對PD患者認知功能障礙的預測效能 血清AGEs預測PD患者認知功能障礙的曲線下面積(AUC)為0.832(95%CI:0.793~0.871),靈敏度為87.8%,特異度為84.2%,最佳截斷值為14.01 ρ/mg·L-1,見圖1。

圖1 血清AGEs預測老年PD患者認知功能障礙的ROC曲線
2.5認知障礙組和認知正常組的一般資料比較 認知障礙組病程長于認知正常組,文化程度低于認知正常組,差異均有統計學意義(P<0.05),見表2。

表2 認知障礙組和認知正常組的一般資料比較(n/n或
2.6PD患者認知功能障礙的多因素Logistic回歸分析 將PD患者認知功能障礙作為因變量(有認知功能障礙=1,無認知功能障礙=0),將病程(≥3年=1,<3年=0),文化程度(低于或為初中=1,高于或為中專=0),AGEs(≥14.01 ρ/mg·L-1=1,<14.01 ρ/mg·L-1=0)作為自變量進行多因素Logistic回歸分析,結果顯示血清AGEs≥14.01 ρ/mg·L-1、病程≥3年、文化程度低于初中是PD患者認知功能障礙的危險因素(P<0.05),見表3。

表3 老年PD患者認知功能障礙的多因素Logistic回歸分析
3 討 論
PD為慢性進展性神經系統退變性疾病,病理特征為細胞內蛋白質包涵體積累、黑質、多巴胺能神經元變性缺失。該病主要表現為運動功能障礙,還可發生認知功能、精神行為等非運動功能障礙,甚至導致殘疾[7-8]。所以尋找輔助診斷PD認知功能障礙相關生物標志物對早期識別、干預癡呆高危人群有益。
本研究結果顯示,92例PD患者認知障礙率為45.65%,認知障礙組病程長于認知正常組,文化程度低于認知正常組,差異均有統計學意義(P<0.05),提示病程、文化程度與PD認知功能障礙有關。既往研究顯示,我國30%~60% PD患者會發生不同程度的認知功能障礙,與本研究結果相符[9]。同時與陳紅霞等[10]發現文化程度低是發生輕度認知功能障礙的危險因素的研究結果一致,具體發病機制有待進一步分析。
本研究發現,NC組MMSE中時間定向力、即刻記憶、地點定向力、注意力及計算力、延遲記憶、視空間、語言評分高于認知正常組,且認知正常組高于認知障礙組,差異均有統計學意義(P<0.05);認知障礙組、認知正常組血清AGEs水平高于NC組,認知障礙組高于認知正常組,差異均有統計學意義(P<0.05),提示血清AGEs水平與PD患者認知功能障礙有關。有研究發現,糖尿病認知功能障礙患者AGEs水平高于非認知功能障礙患者,且高于NC者,與本研究結果一致[11]。糖尿病和AD等癡呆疾病的共同病理基礎為免疫炎癥、氧化應激、胰島素信號傳導途徑異常、AGEs水平上升等[12]。分析原因為晚期糖基化終產物(RAGE)是AGEs的受體,質膜上AGEs、RAGE相互作用,會觸發神經元、內皮細胞等炎癥反應、氧化應激和凋亡的下游信號。糖苷氧化、氧化應激均屬PD致病因素,AGEs交聯導致蛋白質沉積,加快α-突觸核蛋白聚集、路易小體形成。而認知功能障礙患者腦內多巴胺能神經元損傷,紋狀體多巴胺去神經支配或多巴胺能神經功能障礙,繼發性抑制顳葉皮層、丘腦、中腦、海馬等部位神經遞質合成及分泌,導致PD患者認知功能損害嚴重程度加重[13]。
PD患者血清AGEs與MMSE評分中即刻記憶、時間定向力、地點定向力、注意力及計算力、延遲記憶、語言、視空間評分呈負相關(r=-0.648、-0.672、-0.705、-0.465、-0.568、-0.667、-0.767,P<0.05)。同時ROC曲線分析結果顯示,血清AGEs預測PD患者認知功能障礙的AUC為0.832(95%CI:0.793~0.871),多因素Logistic回歸分析顯示AGEs≥14.01 ρ/mg·L-1、病程≥3年、文化程度低于或為初中是PD患者認知功能障礙的危險因素(P<0.05),提示血清AGEs水平可作為PD認知功能障礙的預測、評估病情指標,診斷價值高。大腦為代謝活躍器官,能量代謝與糖氧化有關,腦組織活性糖水平增長可促進糖化修飾[14]。過多毒性AGEs蓄積參與認知功能損害過程,原因為AGEs可修飾tau蛋白、β-淀粉樣蛋白;且有直接細胞毒性,可導致神經元細胞凋亡;AGEs與RAGE結合影響細胞功能,生成自由基,促進氧化應激,還會損傷血管內皮,導致血管內皮形態及細胞骨架變化,提高血管通透性并沉積在血管壁老化蛋白上,導致血管硬化[15]。
綜上所述,PD患者血清AGEs水平升高,伴認知功能障礙的PD患者血清AGEs水平更高,血清AGEs水平有望作為PD認知障礙的預測指標。

