離子液體中Mn(III)Salen催化烯烴環氧化反應選擇性合成烯烴環氧化物
時園 SHI Yuan
(常州大學,常州 213164)
0 引言
工業活動中排放的揮發性有機物(VOC)主要來自于生產制造環節使用的易揮發性有機溶劑。在綠色發展背景下,使用低毒、環保溶劑代替有機溶劑成為從源頭上降低揮發性有機物排放的有效策略。離子液體具有無毒、無揮發、導電性好、溶解性強、可循環利用等特點,可以作為有機溶劑的一種理想替代品。在離子液體中加入Mn(III)Salen催化劑選擇性合成烯烴環氧化物,能夠促進烯烴環氧化反應的進行,對加快反應速率、提高產物質量有積極效果。其中,離子液體成分的不同,以及Mn(III)Salen催化劑類型的不同,都會對反應過程和反應結果帶來差異化影響,優化離子液體中Mn(III)Salen催化烯烴環氧化反應條件對實現綠色優質生產有積極幫助。
1 不同Mn(III)Salen催化劑對苯乙烯環氧化反應的催化效果
1.1 實驗方法
本實驗探究了3種不同類型Mn(III)Salen催化劑對苯乙烯環氧化反應的催化效果,催化劑的制備方法如下:選擇3個容量為250ml的三頸燒瓶,分別加入10mmol的環己二胺、領苯二胺、乙二胺,其余操作一致。用量筒量取75ml的無水乙醇并加入到三頸燒瓶中,將20mmol水楊醛溶于30ml無水乙醇中作為回流液,加熱至100℃后進行密封回流,回流時間為2.5h,然后自然冷卻至50℃。將玻璃導管一端插入三頸燒瓶底部,另一端通過橡膠導管與氣泵出口相連,由氣泵通入氮氣,在氮氣保護下向三頸燒瓶內加入帶醋酸錳的乙醇溶液(10mmol醋酸錳溶于20ml無水乙醇)。按照同樣的方法繼續回流2.5h,自然冷卻至50℃后,用量筒分別量取10mmol的氯化鋰溶液和20ml的無水乙醇,將兩者充分混合后加入到三頸燒瓶中,在接觸空氣的情況下用玻璃棒攪拌,使液體混合均勻后放置24h后,進行過濾并將固體物烘干,即可得到3種類型的Mn(III)Salen固體[1]。將乙二胺與水楊醛制備的Mn(III)Salen表示為A,環己二胺與水楊醛制備的Mn(III)Salen表示為B,領苯二胺與水楊醛制備的Mn(III)Salen表示為C。
選取次碘酸苯(PhIO)為氧化劑,以苯乙烯和次碘酸苯的環氧化為探針反應,以1-丁基-3-甲基咪唑六氟磷酸鹽(BmimPF6)為離子液體,探究3種Mn(III)Salen催化劑在有機溶劑和混合溶劑下對環氧化反應的催化效果[2]。其中,有機溶劑為CH2Cl2,混合溶劑為BmimPF6與CH2Cl2的混合物。氧化劑PhIO的制作方法為:將9g氫氧化鈉粉末溶于75ml純水中,充分攪拌至無固體殘留,得到氫氧化鈉溶液,裝入燒杯中。使用精密天平稱取16.1g的二乙酸碘苯,同樣加入到燒杯中,靜置30min后反應完成,可以發現絮狀物逐漸結成塊狀。過濾后保留塊狀固體,將其投入到盛有50ml氯仿的燒杯中進行純化處理,15min后再次過濾,所得產物即是具有強氧化性的PhIO,可作為氧化劑使用[3]。
1.2 實驗結果
3種Mn(III)Salen催化劑在有機溶劑和混合溶劑下對環氧化反應的催化結果見表1。
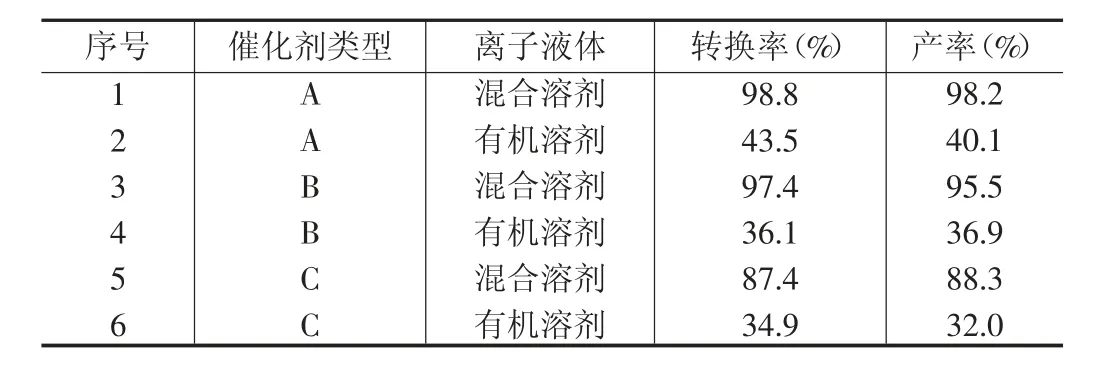
表1 催化效果表
由表1數據可知,選擇不同類型的催化劑,對苯乙烯的轉化率和環氧化物的產率有較為明顯的影響。橫向對比來看,使用乙二胺和水楊醛制作的Mn(III)Salen催化劑(A型)時,苯乙烯的轉化率最高,達到了98.8%。分析其原因,Mn(III)Salen催化環氧化反應的機理是利用活性中間體“氧和Mn(IV)Salen”絡合物來進行的,該中間體的化學結構如圖1所示。
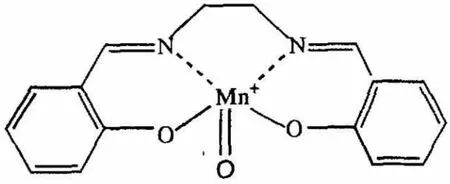
圖1 活性中間體的化學結構
由圖1可知,該物質為8面體結構,其中Mn原子正好處于Salen平面上方,與周圍的3個氧原子組合構成了相對穩定的Mn=O鍵。當進行烯烴環氧化反應時,烯烴會從Mn=O鍵的側面、與Salen平行的方向碰撞Mn=O鍵。這種情況下位于Salen平面上的不同取代基會影響兩者的融合效果,進而決定了催化劑的催化性能[4]。橫向對比來看,在本次實驗選用的3種Mn(III)Salen催化劑中,A型催化劑的融合效果最好,相應的催化活性最高。
在離子液體方面,當選擇由BmimPF6與CH2Cl2組成的混合溶劑時,苯乙烯的轉化率以及環氧化物的產率相對較高。以B型催化劑為例,如果只使用CH2Cl2溶劑,苯乙烯的轉化率僅為36.1%,產率僅有36.9%。如果選用混合溶劑,苯乙烯的轉化率達到了97.4%,產率也上升為95.5%。由此可見,BmimPF6是一種更加有效的環氧化反應介質。
2 離子液體中BmimPF6比例對環氧化反應的影響
2.1 實驗方法
通過上文分析可知,由BmimPF6與CH2Cl2組成的離子液體對環氧化反應產生了顯著影響。為了進一步探究兩種成分的最佳比例,在實驗中將離子液體的總體積固定為5.0ml,然后改變BmimPF6與CH2Cl2的比例,探究在不同體積比下的環氧化反應情況。環氧化產率越高,說明該比例下的離子液體性能越好。實驗中設計了9種情況,具體比例見表2。

表2 離子液體中BmimPF6與CH2Cl2的比例設計
2.2 實驗結果
離子液體中CH2Cl2與BmimPF6在各體積比下的環氧化物產率變化趨勢如圖2所示。
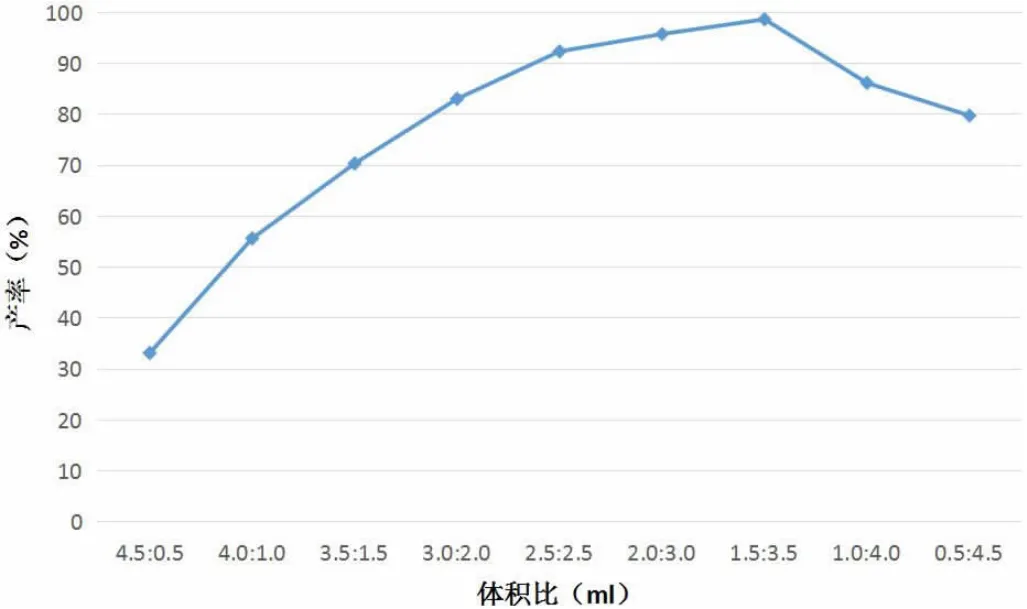
圖2 不同體積比下環氧化物產量變化趨勢圖
根據圖2可知,隨著CH2Cl2與BmimPF6的體積比由大到小,環氧化物的產率呈現出先升高后降低的變化趨勢。其中,在5.0ml離子液體中,CH2Cl2的體積為1.5ml、BmimPF6的體積為3.5ml時,環氧化物的產率最高,達到了98.9%。由此可知,在離子液體中Mn(III)Salen催化烯烴環氧化反應選擇性合成烯烴環氧化物中,按照CH2Cl2與BmimPF6體積比為1.5ml:3.5ml的比例制備離子液體,能夠使環氧化物的產率最高。
3 反應溫度對環氧化物產率的影響
3.1 實驗方法
溫度是影響催化劑活性的一項重要因素,不同類型的催化劑有最適宜的溫度區間,在該區間內催化劑的活性最佳,對環氧化反應的影響更為顯著;相反,如果實際反應溫度超出溫度區間的上限,或者是低于溫度區間的下限,都會導致催化劑的活性降低,從而影響環氧化物的產率[5]。為了確定更適合Mn(III)Salen催化劑的溫度,設計了如下實驗:以苯乙烯為反應底物,使用Mn(III)Salen作為催化劑,使用0.45mmol PhIO作為氧化劑。選取0.5mmol的苯乙烯和2.5ml的離子液體(CH2Cl2與BmimPF6體積比為1.5ml:3.5ml),分別在275K、300K進行環氧化反應,觀察不同溫度下環氧化反應的轉化率與選擇性。
3.2 實驗結果
兩種溫度下苯乙烯環氧化反應的情況對比如圖3、圖4所示。
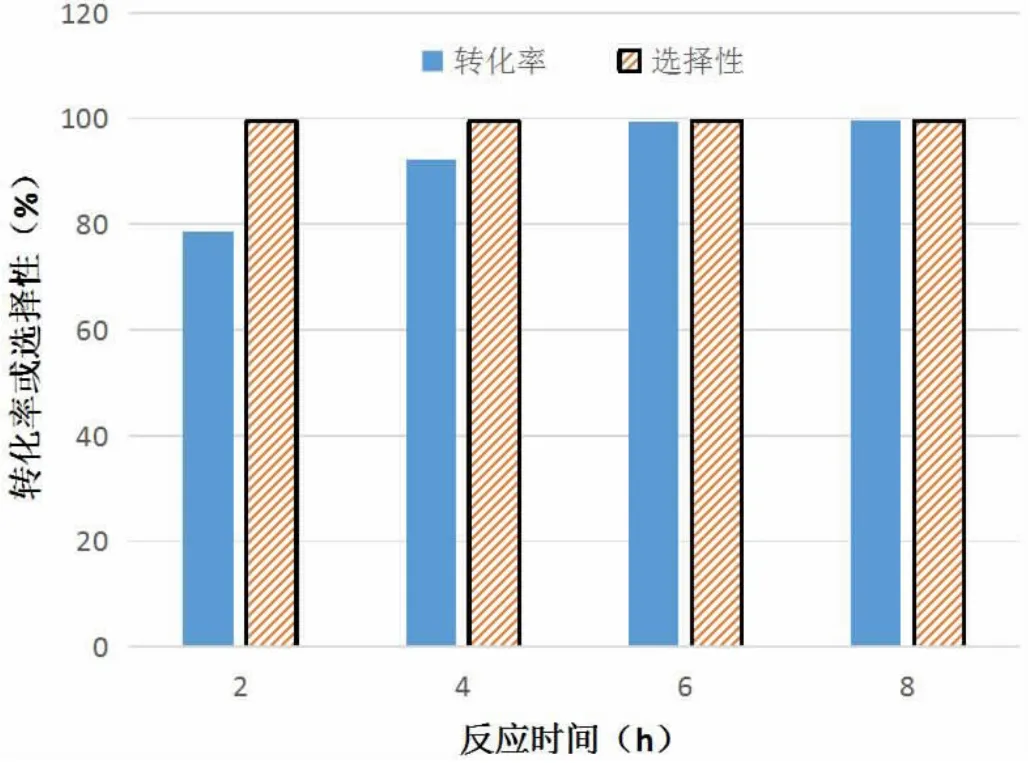
圖3 275K時苯乙烯環氧化反應的轉化率與選擇性

圖4 300K時苯乙烯環氧化反應的轉化率與選擇性
結合圖3和圖4可以發現,反應溫度主要對苯乙烯環氧化反應的轉化率有影響,當溫度為300K時反應速率較快,大約在2h后轉化率達到了95.1%,此時環氧化反應基本結束;相比之下,當溫度為275K時,經過2h后轉化率僅有28.2%。說明適當提高反應溫度,能夠提升苯乙烯環氧化反應的轉化率。在選擇性方面,溫度變化帶來的影響并不明顯。綜上,在離子液體中Mn(III)Salen催化烯烴環氧化反應選擇性合成烯烴環氧化物中,將反應溫度設定為300K更為合適。
4 底物與催化劑、氧化劑比例對環氧化物產率的影響
4.1 底物與催化劑比例的試驗
選擇0.3mmol的苯乙烯為底物,用0.45mmol的PhIO作為氧化劑,設定反應溫度為300K、反應時間為2h,通過改變催化劑的量探究底物與催化劑比例對環氧化物轉化率的影響,結果如圖5所示。
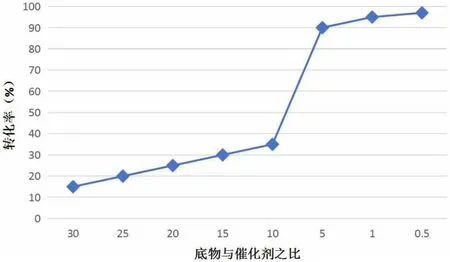
圖5 底物與催化劑比例對轉化率的影響
由圖5可知,環氧化物的轉化率隨著苯乙烯與催化劑摩爾比的減小呈現出上升趨勢,說明在混合物中催化劑的比例越高,環氧化反應速度越快,相應的環氧化物的轉化率越高。其中,當苯乙烯與催化劑的摩爾比為5:1時,轉化率明顯升高,并且底物苯乙烯在2h內基本反應完全。此后再繼續增加催化劑的量,對轉化率的提升作用不明顯。因此,在合成烯烴環氧化物中可以將底物與催化劑的摩爾比設定為5:1,在提高反應速度與轉化率的同時還能降低試驗成本。
4.2 底物與氧化劑比例的試驗
選擇0.3mmol的苯乙烯為底物,用0.05mmol的Mn(III)Salen作為催化劑,設定反應溫度為300K、反應時間為2h,通過改變氧化劑的量探究底物與氧化劑比例對環氧化物轉化率的影響,結果如圖6所示。

圖6 底物與氧化劑比例對轉化率的影響
由圖6可知,當混合物中氧化劑的量低于苯乙烯的量時,環氧化反應的轉化率較低。當兩者的比例為1:1時,轉化率開始明顯增加,在比例達到1.5:1時,大約2h可以完全反應,此時轉化率為95%。綜上,在合成烯烴環氧化物中可以將底物與氧化劑的摩爾比設定為1.5:1。
5 結語
離子液體是一種“環境友好型”溶劑,可以為有機陽離子和無機陰離子提供良好的反應環境,從而使溶解于離子液體中的催化劑具有更好活性,進而達到提高反應物轉化率與產物選擇性的效果。通過烯烴環氧化反應選擇性合成烯烴氧化物時,用BmimPF6與CH2Cl2組成的混合溶劑作為離子液體,用乙二胺和水楊醛制作的Mn(III)Salen作為催化劑,在300K溫度下進行苯乙烯環氧化反應,使苯乙烯環氧化物產率最高、選擇性更好。

