滅活的新型結核病疫苗菌株(B/R菌株)對小鼠T淋巴細胞免疫記憶的影響
豐啟盈,鄧喜玲,張 杰,董江濤,柳小玲,梁 粟,王 菊,張 輝,吳江東,章 樂,吳 芳,張萬江
結核病(Tuberculosis, TB),是結核分枝桿菌(MycobacteriumTuberculosis, Mtb)作為病原體所引起的機體慢性傳染性疾病[1],是影響人類健康和導致死亡的主要疾病之一。2022年全球結核病報告顯示,受COVID-19流行的影響,結核病確診人數在2017年至2019年大幅增長后,2020年患病人數顯著減少,但這一改變在2021年再次扭轉,全球預估有1 060萬人患病,與2020年患病人數相比增加4.5%[2]。目前世界范圍內唯一獲準應用的結核病預防性疫苗——卡介苗(Bacillus Calmette-Guerin, BCG),其問世已超百年,近年來越來越多的研究對其保護效力提出質疑。雖然BCG對新生兒結核與兒童重癥結核病具有較好且長時間的預防作用[3],但對于潛伏性肺結核與成人肺結核,BCG的保護作用并不穩定[4],且BCG缺失了與結核病致病高度相關的RD1和RD2區域編碼的相關抗原[5]。加之耐藥結核與HIV感染等因素對結核病流行的影響,BCG的保護效用已無法滿足現今結核病防治的嚴峻形勢,研制出更為有效的新型結核病疫苗,已然是重要方向。
目前,根據研究平臺的不同,可將正在研制的結核病疫苗分為兩大類:分枝桿菌全菌衍生疫苗與亞單位疫苗[6-7]。全菌疫苗因包含更為完整的抗原成分,可能比亞單位疫苗具有更優的免疫原性,但其中活菌疫苗的安全性需要更為廣泛和長期的研究與評估[8]。相比之下,滅活疫苗的安全性更為可靠,且利于保存與運輸。分枝桿菌滅活疫苗始終在結核疫苗發展史上擁有一席之地,如RUTI與MIP兩款疫苗已在臨床試驗中展示出良好效果[9]。
本課題組前期成功構建并選育的新型結核病疫苗菌株B/R菌株[10],是以BCG菌株與H37Ra菌株為親本菌株,利用原生質體與電穿孔技術融合而成的結核桿菌融合菌株。目前已完成安全性[11]、生物特性與遺傳性狀[12]方面的研究,并以實驗證實該菌株在免疫小鼠后,可建立較高水平免疫記憶與短期保護效力[13]。為進一步探索B/R菌株滅活后建立小鼠免疫記憶的能力,研究滅活B/R菌株作為結核病疫苗的可能性,本研究以滅活B/R菌株為實驗對象,探討其對小鼠T淋巴細胞免疫記憶的影響。
1 材料與方法
1.1 材料
1.1.1 菌株種屬 BCG菌株購自中國食品藥品檢定研究院,B/R菌株由本實驗室構建并保存。
1.1.2 實驗動物雌性 C57BL/6小鼠,6~8周齡,購自新疆醫科大學實驗動物中心,于石河子大學醫學院實驗動物中心集中飼養。小鼠適應性飼養1周無異常后,開展實驗。所有研究方法依照國家實驗動物學會的有關要求進行開展,實驗方案已通過石河子大學動物實驗倫理委員會批準。
1.1.3 主要試劑 1640培養基購自Thermo Fisher公司;胎牛血清購自Hyclone公司;小鼠脾臟淋巴細胞分離液購自北京索萊寶生物科技有限公司;Anti-MouseCD4-PE、Anti-Mouse CD8a-PE、Anti-Mouse CD44-PE Cy5.5與Anti-Mouse CD62L-FITC購自Cell Signaling Technology公司。
1.2 方法
1.2.1 菌株處理與滅活 將保存在-80 ℃冰箱的BCG菌株與B/R菌株取出,置于生物安全柜中自然解凍至常溫。將BCG菌株與B/R菌株分別接種至新制的改良羅氏培養基斜面上,置于37 ℃隔水式恒溫培養箱中培養,傳代3次后選擇生長狀態良好的菌株用于實驗。取適量菌株充分研磨,而后以PBS進行稀釋,期間利用細菌比濁儀檢測懸液濃度,將各菌株懸液濃度調整為1×107cfu/mL。將制備完成的懸液置于干式恒溫儀中,在100 ℃,30 min條件下[14],制備滅活的菌株懸液。
1.2.2 動物分組與疫苗免疫 將小鼠隨機分為PBS組、BCG組、B/R組與滅活B/R組,每組9只。取各實驗組菌株0.1 mL懸液(即1.0×106cfu),通過背部皮下注射,以單次免疫的接種方案分別免疫各組小鼠,PBS組注射0.1 mL PBS作為陰性對照。
1.2.3 分離小鼠脾臟淋巴細胞 在免疫小鼠后第9周、第12周與15周,無菌條件下取各組小鼠脾臟,制備脾臟單細胞懸液。小心吸取單細胞懸液于淋巴細胞分離液上,注意保持液面界限清晰。室溫條件下,懸液以水平轉子800 g離心,20 min。緩慢吸取第2層環狀乳白色液體層,至無菌的15 mL離心管中,向其中加入10 mL的細胞洗滌液,250 g離心10 min。棄上清,加入PBS重懸細胞,250 g離心10 min,2次。1 mL PBS重懸細胞,細胞計數后將細胞濃度調整為1×107個/mL。
1.2.4 流式細胞技術檢測 免疫后淋巴細胞的分型及數量比例分別取各組100 μL細胞懸液至標記好的1.5 mL離心管中,按照實驗設計分別加入CD4、CD8a、CD44與CD62L熒光標記抗體,4 ℃,避光孵育30 min。孵育完成后,向管中加入1 mL PBS,4 ℃,300 g離心5 min,棄上清,重復2次。最后加入500 μL PBS重懸細胞,準備流式上機檢測。檢測時設置空白管與抗體單標管,用以調節相關參數。實驗遵從以下設門原則:設置P1門用于淋巴細胞分選,設置P2門用于分選CD4+、CD8+細胞,通過檢測CD62L,CD44的表達情況,區分中央型T淋巴細胞TCM(CD62L高表達,CD44高表達)與效應型T淋巴細胞TEM(CD62L低表達,CD44高表達)細胞數量水平。
1.2.5 流式細胞技術檢測 免疫后經PPD刺激淋巴細胞的分型及數量比例提取各實驗分組的小鼠脾臟淋巴細胞,置于24孔培養板中,單孔置入細胞數為5×106個。向每孔內分別加入20 μL anti-CD28mcAb工作液和終濃度為10 μg/mL的結核菌素純蛋白衍生物(PPD),再添加RPMI-1640完全培養基至1 mL。細胞培養箱中37 ℃,5% CO2中培養72 h后,收集各組脾臟淋巴細胞,4 ℃,300 g,離心5 min,棄上清,加入100 μL PBS重懸細胞。后續抗體孵育、上機操作與設門原則同上所述。
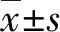
2 結 果
2.1 免疫后各組小鼠CD4+TCM與TEM細胞水平 流式細胞技術檢測結果顯示,免疫小鼠后第9周、第12周與第15周,在CD4+T細胞分型中,各實驗組TCM(F9周=13.2,F12周=15.97,F15周=15.4,P<0.05)和TEM(F9周=28.15,F12周=13.6,F15周=7.435,P<0.05)細胞比例均顯著高于PBS組(圖1),這與前期的研究結果相符。B/R組、滅活B/R組與BCG組相比,在免疫后不同時間點檢測出CD4+TCM細胞比例差距較小。滅活B/R組僅在第12周時CD4+TEM細胞比例高于BCG組與B/R組,但差異無統計學意義。各實驗組免疫小鼠后不同時間CD4+TCM和TEM細胞占比均保持在較高水平, BCG組、B/R組與滅活B/R組組間差異無統計學意義。
2.2 免疫后各組小鼠CD8+TCM與TEM細胞水平 對于CD8+T細胞而言,在免疫后不同時間點,各實驗組CD8+TCM(F9周=8.924,F12周=5.524,F15周=6.574,P<0.05)和TEM(F9周=6.13,F12周=20.15,F15周=9.268,P<0.05)細胞比例均顯著高于PBS組(圖2)。在第9周、第15周與第12周時,各實驗組CD8+TCM和TEM細胞占比差異較小,兩組間比較差異無統計學意義。滅活B/R組僅在第15周時,CD8+TCM細胞比例稍高于BCG組,但此時差異無統計學意義。
2.3 免疫后經PPD刺激各組小鼠CD4+TCM與TEM細胞水平 免疫第9周、第12周與第15周后再經特異性抗原PPD刺激,滅活B/R組、B/R組與BCG組較PBS組相比CD4+TCM(F9w=9.659,F12周=9.326,F15周=39.88,P<0.05)與TEM(F9周=11.2,F12周=6.936,F15周=11.93,P<0.05)細胞比例高出的差異均有統計學意義(圖3)。除12周時CD4+TCM外,滅活B/R組在其余各時間點的CD4+TCM與TEM細胞比例均高于BCG組,但差異均無統計學意義。總體而言,在以上3個時間點免疫小鼠后再經PPD刺激,BCG組、B/R組與滅活B/R組3者間CD4+TCM與TEM的差異,均無統計學意義。

圖3 免疫后不同時間點再經刺激,各組小鼠淋巴細胞CD4+ TCM與TEM水平)
2.4 免疫后經PPD刺激各組小鼠CD8+TCM與TEM細胞水平 免疫第9周、第12周與第15周后再經特異性抗原刺激,BCG組、B/R組與滅活B/R組與PBS組相比,CD8+TCM(F9周=7.242,F12周=67.71,F15周=138.8,P<0.05)和TEM(F9周=9.295,F12周=10.86,F15周=38.47,P<0.05)差異均有統計學意義(圖4)。值得注意的是,在第15周時,滅活B/R組與B/R組的CD8+TCM(q滅活B/R=12.24,qB/R=12.61,P<0.05)與TEM(q滅活B/R=7.191,qB/R=4.997,P<0.05)細胞比例均顯著高于BCG組。第9與12周,各實驗組間CD8+TCM與TEM水平差異無統計學意義。第15周時,滅活B/R組與B/R組間CD8+TCM與TEM水平差異無統計學意義。

圖4 免疫后不同時間點再經刺激,各組小鼠淋巴細胞CD8+ TCM與TEM水平)
3 討 論
了解預防疾病或初始感染所需的免疫反應,是開發有效疫苗的關鍵[15]。結核病的發病機制是一個復雜的過程,涉及宿主免疫系統和細胞因子間的相互作用。首先,固有免疫在抵抗MTB感染中發揮著重要作用[16-17]。巨噬細胞作為首道防線,只有在數量眾多且干預及時的情況下才能控制MTB的感染[18],否則將會淪為MTB胞內寄生的庇護所。當感染蔓延至淋巴結,適應性免疫啟動。體液適應性免疫在結核病中的作用具有不確定性[19-20],機體抵抗MTB的感染由細胞免疫起決定性作用。依據表面抗原的不同,T細胞被分為CD4+與CD8+兩大亞群。由于CD4+T細胞耗竭,HIV患者感染結核病的風險是單獨感染結核病的15~20倍[21],這足以證明CD4+T細胞在結核病免疫中的關鍵作用。以往一般認為CD8+T細胞在控制MTB的感染中沒有作用,但這是不正確的。CD8+T細胞通過組織相容性復合物Ⅰ類分子識別MTB感染,并產生多種細胞因子參與免疫反應。事實上,BCG對CD8+T 細胞的誘導不足被認為是其保護效果較差的主要原因之一[22]。
機體應對慢性感染性疾病時,免疫記憶由經抗原初次刺激后產生的記憶性T細胞主導,該細胞具有自我更新能力可持續存在,再次受到同一抗原入侵時即刻發動[23-24]。記憶性T細胞可分為TCM和TEM兩類細胞,前者長期存在于機體內,參與免疫應答過程,后者生存時間較短但具有更強的免疫原性。再次接觸相同抗原時,增殖能力較強的TCM可迅速分化為效用T淋巴細胞與TEM,TEM可快速啟動免疫應答。本實驗中,在未經刺激的小鼠脾臟淋巴細胞CD4+T細胞流式結果中,滅活B/R組與B/R組間CD4+TCM、TEM的水平差異沒有統計學意義。結果顯示,免疫小鼠后第9周、第12周與第15周,滅活B/R組、B/R組與BCG組CD4+TCM和TEM細胞數量差異不大且差異在各時間點內均無統計學意義。總體來看,滅活B/R菌株與B/R菌株誘導小鼠產生CD4+TCM和TEM的效力與BCG菌株相當,這與前期研究結果并不一致。本次實驗中B/R菌株未展現出在檢測后期CD4+TEM顯著高于BCG菌株的結果,各實驗組菌株所誘導產生的CD4+TEM,均保持在較高水平。
能否誘導T淋巴細胞在機體內的特異性免疫應答是評價結核病疫苗的首要標準[17],其具體表現為機體的免疫記憶水平。免疫記憶指再次感染相同抗原,引起較初次感染更為快速且強烈的免疫應答[25]。在本研究中,免疫小鼠后第9周、第12周與第15周,分離淋巴細胞經體外PPD刺激,滅活B/R組、B/R組與BCG組所產生CD4+和CD8+的TCM和TEM均顯著高于PBS組,證明滅活B/R組、B/R組與BCG組一致,均可誘導免疫記憶在二次應答中產生免疫保護反應。無論是CD4+或CD8+的TCM和TEM,在以上3個時間點內,各實驗組間差異均無統計學意義,表明滅活B/R菌株誘導細胞免疫的能力與B/R、BCG菌株基本相當,熱滅活未對B/R組的免疫原性造成損害。免疫后第15周,滅活B/R與B/R菌株可誘導與BCG相比更高水平的CD8+TCM和TEM,這與先前的研究一致[26]。有研究認為,BCG在誘導TEM上的不足是其保護效力隨年齡增長而減弱的原因[27-28],這提示滅活B/R與B/R菌株擁有較BCG更具優勢的免疫保護期限。
滅活疫苗在各類疾病的預防中應用廣泛,熱滅活在其他病原體上已有較多成功應用。在一定限度內,熱滅活一般不影響滅活產品的免疫原性[29-30]。本研究中滅活B/R菌株誘導免疫記憶的能力與B/R菌株相當,在研究后期甚至表現出優于BCG菌株的效力。綜上所述,我們證明了熱滅活不影響B/R菌株對小鼠T淋巴細胞免疫記憶的誘導,滅活B/R菌株可以促進高水平免疫記憶細胞的產生,并在保護期限方面可能更具優勢。
利益沖突:無

