非固定狀態下椎板重建對兔脊柱穩定性的影響
劉學鵬,孫甲樹,張引鋒,孫海燕*
1.陽光融和醫院骨科,濰坊 261000
2.淄博市第一醫院骨科,淄博 255200
脊柱融合術為治療脊柱疾病不可或缺的方法[1],但融合手術創傷較大[2],且易致融合節段活動功能喪失、融合失敗、鄰近節段退行性變(ASD)等問題[3]。單純開窗、半椎板切除或椎板切除減壓術不影響脊柱穩定性[4],但5%~ 40%的患者術后發生腰椎不穩甚至滑脫、硬膜外粘連和繼發性椎管狹窄等,甚至發生下腰椎術后失敗綜合征(FBSS)[5]。因此,研究預防椎板切除術后脊柱不穩的材料和手術方法對改善術后效果有積極意義。本研究用自體微小骨粒與不同比例的納米羥基磷灰石顆粒修復全椎板切除術后的兔椎板缺損,評估其組織相容性及對脊柱穩定性的影響,現報告如下。
1 材料與方法
1.1 實驗動物
選取48 只4 月齡新西蘭大白兔(山東魯抗實驗動物繁育中心,合格證號:SCXK-2022-0001),雌雄不限,體質量4.5~ 5.5 kg,平均分為4組,每組12只:A 組,自體微小骨粒植骨;B 組,自體微小骨粒與納米羥基磷灰石以3∶1 的比例混合后進行植骨;C組,自體微小骨粒與納米羥基磷灰石以1∶1 的比例混合后進行植骨;D 組,空白對照組,僅放置明膠海綿。動物實驗方案及實驗過程均通過濰坊市陽光融和醫院動物實驗倫理委員會審核批準。
1.2 實驗方法
術前動物禁食水6 h。用1%戊巴比妥鈉(30 mg/kg)耳緣靜脈注射麻醉,取俯臥位,以L5/L6為中心,術野去毛備皮,常規碘伏消毒皮膚,鋪無菌洞巾,切開皮膚及淺、深筋膜3~ 4 cm,鈍性分離骶棘肌,顯露L5棘突及椎板,咬骨鉗咬除L5棘突及上下棘突間韌帶,1 mm 槍狀椎板咬骨鉗咬除L5,6節段黃韌帶、L5全部椎板,在咬除椎板過程中需要確保關節突關節的關節囊完整性,造成骨缺損平均大小為8 mm×6 mm,全椎板切除動物模型建立完成。
用同一手術切口,牽拉皮緣,暴露其中一側髂骨,取髂骨(應注意保護走行于髂骨近端下方的腰骶神經,損傷后會出現下肢癱瘓),去除骨膜和軟骨,用尖嘴咬骨鉗將其咬碎成小骨粒(長寬高均為1~ 2 mm,目測體積與用尖嘴咬骨鉗咬碎的納米羥基磷灰石相仿,盡可能均勻)用作植骨。
選取合適大小明膠海綿捏成薄片狀,放入開窗處,在明膠海綿上方放入骨粒,須覆蓋椎板缺損處,總量約為3 g(將骨顆粒放在無菌單上,置于微量電子秤上稱重)。在植骨前將植骨處(L5,6節段)椎板去皮質化,使其滲血。A 組放入自體微小骨粒;B組自體微小骨粒和納米羥基磷灰石以3∶1 比例放入;C 組自體微小骨粒和納米羥基磷灰石以1∶1 比例放入;D 組只放明膠海綿。徹底止血后,留置引流管1 根并妥善固定,逐層縫合切口。術后碘伏消毒,無菌紗布包扎。術后單籠飼養,自由活動、常規喂食給水,觀察兔的精神狀態、生命體征、雙下肢感覺運動功能、二便功能、進飲食、體質量情況等。
術前給予頭孢唑啉鈉(13 mg/kg)靜脈注射1次,椎板切除前30 min 給予靜脈注射地塞米松1 mg,術后給予頭孢唑啉鈉(13 mg/kg)靜脈注射2 次(每24 h 1 次)。
1.3 觀察指標
術后3 個月每次每組隨機空氣栓塞法處死4 只動物,取出椎板缺損脊柱標本進行手觸檢查、生物力學檢測及組織切片檢查。
每組標本用10%福爾馬林液固定1 周,再用10%硝酸脫鈣2 周。將1.0 cm 椎板缺損脊柱標本均等分為3 段,分別脫水和石蠟包埋,每段橫切片2枚,厚7~ 10 μm,分別行HE 染色,光鏡觀察植骨區的成骨情況。
取L4~ S1節段標本,去除椎旁肌肉,保留韌帶、椎間關節和椎間盤,將標本上、下端用骨水泥進行包埋,置于-20℃冰箱保存。測試時解凍,使用CSS-44100 型材料測試機(實驗標準為GB 228-87)軸向加載,在壓頭上加接測試傳感器精確測力,模擬軸向壓縮、屈伸、側曲運動,每個標本每種測試方式重復3 次,取平均值,記錄載荷-形變曲線、載荷-位移曲線。同樣方法進行標本的強度和軸向剛度檢測[6-7]。
1.4 統計學處理
采用SPSS 17.0 軟件對數據進行統計分析,符合正態分布的計量資料以表示,組間比較采用獨立樣本t檢驗;以P< 0.05 為差異有統計學意義。
2 結果
A 組1 只動物因術后傷口感染死亡;C 組1 只動物不進食后死亡;均于1 周內補充。一般術后第2 天,所有動物均可進飲食,無精神萎靡、煩躁,雙下肢感覺、運動功能正常,二便正常,可站立、行走、搖尾,術后3 d 可跑、跳。術后7 d 切口愈合。術后3個月體質量皆有不同程度增加。
2.1 大體觀察
A、B、C 組大體標本新生椎板形態正常,骨質愈合,纖維組織增生連接,骨橋形成,植骨處骨痂愈合良好(圖1a~ c)。D 組為纖維結締組織愈合(圖1d)。
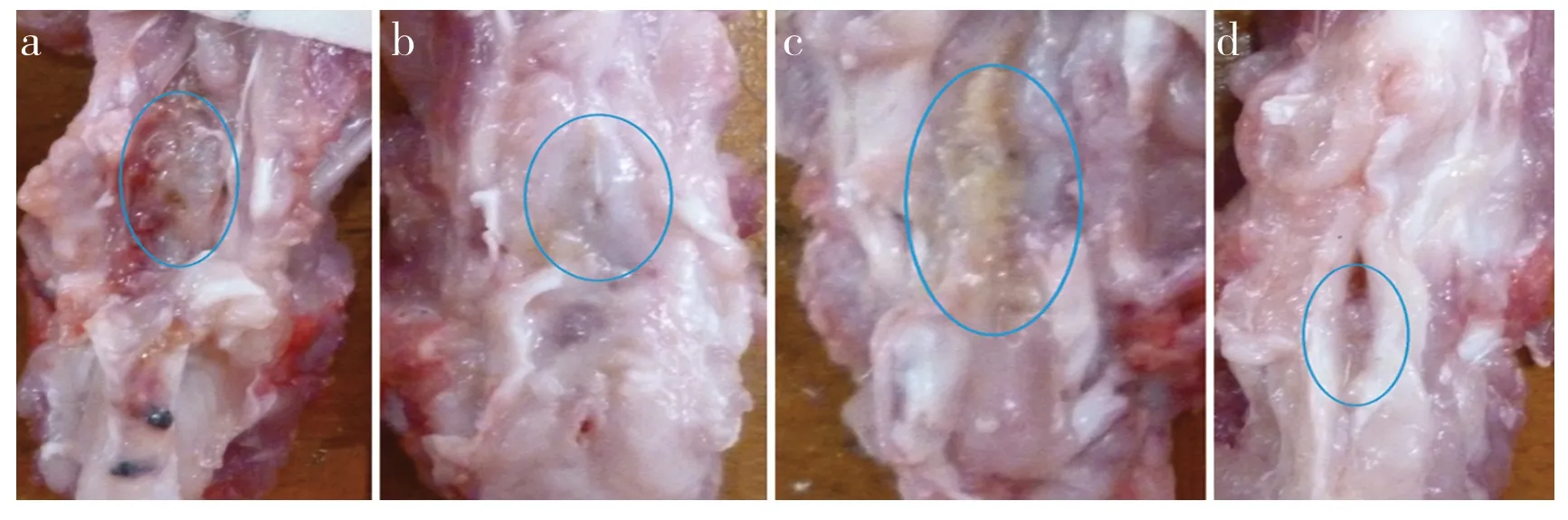
圖1 大體標本Fig 1 Gross specimen
2.2 組織學觀察
A 組可見少量幼稚軟骨細胞,較多的成熟軟骨陷窩細胞,過渡性骨小梁排列結構趨于正常,向板層骨過渡,骨髓腔貫通,可見大量髓細胞,無炎性反應(圖2a)。B 組自體髂骨與人工骨無明顯相互促進作用,也無抑制作用;可見較少量的幼稚軟骨細胞,以較幼稚的軟骨陷窩細胞為主,無過渡性骨小梁,炎性反應基本消失;纖維組織成熟、分化,納米羥基磷灰石孔隙中細胞長入,未完全降解,晶體數量減少,軟骨成骨更多,且趨向成熟骨(圖2b)。C 組成骨介于A 組與B 組之間,其新生軟骨及成骨較A 組少,較B 組多,較少的幼稚軟骨細胞,以成熟的軟骨陷窩細胞為主,過渡性骨小梁較少,炎性反應基本消失(圖2c)。D 組可見纖維結締組織增生(圖2d)。
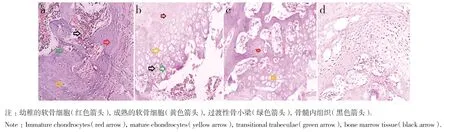
圖2 HE 染色(×100)Fig 2 HE staining(×100)
2.3 載荷與形變、位移的關系
載荷與形變呈非線性關系,表現出復合組織結構的力學性能。從載荷-應變曲線可發現3 個不同的變化過程:在力量較小時標本即出現形變,類似軟組織的力學表現;隨著力量的增加,展現出彈性材料的力學表現,表現為彈性形變;最后力量增大而形變減少,曲線斜率明顯增大(圖3)。載荷與位移基本呈線性關系,載荷-位移曲線基本呈不同斜率的直線(圖4)。
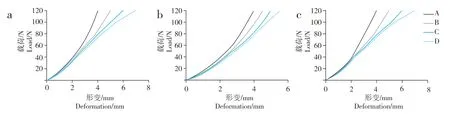
圖3 載荷與形變關系Fig.3 Relationship between load and deformation
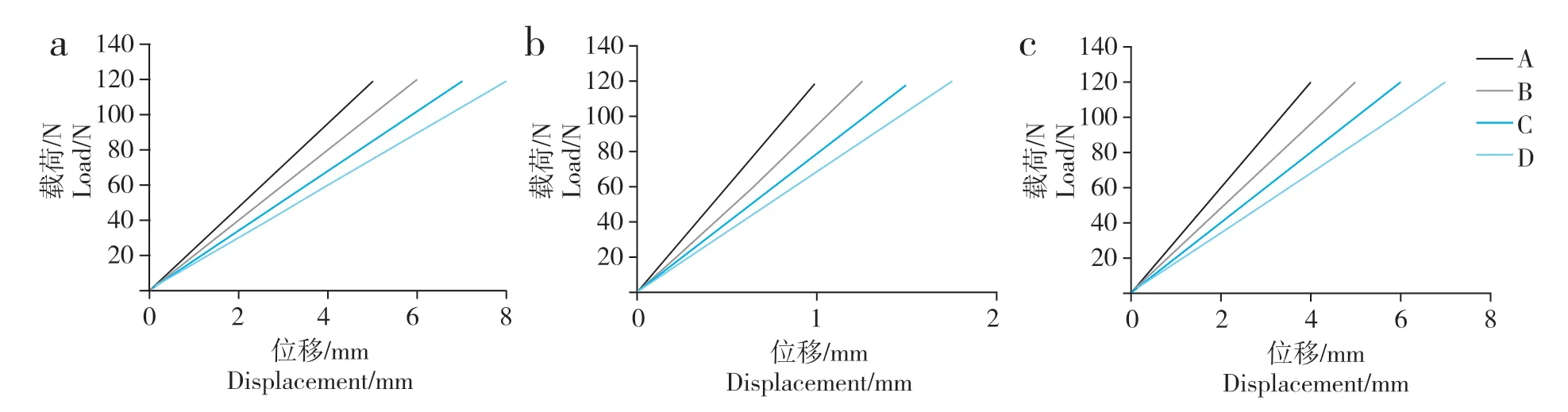
圖4 載荷與位移關系Fig.4 Relationship between load and displacement
2.4 植骨段的強度和軸向剛度
生物力學表明,A、B、C 組在植骨段強度及剛度方面差異無統計學意義(P> 0.05,表1);與D 組相比,差異均有統計學意義(P< 0.05,表1)。
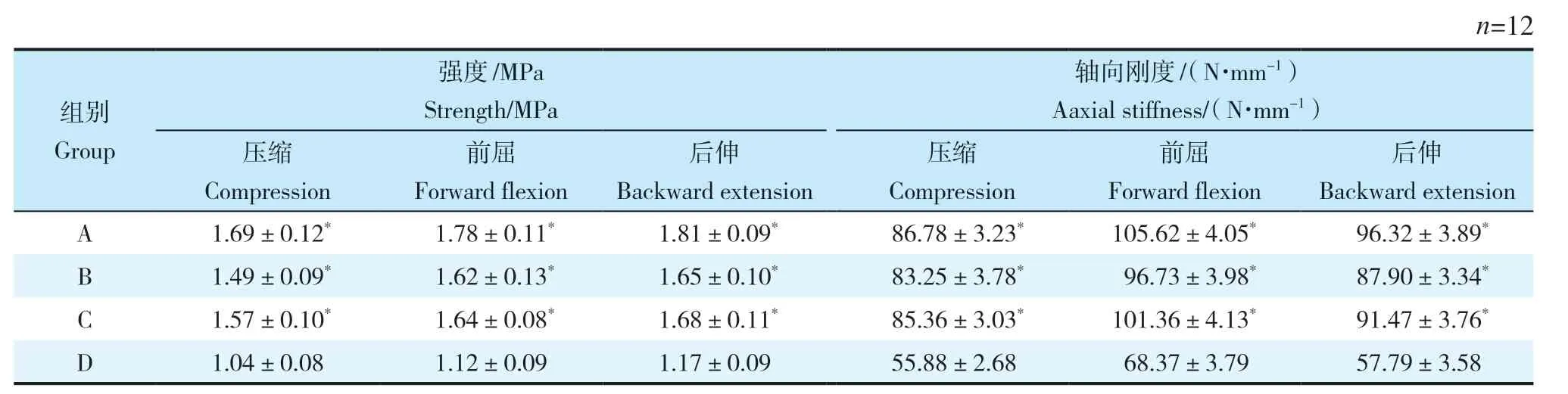
表1 120 N載荷下植骨段的強度和軸向剛度Tab.1 Strength and axial stiffness of bone graft segments under 120 N load
3 討論
理想的植骨材料應具備以下特點[8]。①具備骨傳導性,允許骨長入;②具備骨誘導因子,能誘導骨再生和修復;③植骨空隙中存活,且具備干細胞的分化潛能;④結構完整,具備一定的力學支撐特性。自體松質骨內含有豐富的骨髓干細胞、生長因子等[9],在明膠海綿等特定條件的誘導下可轉變為具有成骨活性的細胞[10],此類細胞在很多動物實驗中已被證實具有明確的成骨活性[11]、骨誘導、骨引導、骨傳導作用[12];故自體骨移植一直是植骨融合的金標準[13]。但自體骨來源有限,取骨增加出血量,延長手術時間,部分患者出現髂骨骨折、供骨區疼痛及神經損傷等并發癥[14]。同種異體骨雖來源豐富,但因各種弊端限制它只能作為自體骨量不夠情況下的一種補充[15]。近年來,隨著材料學的不斷發展,復合人工骨在植骨術中得到推廣[16]。
羥基磷灰石中的鈣磷結構接近于人體骨骼,納米羥基磷灰石具有與松質骨類似的互通的多孔支架結構,無抗原性,具有生物相容性[17],其力學性能可滿足臨床上骨組織修復的要求[18],其化學成分和表面特性可影響細胞的生存、附著、遷移分化和增殖[19]。骨移植后骨愈合的3個基本過程是移植物的血管化、新生骨形成及與鄰近骨質融合[20],血管化是關鍵環節,血管化程度與植骨修復效果呈正相關[17]。羥基磷灰石可在缺損處為修復早期的微血管形成及宿主骨細胞的附著提供支撐[14]。有研究[21]應用納米羥基磷灰石修復兔的橈骨缺損,可見植入材料內大量新生血管組織長入,并存在隨血液循環進入的間充質干細胞等在誘導因子的作用下分化為成骨細胞,并能產生新生骨組織加速骨愈合。本研究的組織學檢查也有相同發現,如新生血管長入及軟骨細胞生長,術后3 個月周圍纖維組織、軟骨組織與納米羥基磷灰石融合,且沒有明顯的排斥反應。
本研究還發現,隨著自體骨比例的降低,融合的成功率及生物力學指標也均有下降,并且炎性介質增加。也有研究[22]報道,單獨應用納米羥基磷灰石進行植骨,2、4、6、10 周時均未觀察到骨融合,組織學觀察成骨效果亦不如自體骨,說明納米羥基磷灰石材料本身雖具有仿生骨的構架,有骨傳導性,但其成骨效果欠佳;其作用機制是誘導干細胞長入,促進細胞因子附著和增生,逐漸分化為新生骨組織,同時,納米羥基磷灰石逐漸分解,最終被新生骨組織替代[23]。且本研究未采取制動措施,植骨顆粒與植骨床之間可能存在微動,也可能影響植骨融合的效果。但Nagel 等[24]在羊后路椎板融合研究中發現,腰椎關節的融合率為100%,而腰骶關節的融合率為0,L5/L6節段平均位移1.2 mm,產生10%應變,認為椎板間輕微位移不會對植骨融合產生影響。Evans[25]認為,理想的植骨區力學環境應遵循:①作用于植骨塊和宿主骨的載荷不能超過兩者所能承受的最大載荷;②植骨區應受到適當的應力刺激,可以存在微動關系,但不能有顯著運動,且愈合前不應存在張應力。本研究術后3 個月植骨組均愈合良好,因此,推測植骨愈合不僅需要一定的植骨環境,也需要一定的應力刺激。
有研究[26-28]表明,后方韌帶復合體(PLC)對脊柱有顯著的穩定作用,可以限制脊柱的過度屈伸。本研究結果顯示,與未植骨組(D 組)相比,植骨組(A、B、C 組)的屈伸、壓縮、拉伸應力均較高,表明椎板重建能增加脊柱的穩定性;也從另一個方面說明,椎板切除對腰椎PLC 的生物力學影響較大,這與Kim 等[29]的研究結果一致。分析其原因,椎板重建恢復了腰椎的后張力帶,并重建了腰椎PLC 結構,其中椎板可抵抗軸向旋轉,后側張力帶可抵抗屈曲運動。Merter 等[30]的研究表明,FBSS 的發生可能是由于PLC受損后脊柱后部結構失去了對壓縮力的阻力,大部分壓縮力轉移到椎間盤。Li 等[31]的研究表明,保留PLC 可減少減壓節段的椎間盤應力。Huang 等[32]發現,在后路腰椎椎間融合術中保留PLC 可有效預防ASD 的發生。此外,另一項研究[33]也發現,椎板切除術本身也會導致ASD。因此,結合本研究的生物力學數據可以推斷,椎板重建可以通過恢復脊柱后部結構來預防ASD,減輕減壓節段的椎間盤應力[17]。相關研究[34]還表明,椎板切除術后椎板重建對關節活動度的影響較小,說明重建椎板不僅可以重建脊柱的穩定性,還可保留脊柱小關節的原始關節活動度。
本研究結果表明,全椎板切除術后行椎板重建可增加脊柱穩定性,且新生椎板的生物學特性不僅符合椎板的力學需求,還有很好的生物相容性及骨誘導性,具有廣泛的應用前景。但本研究樣本量較小,實驗時間短,動物模型力學性能與人體存在差異,且缺乏在臨床實踐中的驗證,結論仍需進一步探討、研究。

