阻塞性睡眠呼吸暫停致日間過度嗜睡患者多導睡眠監測特點分析
惠培林 范 杰 馬 薇 張尚麗 李 淵 謝宇平
(甘肅省人民醫院睡眠醫學中心/甘肅省睡眠臨床醫學研究中心,蘭州,730000)
阻塞性睡眠呼吸暫停(Obstructive Sleep Apnea,OSA)是最常見的睡眠呼吸障礙,其臨床特征是睡眠中間歇性呼吸暫停,導致間歇性大腦缺氧、高碳酸血癥、睡眠片段化、胸內壓力波動和交感神經活動增加[1],進而引起日間嗜睡和認知功能損害。在美國,OSA的總體估計患病率為輕度10%,中度至重度為4%~6.5%,在老年人中,這一比例高達30%~80%[2]。我國一項薈萃分析結果提示,OSA發病率為3.93%[3]。青中年人的OSA與日間過度嗜睡(Excessive Daytime Sleepiness,EDS)[4]、高血壓、冠心病、充血性心力衰竭、中風以及多種炎癥和代謝疾病相關[1]。OSA引起的EDS,更是造成交通和工作事故、學習和工作效率低下等問題的常見直接原因。更重要的是,Pan等[5]認為,OSA患者的睡眠片段化和/或間歇性低氧可能導致神經退行性病變,導致認知功能受損[6-7]。在中年人中,OSA通常與注意力、記憶力和執行功能的輕度損害有關。在老年人中,OSA與輕度認知功能損害或阿爾茨海默病的發展有關。而在所有年齡段中,OSA和神經退行性疾病的生物標志物之間都有聯系。長期暴露于間歇性缺氧、白天過度嗜睡、睡眠碎片等的OSA病理生理導致認知功能受損[2]。Sharma等[8]納入208例老年志愿者,發現OSA指數的嚴重程度與腦脊液Aβ42的年變化率相關,提示OSA可促進認知功能障礙的發生和發展,認知功能的損害加重人群老齡化和增加社會負擔。EDS是一種公共健康危害,即使在已經診斷為OSA的患者中,EDS仍然診斷不足和治療不足[9-10]。EDS通常使用標準驗證工具Epworth嗜睡量表(ESS)定義,評分范圍從0~24分[11],其閾值得分大于10分[12],是OSA最常見的報告癥狀之一,同時伴有疲勞和神經認知功能障礙(例如注意力受損,情緒變化主要包括易怒性增加)[13-14]。ESS是一種常用的主觀問卷,在8種不同的日常情景下,以0(從不)到3(打盹的可能性高)的等級記錄患者自我報告的入睡可能性[15]。在大量臨床樣本中的驗證表明,ESS提供了白天嗜睡的準確測量,在所有患者中都有類似的解釋[16],項目反應理論分析證實了ESS作為嗜睡傾向測量的可靠性[17]。然而,在某些臨床情況下,將嗜睡作為唯一測試的主觀測量可能不可靠[18]。例如,患者對慢性睡眠剝奪的感知的已知適應可能會導致主觀睡眠質量和客觀睡眠評估之間的差異(即,與客觀測量比較,對睡眠的感知較差,或在客觀睡眠中斷時感知良好)[19]。忽視嗜睡癥狀的能力有助于解釋為什么EDS仍然被診斷不足和報告不足,以及ESS評分與AHI或客觀測量(如多次睡眠潛伏試驗,MSLT)之間的相關性差[20]。而對于相同程度的OSA,在臨床中白天嗜睡的程度差異很大,其機制目前尚不清楚。這就提出了一個重要的問題,即為什么有些患者會出現困倦嗜睡,而另一些患者卻不會出現困倦嗜睡。基于此,本研擬從睡眠結構特點出發,分析OSA伴EDS患者睡眠結構特點。現報道如下。
1 資料與方法
1.1 一般資料 選取2021年8月至2022年8月在甘肅省人民醫院睡眠醫學中心就診的OSA伴EDS組42例作為觀察組,選取OSA不伴EDS組46例作為對照組。觀察組平均年齡(43.14±14.75)歲,對照組平均年齡(43.14±14.75)歲。本研究經醫院倫理委員會審批通過。
1.2 納入標準 1)符合中國醫師協會睡眠醫學專業委員會2018年修訂的《成人阻塞性睡眠呼吸暫停診治指南》診斷標準OSA者,包括新診斷且未使用任何治療措施的OSA者,OSA合并CPAP治療半年以上者,OSA合并外科手術后3個月者;2)年齡18~70歲之間者;3)日間嗜睡癥狀者(ESS評分≥12);4)對本研究知情同意,并簽署知情同意書者。
1.3 排除標準 1)長期吸煙、飲酒史,長期喝咖啡、濃茶影響睡眠者;2)有嚴重肺部疾病,如重度哮喘、支氣管擴張、慢阻肺、重度肝損害、急性各種感染等影響到PSG及常規檢查等各項結果的疾病者;3)嚴重冠脈疾病者、心臟或外周介入手術后者;4)其他類型的呼吸暫停如中樞型、混合型等者;5)長期服用鎮靜安眠類藥物者;6)認知能力惡化癥狀者(簡明智力狀態量表評分低于24分);7)夜間癥狀較嚴重而無法堅持完成PSG者;8)睡眠障礙國際分類(ICSD-3)中定義的發作性睡病者;9)失眠者;10)未簽署知情同意書者。
1.4 治療方法
1.4.1 監測方法 采用美國飛利浦偉康生產的Alice5 PSG系統在甘肅省人民醫院睡眠醫學中心進行;選擇安靜、舒適、無干擾、溫度適宜的睡眠監測室內進行整夜PSG。
1.4.2 睡眠分期判讀標準 根據美國睡眠醫學會最新修訂的《睡眠及其相關事件判讀手冊-規則、術語和技術規范》(2.6版),由接受專業培訓并獲得美國睡眠醫學會認證的國際多導睡眠注冊技師(RPSGT)認證的同一名睡眠技師完成睡眠分圖。
1.4.3 睡眠參數定義 本研究所使用的睡眠指標如下:1)AHI:呼吸暫停低通氣指數[(呼吸暫停次數+低通氣次數)×60/TST];2)總睡眠時間(TST):監測后所有睡眠時間;3)夜間LSpO2:夜間最低血氧飽和度;4)夜間ASpO2:夜間平均血氧飽和度;5)睡眠效率:總睡眠時間/臥床時間;6)睡眠潛伏期:從關燈至第1幀任何睡眠期的時間;7)覺醒指數:每小時覺醒次數;8)各期睡眠比:NREM1、2、3和R期睡眠占總睡眠時間的百分比。
1.4.4 睡眠監測要求 睡眠監測當晚午后不飲酒、茶、咖啡和可樂等影響睡眠的飲品。為排除首夜效應,所有受試者在同一睡眠監測室用同一方法進行連續兩晚的整夜PSG監測,本研究均采用第二晚的睡眠監測數據。

2 結果
2.1 2組患者一般資料比較 OSA合并EDS組、OSA不伴EDS組性別、年齡和體質量指數(BMI)差異均無統計學意義(均P>0.05),ESS嗜睡量表評分有統計學意義(P<0.001)。見表1。

表1 2組患者一般資料比較
2.2 整夜睡眠參數 OSA伴EDS組和OSA不伴EDS組總睡眠時間、NREM1期睡眠比、NREM3期睡眠比和平均SpO 2差異均無統計學意義(均P>0.05)。OSA伴EDS組AHI、總睡眠時間、N1、N2占比都高于不伴有嗜睡組,差異無統計學意義(P>0.05)睡眠效率;OSA伴EDS組夜間LSpO2、夜間ASpO2、睡眠潛伏期、睡眠效率、N3、R占比都低于不伴有EDS組,覺醒指數高于不伴有EDS組,其中夜間LSpO2、睡眠潛伏期、覺醒指數、N3、R占比差異有統計學意義(P<0.05)。見表2。
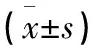
表2 2組患者PSG比較
3 討論
OSA是一個公認的健康問題,影響全球近10億人,其患病率正在增加,各國之間的差異很大[21],睡眠期間反復發作的部分或完全咽部塌陷是阻塞性睡眠呼吸暫停(OSA)的特征[12],主要可表現為睡眠中大聲打鼾、呼吸暫停、憋醒或窒息感、白天嗜睡、疲勞以及引起失眠[22]。其中許多阻塞性睡眠呼吸暫停(OSA)患者經歷過多的白天嗜睡(EDS),這會對日常功能、認知、情緒和其他方面的健康產生負面影響[23-26]。例如,OSA患者的EDS與機動車和職業事故風險增加[27-28]以及抑郁和焦慮的患病率增加[29-30]有關。OSA和EDS患者,無論是否接受治療,都可能表現出注意力、記憶力和高階執行功能受損[31-32]。神經影像學研究顯示,EDS可能是OSA的一個突出癥狀,當困倦侵入日常生活活動時會發生[33-34]。盡管一級OSA治療(如持續氣道正壓(CPAP)治療)可以降低EDS,但盡管接受了OSA的優化治療,仍有相當比例的患者繼續經歷EDS。
本研究以睡眠結構層面為切入點,對OSA伴EDS患者和OSA未伴EDS患者的PSG進行比較。從PSG數據中發現,比較2組間總睡眠時間、睡眠效率、N1期占比、N2期占比,以及夜間ASpO2,發現2組患者并無明顯差異,但2組在夜間LSpO2、睡眠潛伏期、覺醒指數、N3期及R期睡眠占比上差異均有統計學意義,OSA伴EDS組患者夜間血氧飽和度、N3期及R期占比均明顯低于OSA不伴有EDS患者組,而覺醒指數明顯高于不伴EDS組。綜上可知,OSA伴EDS患者與OSA不伴EDS患者比較,PSG中睡眠結構破壞更加嚴重。本研究中OSA伴EDS共病患者存在淺睡眠占比增多,而深睡眠占比減少,覺醒次數多,夜間缺氧更重,該結果與已有研究結果相一致[35-36]。既往研究表明,低氧和高碳酸血癥引起的下丘腦食欲素神經元活性的抑制被認為是OSA中EDS的一種因果機制[37-38]。大鼠研究表明,急性缺氧/高碳酸血癥會使食欲素神經元迅速失活,這可能導致OSA患者食欲素神經功能受損[37]。食欲素是在睡眠-覺醒周期調節中發揮重要作用的神經肽,有助于維持清醒狀態和快速眼動(REM)睡眠[39-42]。實驗性危險因素包括慢性間歇性缺氧和睡眠碎片,這會導致神經元的氧化損傷和腦回路連通性的改變,包括大腦覺醒促進區的去甲腎上腺素能和多巴胺能神經傳遞。EDS的多因素病理生理機制涉及慢性周期性缺氧-復氧對多巴胺能和食欲能神經元的影響、氧化應激、全身炎癥、大腦負責維持警覺區域的神經元損傷、遺傳因素和睡眠碎片。呼吸暫停和低通氣通常以睡眠喚醒結束,這允許上氣道重新打開,恢復正常呼吸[43]。使用間歇性低氧干預的實驗小鼠模型涉及細胞損傷和凋亡,以響應炎癥和氧化應激途徑的激活,導致大腦負責覺醒和睡眠調節的區域的永久性神經元損傷[44-45]。這些受損區域與即使在恢復到正常的環境后仍持續嗜睡有關。OSA患者反復出現的覺醒誘導的睡眠碎片可以改變睡眠的循環結構[44]。睡眠碎片化和缺氧-復氧循環可能會誘發炎癥和氧化應激,從而改變喚醒激活神經元的健康[45-46]。
本研究通過對OSA及OSA伴EDS患者的主觀及客觀睡眠進行分析比較,獲得OSA伴EDS患者的睡眠結構特征。但本研究也存在一定局限性,如樣本量過小,患者均來自于甘肅,可能存在地域海拔影響,且并未對AHI值進行分度及對夜間低氧分布進行亞組分析等。通過本研究,我們應更加重視OSA伴EDS這一廣大的患者群體,積極改善患者OSA及白天嗜睡癥狀,進而防止患者睡眠呼吸暫停進程及日間嗜睡加劇,從而誘導更多健康及社會生活安全問題,更好地提高此類患者生命質量與身心健康。
利益沖突聲明:無。

