黃瓜Hsp70 基因家族的泛基因組分析



摘 要: 黃瓜(Cucumis sativus L.)是世界范圍內廣泛種植的重要蔬菜作物。熱激蛋白(Heat shock protein, Hsp)基因Hsp70 亞家族被認為是參與植物熱激反應最重要的分子伴侶蛋白。然而,Hsp70 基因在黃瓜中的功能卻知之甚少。黃瓜泛基因組的建立,為充分挖掘遺傳變異資源和黃瓜遺傳育種提供了平臺資源和信息。本研究通過生物信息學技術對基于11個不同黃瓜品系(包括3個野生種以及8個栽培種)的泛基因組中的Hsp70基因進行鑒定與分析,共鑒定到12個CsHsp70s 基因,其中在這些品系中共有的基因是9 個,蛋白質序列長度、基因結構和保守蛋白基序完全一致的共有基因有5 個(CsHsp70-1, CsHsp70-2, CsHsp70-7, CsHsp70-8, CsHsp70-11),表明其在不同黃瓜品系中的功能可能是保守的;另外4 個共有基因(CsHsp70-3, CsHsp70-4, CsHsp70-5, CsHsp70-12)在不同黃瓜品系中的基因結構、蛋白質序列長度以及保守蛋白基序并不完全相同,說明其在不同黃瓜品系中的功能可能具有多樣性。同時,還鑒定到3 個非共有基因(CsHsp70-6, CsHsp70-9, CsHsp70-10),非共有基因的出現是由于其在印度栽培種‘Hx14’中的缺失所致,這種基因‘丟失’的現象,可能與黃瓜漫長的馴化和育種過程相關。本研究為黃瓜Hsp70 基因的功能研究以及黃瓜耐熱性分子遺傳育種提供了參考和依據。
關鍵詞: 黃瓜;Hsp70;泛基因組;生物信息學
中圖法分類號: S642.2 文獻標識碼: A 文章編號: 1000-2324(2024)06-0826-10
隨著人口增長和工業發展,全球變暖已成為一個關乎人類未來生存和發展的重大問題[1,2]。世界氣象組織3 月19 日發布的《2023 年全球氣候狀況報告》顯示,2023 年是全球有氣象記錄以來的最熱年份,全球近地表平均溫度比工業化前水平高1.45 ℃,而最熱年份這一紀錄有可能在2024 年繼續被打破。黃瓜(Cucumis sativus L.)是世界上重要的蔬菜栽培作物[3],起源于喜馬拉雅山南麓的熱帶雨林地區以及印度北部地區[4],生長最適溫度為25~30 ℃,高溫脅迫會引起黃瓜葉片和莖稈枯萎,從而影響黃瓜的正常生長、光合作用和果實品質[5]。
熱激蛋白(Heat shock protein, Hsp)被認為是熱激反應的核心,在提高植物耐熱性方面發揮關鍵作用[6]。作為分子伴侶蛋白,Hsps 已被證明參與多種非生物脅迫(如高溫、干旱),對于重建細胞平衡非常重要[7]。植物中的Hsp 可分為五個亞家族,包括小Hsp(sHsp;即Hsp10,Hsp20 和Hsp40),Hsp60,Hsp70,Hsp90 和Hsp100 家族[8]。其中,Hsp70 被認為是最高度保守的Hsps,在大多數植物中作為主要的分子伴侶,保護細胞免受生物或非生物脅迫的不利影響[9]。在擬南芥中,Hsp70 的表達水平在高溫條件下會被顯著上調[10]。同時,熱處理明顯增加了AtHsp70-15 基因敲除突變體的死亡率,表明AtHsp70-15 在擬南芥的熱激響應中發揮著重要作用[11]。此外,擬南芥中的Hsp70-16 與VDAC3 相互作用,促進VDAC3 離子通道的開放,從而影響ABA從胚乳到胚的外流,進而對冷脅迫下的種子萌發產生負調節作用[12]。辣椒中的CaHsp70-2 的異源表達可調節轉基因擬南芥中與脅迫相關基因的表達,并增強其耐熱性[13]。CaHsp70-1 作為細胞質Hsp70 亞家族的成員,可能通過包括Ca2+、H2O2和Put 的信號轉導途徑參與熱激防御響應[14]。此外,Hsp70 還通過增強抗氧化能力來提高玉米對鹽和高溫脅迫的耐受性[15]。然而,到目前為止,關于黃瓜中的Hsp70家族的研究還較少。
近年來,隨著多種植物參考基因組的不斷公布以及同種植物不同個體基因組間的相互比較,研究人員逐漸認識到利用單一參考基因組來研究基因功能存在著一定的局限性,泛基因組的應用有力地解決了這一問題,同時,為研究植物進化、選擇與基因功能提供新思路[16]。泛基因組代表了一個物種基因組的多樣性,包括所有個體都有的共有基因和某些個體沒有的可變基因[17]。我國學者于2014 年首次公布了關于植物泛基因組的研究成果,基于對7 個野生大豆品系的全基因組比較,鑒定出大量與抗逆、抗病、花期和產油量等重要農藝性狀相關的基因和變異[18]。2022 年,研究人員首次構建了高質量的黃瓜泛基因組,為黃瓜重要基因挖掘和遺傳育種提供了重要資源和信息[19]。
本研究對包括11 個黃瓜品系的泛基因組中的Hsp70 家族進行鑒定,并對其蛋白質序列長度、保守蛋白基序、基因結構以及系統進化關系進行分析,以期為黃瓜Hsp70 家族基因功能研究及黃瓜耐熱性分子遺傳育種提供參考信息。
1 材料與方法
1.1 黃瓜Hsp70基因的確定
所選擇的11 個黃瓜品系包括3 個印度野生種(PI, W4, W8),2 個印度栽培種(Hx14,Hx117),3 個東亞栽培種(9930, XTMC, Cu2),2 個歐亞栽培種(Cuc37, 9110gt)以及1 個西雙版納栽培種(Cuc80);其中,栽培種‘9930’及野生種‘PI’基因組、基因和蛋白質序列文件從葫蘆科基因組數據庫(http://www. cucurbitgenomics.org/)下載;其它9 個品系的基因組文件及基因組注釋文件在National Center for BiotechnologyInformation(NCBI)數據庫(https://www. ncbi.nlm.nih.gov/)下載;基因組文件使用TBtools 軟件[20]提取CDS序列后翻譯成蛋白質序列文件備用;隨后,在Pfam 數據庫(http://pfam.xfam.org/)下載Hsp70(PF00012)的隱馬爾可夫模型(HMM)配置文件;使用HMMER 3.0 對黃瓜基因組數據庫中的Hsp70 進行檢索;刪除重復序列后,保留所有序列并提交到CDD(https://www.ncbi. nlm. nih. gov/cdd/)和 SMART(http://smart.embl-heidelberg. de/)在線網站,以再次確認Hsp70 的保守結構域。所有高置信度和非冗余基因都被重命名為黃瓜CsHsp70。
1.2 黃瓜Hsp70保守蛋白基序的確定
提取不同黃瓜品系中Hsp70 的蛋白質序列,使用MEME程序(5.0.4 版,http://alternate.memesuite.org/tools/meme)識別CsHsp70 蛋白序列中的保守基序,參數設置如下:重復次數不限,基序數最多為5 個,最大基序長度為6 至100 個氨基酸殘基。
1.3 黃瓜Hsp70基因結構的確定
提取基因在染色體上的外顯子及CDS位置信息,通過Gene Structure Display Server 在線網站 (http://gsds. cbi. pku. edu. cn/)分析所有的CsHsp70的基因結構。
1.4 黃瓜Hsp70系統進化樹分析
使用ClustalX(1.83 版)程序和默認參數對CsHsp70 蛋白質序列進行多序列比對。不同黃瓜品系中Hsp70s 的全長氨基酸序列上傳到MEGA(7.0 版)軟件中。序列比對采用ClustalW比對方法。然后使用鄰接法(Neighbor-Joining,NJ)根據比對結果構建系統進化樹[21]。
1.5 黃瓜Hsp70基因響應熱激的轉錄組分析
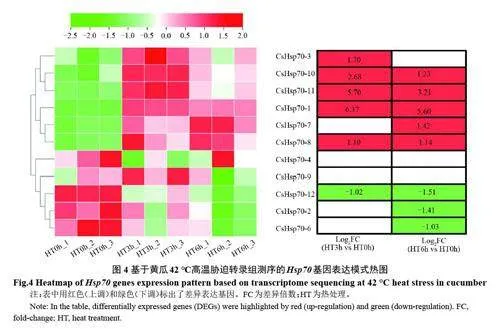
將中國農業科學院蔬菜花卉研究所顧興芳實驗室提供的用于黃瓜參考基因組測序的‘Chinese long’自交系9930 的幼苗在42 ℃下熱激處理,分別于處理后0、3、6 h 取幼苗葉片在諾禾致源公司進行轉錄組測序[22]。測序數據已提交至GEO 數據庫,登錄號為GSE151055。進行了三次生物學重復。對于CsHsp70s 的轉錄組分析,采用閾值FDR(或p 值)≤0.05 和絕對值log2(fold-change)≥1 來定義差異表達基因(DEGs)。使用TBtools 繪制CsHsp70s 基因在熱激下的表達水平的熱圖。
2 結果與分析
2.1 黃瓜Hsp70基因的鑒定
泛基因組研究可以得到物種全面且準確的變異信息。為了了解Hsp70 基因在11 個不同黃瓜品系中的變異情況,我們首先在全基因組范圍內鑒定了Hsp70 基因家族的成員。如表1 所示,所選擇的11 個黃瓜品系包括印度野生種3 個(PI, W4, W8),印度栽培種2 個(Hx14,Hx117),東亞栽培種3 個(9930, XTMC, Cu2),歐亞栽培種2 個(Cuc37, 9110gt),西雙版納栽培種1 個(Cuc80);其中,PI、W4 和 W8 屬于C.sativus var. hardwickii,被認為是栽培黃瓜的野生祖先[4,19]。
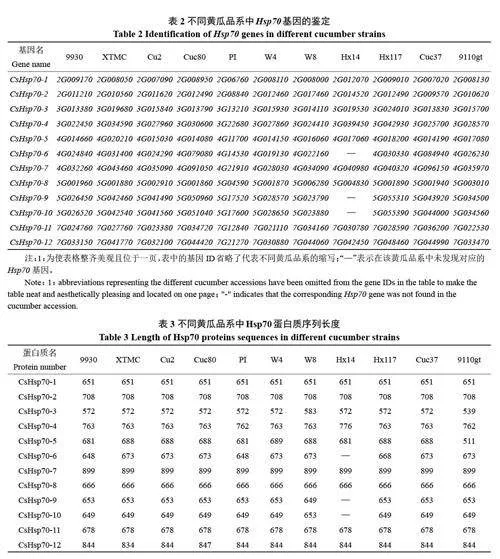
通過hmmer搜索以及在線數據庫比對,最終確定不同黃瓜品系中Hsp70 基因家族的成員組成。如表2 所示,一共鑒定到12 個成員,并按照其在染色體上的位置進行排序。其中,在所選的11 個黃瓜品系中都存在的基因有9 個;相應的,非共有基因有3 個(CsHsp70-6, CsHsp70-9,CsHsp70-10)。值得注意的是,非共有基因的出現是由于其在印度栽培種‘Hx14’中的缺失所致。
2.2 黃瓜Hsp70蛋白質序列長度統計及分析
為了全面了解不同黃瓜品系中CsHsp70 的基因特征,首先對所鑒定到的CsHsp70 蛋白質序列長度進行統計分析。如表3所示,僅有5個基因(CsHsp70-1, CsHsp70-2, CsHsp70-7, CsHsp70-8,CsHsp70-11)在所研究的11 個黃瓜品系中的蛋白質序列長度完全一致。有趣的是,這5 個基因都屬于共有基因,暗示著其在不同黃瓜品系中的功能可能是保守的。而另外4 個共有基因(CsHsp70-3, CsHsp70-4, CsHsp70-5, CsHsp70-12)則在不同黃瓜品系中的蛋白質序列長度出現差異,其中CsHsp70-5 的差異是最大的,暗示著其在不同品系中的功能可能是多樣的。另外,CsHsp70-3 和CsHsp70-4 的變異主要出現在印度種和歐亞種,而在東亞種以及西雙版納種是保守的。與此相反的是,CsHsp70-12 在印度種和歐亞種是完全保守的,變異出現在東亞種以及西雙版納種。3個非共有基因(CsHsp70-6, CsHsp70-9,CsHsp70-10),除了在印度栽培種‘Hx14’中完全缺失以外,在其他不同品系中也出現了不同程度的變異,尤其是在印度野生種‘W8’中變異最明顯。綜上所述,不同品系中CsHsp70 蛋白質序列長度不盡相同,這種有趣的現象可能與黃瓜的馴化和育種過程相關。
2.3 黃瓜Hsp70基因結構分析
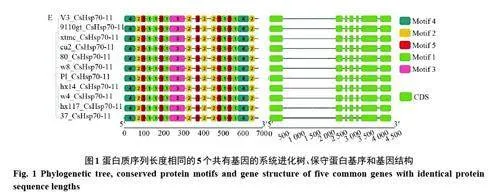
2.3.1 蛋白質序列長度相同的5 個共有基因的系統進化樹、保守蛋白基序和基因結構分析 為了全面了解不同黃瓜品系中CsHsp70 的基因特征,我們對所鑒定到的CsHsp70 基因結構以及保守蛋白基序進行系統分析。如圖1所示,不同黃瓜品系中蛋白質序列長度完全一致的5個共有基因(CsHsp70-1, CsHsp70-2, CsHsp70-7, CsHsp70-8,CsHsp70-11),同樣也在不同品系中具有相同的基因結構和保守蛋白基序,說明了這部分基因在馴化和育種過程中被完全保留下來,暗示著其可能具有控制著生命體基本代謝的功能。
2.3.2 蛋白質序列長度不同的4 個共有基因的系統進化樹、保守蛋白基序和基因結構分析 不同黃瓜品系中蛋白質序列長度不完全相同的4個共有基因(CsHsp70-3, CsHsp70-4, CsHsp70-5,CsHsp70-12),則展現出不完全一致的蛋白保守基序和基因結構(見圖2)。通過對其基因結構的分析發現,變異主要是由于不同品系中外顯子數目的差異所致。具體來看,CsHsp70-3 在歐亞栽培種‘9110gt’中有2 個外顯子,在印度野生種‘W8’中有3 個外顯子,而在其他品系中都只有1 個外顯子,從而導致了CsHsp70-3 在這兩個品系中的基因結構及蛋白結構發生變異。CsHsp70-4 的變異主要發生在印度栽培種‘Hx14’,與其它品系相比,其在起始密碼子上游增加了一個外顯子,導致了基因長度明顯增長,而不同品系中的保守蛋白基序并未發生明顯變化。CsHsp70-5 的變異主要出現在歐亞栽培種‘9110gt’,與其它品系相比,其5’端出現大片段缺失,致使其基因序列長度明顯變短,蛋白保守基序也出現明顯變化;另外,不同品系中CsHsp70-5 蛋白質序列的系統進化樹表明,CsHsp70-5 在不同品系中的蛋白質序列差異較大,主要可以分成3 個進化枝,東亞栽培種‘XTMC’和‘Cu2’在同一個分支,印度野生種‘PI’、‘W4’和東亞栽培種‘9930’在同一個分支,其余的6 個品系在同一個分支,以上結果表明,CsHsp70-5 基因可能具有不同的功能。CsHsp70-12 在不同品系中的基因結構并未發生明顯變化,只是在東亞栽培種‘XTMC’以及西雙版納栽培種‘Cuc80’中的保守蛋白基序發生改變。
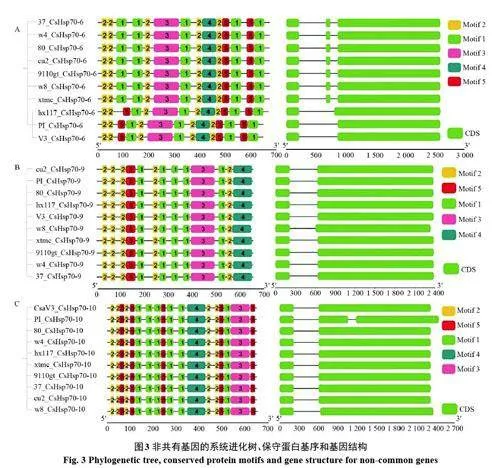
2.3.3 非共有基因的系統進化樹、保守蛋白基序和基因結構分析 3 個非共有基因(CsHsp70-6,CsHsp70-9, CsHsp70-10)除了在印度栽培種‘Hx14’中完全缺失以外,在其它品系中的基因結構及保守蛋白基序也不完全一致(見圖3),具體來看,不同品系中CsHsp70-6 蛋白質序列的進化樹分析顯示,印度栽培種‘Hx117’、印度野生種‘PI’以及東亞栽培種‘9930’在同一個分支,表明這三個品系之間的親緣關系更近,同時,這三個品系的保守蛋白基序與基因結構也展示出與其它品系不一致的特征,說明了這三個品系中的CsHsp70-6 可能具有與其它品系不同的基因功能。此外,對于基因結構的分析表明,CsHsp70-10 在印度野生種‘PI’中表現出與其它品系不一致的結構特征,但其蛋白保守基序以及蛋白長度并未發生變化,這一結果表明不同品系中蛋白質序列長度相同的情況下,其基因結構不一定完全一致。
2.4 黃瓜Hsp70 基因在42 ℃熱激下的表達模式分析
為了挖掘參與黃瓜高溫響應的Hsp70 基因,我們利用參考基因組測序品種9930 為材料,進行42 ℃高溫處理,分別在處理后0、3、6 h 取樣進行轉錄組測序。測序結果表明,除了CsHsp70-5不表達以外,其余的11 個基因在不同程度上參與了黃瓜的熱激響應。如圖4 所示,聚類分析按照黃瓜Hsp70 基因響應高溫的表達模式將其分成兩大類,其中CsHsp70-1,CsHsp70-3,CsHsp70-7,CsHsp70-8,CsHsp70-10,CsHsp70-11這6 個基因受熱激誘導表達顯著上調,尤其是CsHsp70-1 受熱激誘導表達最為強烈,與未處理的對照組(0 h)相比,其表達水平在高溫處理3 h后,迅速升高了6.37 倍,在高溫處理6 h 后表達量仍然維持較高水平,暗示著該基因可能是調控黃瓜耐熱性的關鍵因子。而另外3 個基因(CsHsp70-2,CsHsp70-6,CsHsp70-12)則展現出與之不同的表達模式,表達水平隨著熱激持續時間的延長而逐漸減弱。總之,以上結果表明CsHsp70 家族基因參與了黃瓜的高溫響應過程,可能在黃瓜耐熱性中發揮關鍵作用。
3 討 論
環境溫度是影響植物生長發育、地理分布和季節行為的最關鍵因素之一[23]。以全球變暖為主要標志的全球氣候變化已對農業生產產生了重大影響[24]。黃瓜是一種重要的經濟作物,在設施栽培的春末和秋初季,溫度經常超過35 ℃,甚至可能達到50 ℃。在此期間,黃瓜經常遭受熱激,對果實品質和產量都有很大影響[25]。因此,發掘黃瓜中的耐熱基因、培育耐熱品種對黃瓜生產至關重要。
熱激蛋白為代表的分子伴侶蛋白參與蛋白質折疊和降解過程[26]。并能在脅迫條件下協助蛋白質復性,通過重建正常的蛋白質構象從而恢復細胞穩態,參與各種應激反應機制,在保護植物免受非生物脅迫損傷方面起著重要作用[27]。其中,Hsp70s 高度保守,被認為是熱激反應產生的最豐富的熱激蛋白[28]。
在漫長的進化過程中,由于地域因素,環境因素等影響,每個個體都形成了極其特別的遺傳性狀,單一個體的基因組已經不能涵蓋這個物種的所有遺傳信息。同時,對不同生長栽培環境下物種基因特征進行研究,有助于培育更適應不同環境氣候變化的作物。因此,在黃瓜泛基因組中對Hsp70 家族進行鑒定及分析對于發掘黃瓜中的耐熱基因是非常有利的。
本研究在包含11 個黃瓜品系的泛基因組中對全基因組范圍內的Hsp70 基因進行鑒定,共鑒定到12 個CsHsp70 基因,相較于模式作物擬南芥中的Hsp 基因數目并未發現明顯的大規模擴張及收縮[29]。但是,在印度栽培種‘Hx14’中卻出現了基因缺失,只鑒定到9 個CsHsp70 基因(表2),我們推測這可能是由于黃瓜從野生種到栽培種馴化過程中受到外界環境壓力所導致的‘基因丟失’的結果。同時,我們還發現有5 個共有基因在不同黃瓜品系中的蛋白序列長度、蛋白保守基序以及基因結構完全一致(圖1),推測這5 個基因可能調控著黃瓜的基礎代謝過程,同時在不同黃瓜品系中的基因功能可能是保守的。另外,還鑒定到4 個發生變異的共有基因(圖2),這4 個基因應該作為后續基因功能研究的重點對象,因為變異基因可能就是使個體產生不同性狀(抗病性,耐熱性等)的原因。總之,我們的研究為基因功能研究以及分子遺傳育種提供了參考信息,具體的基因功能及調控機理還需要進一步的驗證及解析。
4 結 論
熱激蛋白Hsp70 基因家族被認為是參與植物熱激反應最重要的分子伴侶蛋白。本研究利用生物信息學技術對基于11 個黃瓜品系的泛基因組中的Hsp70 家族進行鑒定與分析。最終鑒定到在所有品系中高度保守的共有基因有5 個,發生變異的共有基因有4 個,非共有基因有3 個。所確定的12 個Hsp70 家族基因在不同黃瓜品系中具有不完全相同的基因特征。
參考文獻
[1] Battisti DS, Naylor RL. Historical warnings of future
food insecurity with unprecedented seasonal heat [J].
Science, 2009, 323(5911): 240-244.
[2] Zhang H, Zhou JF, Kan Y, et al. A genetic module at
one locus in rice protects chloroplasts to enhance
thermotolerance [J]. Science, 2022, 376(6599): 1293-
1300.
[3] Shang Y, Ma Y, Zhou Y, et al. Plant science.
Biosynthesis, regulation, and domestication of
bitterness in cucumber [J]. Science, 2014, 346
(6213): 1084-1088.
[4] Qi J, Liu X, Shen D, et al. A genomic variation map
provides insights into the genetic basis of cucumber
domestication and diversity [J]. Nature Genetics,
2013, 45(12): 1510-1515.
[5] Yu B, Ming F, Liang Y, et al. Heat Stress Resistance
Mechanisms of Two Cucumber Varieties from
Different Regions [J]. International Journal of
Molecular Sciences, 2022, 23(3): 1817.
[6] Shan Q, Ma F, Wei J, et al. Physiological Functions
of Heat Shock Proteins [J]. Current Protein amp;
Peptide Science, 2020, 21(8): 751-760.
[7] Singh G, Sarkar NK, Grover A. Hsp70, sHsps and
ubiquitin proteins modulate HsfA6a-mediated
Hsp101 transcript expression in rice (Oryza sativa
L.) [J]. Physiol Plant, 2021, 173(4): 2055-2067.
[8] Usman MG, Rafii MY, Martini MY, et al. Molecular
analysis of Hsp70 mechanisms in plants and their
function in response to stress [J]. Biotechnology and
Genetic Engineering Reviews, 2017, 33(1): 26-39.
[9] Song P, Jia Q, Xiao X, et al. HSP70-3 Interacts with
Phospholipase Dδ and Participates in Heat Stress
Defense [J]. Plant Physiology, 2021, 185(3): 1148-
1165.
[10] Kumar SV, Wigge PA. H2A. Z-containing
nucleosomes mediate the thermosensory response in
Arabidopsis [J]. Cell, 2010, 140(1): 136-147.
[11] Jungkunz I, Link K, Vogel F, et al. AtHsp70-15-
deficient Arabidopsis plants are characterized by
reduced growth, a constitutive cytosolic protein
response and enhanced resistance to TuMV [J]. The
Plant Journal, 2011, 66(6): 983-995.
[12] Ashraf M, Mao Q, Hong J, et al. HSP70-16 and
VDAC3 jointly inhibit seed germination under cold
stress in Arabidopsis [J]. Plant, Cell amp; Environment,
2021, 44(11): 3616-3627.
[13] Guo M, Liu JH, Ma X, et al. Genome-wide analysis
of the Hsp70 family genes in pepper (Capsicum
annuum L.) and functional identification of
CaHsp70-2 involvement in heat stress [J]. Plant
Science, 2016, 252: 246-256.
[14] Guo M, Zhai YF, Lu JP, et al. Characterization of
CaHsp70-1, a pepper heat-shock protein gene in
response to heat stress and some regulation
exogenous substances in Capsicum annuum L [J].
International Journal of Molecular Sciences, 2014, 15
(11): 19741-19759.
[15] 胡秀麗,李艷輝,楊海榮,等.HSP70 可提高干旱高溫
復合脅迫誘導的玉米葉片抗氧化防護能力[J]. 作物
學報,2010,36(4):636-644.
[16] Bayer PE, Golicz AA, Scheben A, et al. Plant pangenomes
are the new reference [J]. Nature Plants,
2020, 6(8): 914-920.
[17] Liu Y, Du H, Li P, et al. Pan-Genome of Wild and
Cultivated Soybeans [J]. Cell, 2020, 182(1): 162-176.
e13.
[18] Li YH, Zhou G, Ma J, et al. De novo assembly of
soybean wild relatives for pan-genome analysis of
diversity and agronomic traits [J]. Nature
Biotechnology, 2014, 32(10): 1045-1052.
[19] Li H, Wang S, Chai S, et al. Graph-based pangenome
reveals structural and sequence variations
related to agronomic traits and domestication in
cucumber [J]. Nature Communications, 2022, 13(1).
[20] Chen C, Wu Y, Li J, et al. TBtools-II: A \"one for all,
all for one\" bioinformatics platform for biological
big-data mining [J]. Molecular Plant, 2023, 16(11):
1733-1742.
[21] Liu K, Xu H, Gao X, et al. Pan-Genome Analysis of
TIFY Gene Family and Functional Analysis of
CsTIFY Genes in Cucumber [J]. International
Journal of Molecular Sciences, 2023, 25(1).
[22] Chen C, Chen X, Han J, et al. Genome-wide analysis
of the WRKY gene family in the cucumber genome
and transcriptome-wide identification of WRKY
transcription factors that respond to biotic and
abiotic stresses [J]. BMC Plant Biology, 2020, 20(1).
[23] Ding Y, Shi Y, Yang S. Molecular Regulation of
Plant Responses to Environmental Temperatures [J].
Molecular Plant, 2020, 13(4): 544-564.
[24] Lesk C, Rowhani P, Ramankutty N. Influence of
extreme weather disasters on global crop production
[J]. Nature, 2016, 529(7584): 84-87.
[25] Dong S, Zhang S, Wei S, et al. Identification of
Quantitative Trait Loci Controlling High-
Temperature Tolerance in Cucumber (Cucumis
sativus L.) Seedlings [J]. Plants (Basel), 2020, 9(9).
[26] Zhu JK. Abiotic Stress Signaling and Responses in
Plants [J]. Cell, 2016, 167(2): 313-324.
[27] Lamers J, Van Der Meer T, Testerink C. How Plants
Sense and Respond to Stressful Environments [J].
Plant Physiology, 2020, 182(4): 1624-1635.
[28] Zhang X, Li J, Li M, et al. NtHSP70-8b positively
regulates heat tolerance and seed size in Nicotiana
tabacum [J]. Plant Physiology and Biochemistry,
2023, 201.
[29] Lin BL, Wang JS, Liu HC, et al. Genomic analysis of
the Hsp70 superfamily in Arabidopsis thaliana [J].
Cell Stress Chaperones, 2001, 6(3): 201-208.

