前列腺六段跨膜上皮抗原4 對炎癥環境下前列腺癌細胞增殖的影響
孫興華 于 濤 張學新 常鴻艷 洪月光 李偉偉
1.河北省秦皇島市中醫醫院腫瘤科,河北秦皇島 066000;2.濰坊醫學院生命科學與技術學院,山東濰坊 261053;3.河北省秦皇島市中醫醫院心血管內科,河北秦皇島 066000;4.河北省秦皇島市婦幼保健院生殖醫學科,河北秦皇島 066000
前列腺癌是危害全世界男性健康的最常見惡性腫瘤之一[1]。炎癥在多種人類腫瘤包括前列腺癌的發生、促進和發展中起重要的作用[2]。脂多糖(lipopolysaccharide,LPS)是革蘭氏陰性菌外膜的主要成分,LPS的識別與跨膜信號轉導,是引起細胞炎癥效應的關鍵。有研究顯示,長期慢性炎癥反應的發生是非小細胞肺癌、胃癌和宮頸癌發生的重要致病因素[3-6]。感染及炎癥與前列腺癌的關系密不可分,革蘭氏陰性桿菌的反復感染是慢性前列腺炎發病的重要原因,增加了PCa細胞的增殖能力、遷移能力及局部侵襲能力[7-8]。前列腺六段跨膜上皮抗原(six-segment transmembrane epithelial antigen of prostate,STEAP)家族參與多種生物學過程,包括增殖和炎癥,在癌癥治療中發揮潛在作用[9]。STEAP4 是STEAP 家族成員之一,參與乳腺癌和膀胱癌的發展,并與結腸癌的炎癥有關[10-12]。另有研究表明,STEAP4 在前列腺癌組織中高度表達,并且相關性分析得出STEAP4 高表達的患者比低表達的患者其前列腺癌復發的時間更快,可作為前列腺癌患者的預后指標[13]。然而,STEAP4 在前列腺癌發展中的作用和相關機制仍不清楚。本研究旨在探討STEAP4 對LPS 誘導的前列腺癌細胞增殖的影響,可能為前列腺癌的治療提供新思路。
1 材料與方法
1.1 細胞培養與處理
人前列腺癌細胞系PC3(貨號:CRL-1435)和VCaP(貨號:CRL-2876)由ATCC 提供,并在含有10%胎牛血清(Gibco,美國)和1%青霉素/ 鏈霉素的DMEM(賽默飛世爾科技公司,中國)中于37℃、5%CO2條件下培養。參照Xu 等[14]研究,將PC3 和VCaP細胞暴露于1 μg/ml 的LPS(索萊寶,北京)中孵育24 h誘導炎癥環境。
1.2 細胞轉染
采用Lipofectamine 2000(賽默飛世爾科技公司,中國)將沉默載體(si-STEAP4 及其對照si-con)轉染進入細胞。經48 h 轉染后,觀察細胞生長情況,收集細胞用于進一步研究。STEAP4 的siRNA(si-STEAP4:5’-AUCUUACAAGUUUUCUCCAU-3’)和siRNA 陰性對照(si-con:5’-AGACAUGUGUGUGUCCGCCTT-3’)購自GenePharma(上海)。實驗重復3 次,設3個復孔。將細胞分為對照組、LPS 處理組、轉染對照組(LPS+si-con)和轉染沉默組(LPS+si-STEAP4)。
1.3 蛋白免疫印跡
采用放射免疫沉淀法測定蛋白濃度,根據光密度(optical density,OD)值從標準曲線中計算蛋白的濃度。根據蛋白濃度計算上樣量。本研究實驗的樣品量為20 μl,上樣量為30 μg。臨用前加入最終的樣品緩沖液:2%SDS、100 mmol/L DTT、60 mmol/L Tris(pH 6.8)、0.01%溴酚藍和10%甘油。在電極(正極)上依次疊放PVDF 膜和凝膠。轉膜結束,將膜浸入封閉液(含5%脫脂奶粉的TBS)中緩慢振蕩后洗滌。抗STEAP4(cat.No.PA5-106509,1∶1 000 稀釋度,賽默飛世爾科技公司);環鳥苷酸(cyclic guanosine monophosphate,cGMP)(cat.No.#A11070,1∶1000 稀釋度,賽默飛世爾科技公司);抗-cGMP 依賴性蛋白激酶(cGMP-dependent protein kinase,PKG)1(cat.No.#3248,1∶1 000 稀釋度,Cell Signaling Technology)、抗-PKG2(cat.No.PA5-116863,1∶1 000 稀釋度,賽默飛世爾科技公司)、抗血管擴張劑刺激磷酸蛋白(vasodilator stimulated phosphoprotein,VASP)(cat.No.ab109321,1∶1 000 稀釋度,Abcam)、抗磷酸化VASP(p-VASP,ab218619,1∶1 000 稀釋度,Abcam)、抗β-actin(cat.No.ab8227,1∶2 000 稀釋度,Abcam),4℃緩慢振蕩過夜;加HRP標記的二抗(1∶12 000 稀釋),室溫緩慢振蕩2 h 后洗滌;以β-action 作為內參,采用Quantity One 軟件將條帶轉化為灰度值,蛋白表達量=目的條帶灰度值/內參條帶灰度值。實驗重復3 次。
1.4 采用酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)檢測細胞因子的含量
取對數生長期的PC3 和VCaP 細胞,以2×107/L接種于6 孔板中,每孔2 ml,細胞貼壁后按照分組進行處理。用si-con 或si-STEAP4 轉染PC3 和VCaP 細胞。轉染24 h 后,用1 μg/ml LPS 另外再處理細胞24 h。收集上清液于4℃、4 000 r/min 離心10 min(離心半徑10 cm)。按照ELISA 試劑盒白細胞介素(interleukin,IL)-6(cat.No.KHC0061)、IL-8(cat.No.KHC0081)和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)(cat.No.MS223-4)說明書操作,檢測上清液中IL-6、IL-8 和TNF-α 含量。實驗重復3 次,設3 個復孔。
1.5 CCK-8 法檢測細胞存活率
將PC3 和VCaP 細胞(1×104/ 孔)接種至96 孔板。經LPS 處理后,加入10 μl 的CCK-8 試劑(Beyotime)并孵育4 h。使用SpectraMax iD5 微板讀取器(Molecular Devices,Sunnyvale,CA)檢測450 nm 處的OD 值。實驗重復3 次,設3 個復孔。
1.6 EdU 染色
將PC3 和VCaP 細胞(5×105/孔)接種至6 孔板,用si-con 或si-STEAP4 轉染PC3 和VCaP 細胞。轉染24 h 后,用1 μg/ml LPS 另外再處理細胞24 h。根據操作說明書使用EdU 檢測試劑盒(Abcam)進行孵育。使用DAPI(Beyotime)將細胞核進行染色,在熒光顯微鏡下觀察細胞。細胞增殖以總細胞中EdU 陽性細胞的百分比來表示。實驗重復3 次。
1.7 統計學方法
采用GraphPad Prism 8 統計學軟件進行數據分析。計量資料采用均數±標準差(±s)表示,比較采用t 檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 LPS 處理后各組前列腺癌細胞中STEAP4 蛋白表達水平的變化
LPS 處理組PC3 和VCaP 細胞的STEAP4 蛋白表達水平顯著高于對照組,差異有統計學意義(P<0.05);LPS 處理組PC3 和VCaP 細胞的STEAP4 的表達水平與轉染對照組比較,差異無統計學意義(P>0.05);轉染沉默組PC3 和VCaP 細胞的STEAP4 的表達水平顯著低于轉染對照組,差異有統計學意義(P<0.05)。見圖1。
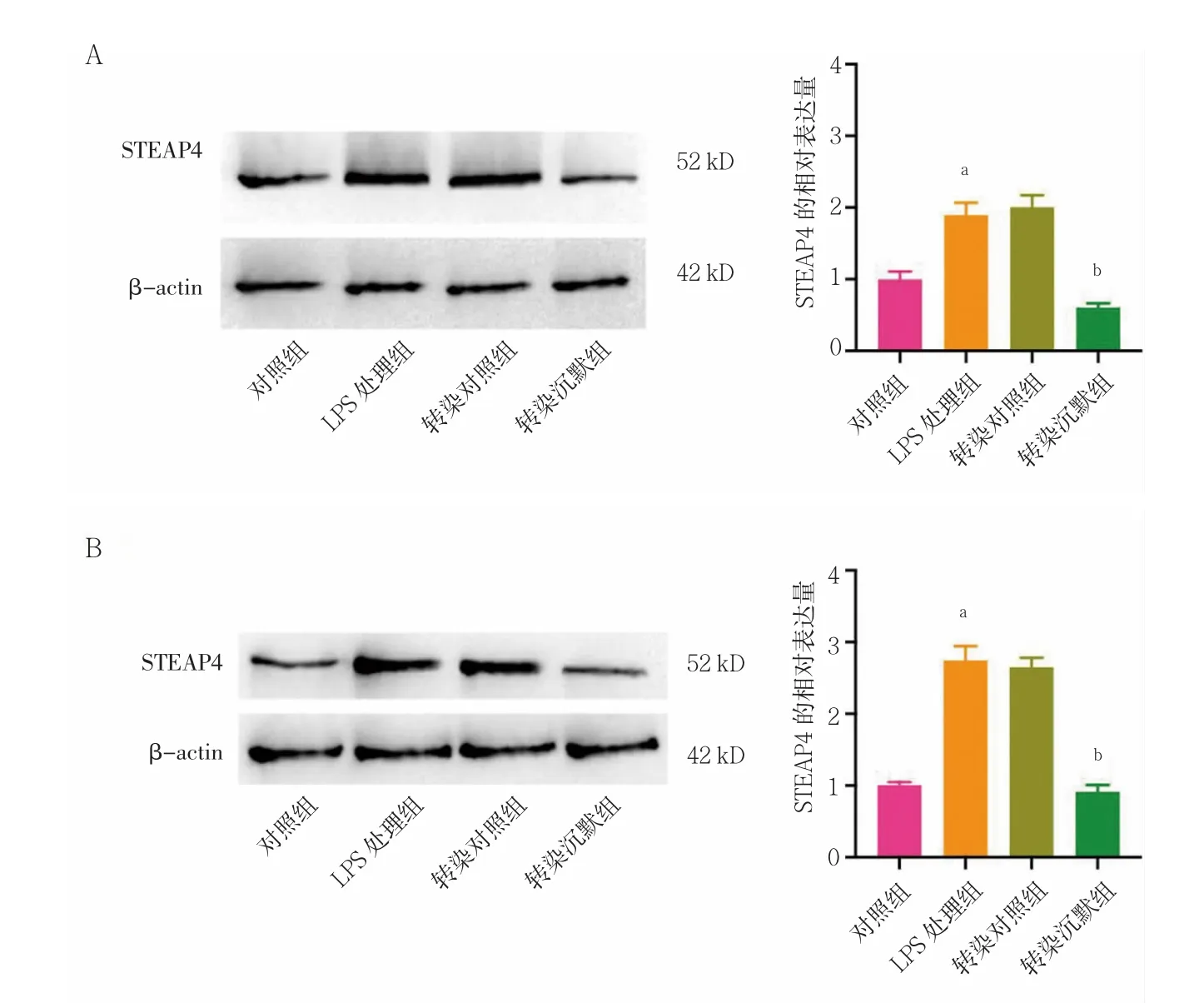
圖1 LPS 處理后各組細胞中STEAP4 蛋白表達水平的變化(n=3)
2.2 STEAP4 敲除對LPS 誘導的各組前列腺癌細胞的炎癥反應的影響
LPS 處理組PC3 和VCaP 細胞的IL-6、IL-8 和TNF-α 的表達水平顯著高于對照組,差異有統計學意義(P<0.05);LPS 處理組和轉染對照組PC3 和VCaP細胞的IL-6、IL-8 和TNF-α 的表達水平比較,差異無統計學意義(P>0.05);轉染沉默組PC3 和VCaP 細胞的IL-6、IL-8 和TNF-α 的表達水平顯著低于轉染對照組,差異有統計學意義(P<0.05)。見圖2。
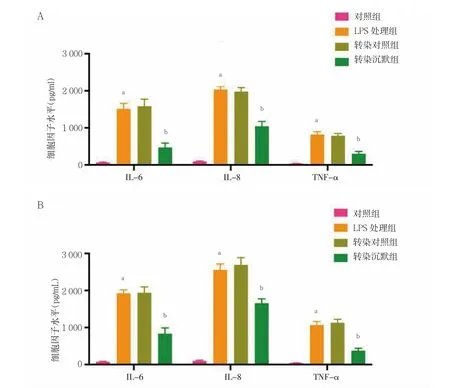
圖2 STEAP4 敲除對LPS 誘導的各組前列腺癌細胞的炎癥反應的影響(n=3)
2.3 STEAP4 敲除對LPS 誘導的各組前列腺癌細胞增殖的影響
LPS 處理組PC3 和VCaP 細胞24、48、72 h 的增殖活力顯著高于對照組,差異有統計學意義(P<0.05);LPS 處理組和轉染對照組PC3 和VCaP 細胞24、48、72 h 的增殖活力比較,差異無統計學意義(P>0.05);轉染沉默組PC3 和VCaP 細胞24、48、72 h 的增殖活力均低于轉染對照組,差異有統計學意義(P<0.05)LPS 處理組PC3 和VCaP 細胞的增殖活力顯著高于對照組,差異有統計學意義(P<0.05);LPS 處理組和轉染對照組PC3 和VCaP 細胞的增殖活力比較,差異無統計學意義(P>0.05);轉染沉默組PC3 和VCaP 細胞的增殖活力顯著低于轉染對照組,差異有統計學意義(P<0.05)。見圖3。
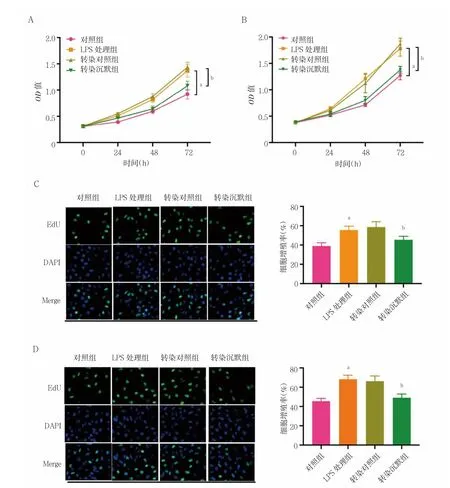
圖3 STEAP4 敲除對LPS 誘導的各組前列腺癌細胞增殖的影響(n=3)
2.4 STEAP4 敲低對LPS 誘導的前列腺癌細胞中cGMPPKG 信號途徑的影響
LPS 處理組PC3 和VCaP 細胞中cGMP、PKG1、PKG2 和pVASP/VASP 的相對表達量顯著低于對照組,差異有統計學意義(P<0.05);轉染對照組和LPS處理組PC3 和VCaP 細胞中cGMP、PKG1、PKG2 和pVASP/VASP 的相對表達量比較,差異無統計學意義(P>0.05);轉染沉默組的PC3 和VCaP 細胞中cGMP、PKG1、PKG2 和pVASP/VASP 的相對表達量顯著高于轉染對照組,差異有統計學意義(P<0.05)。見圖4。
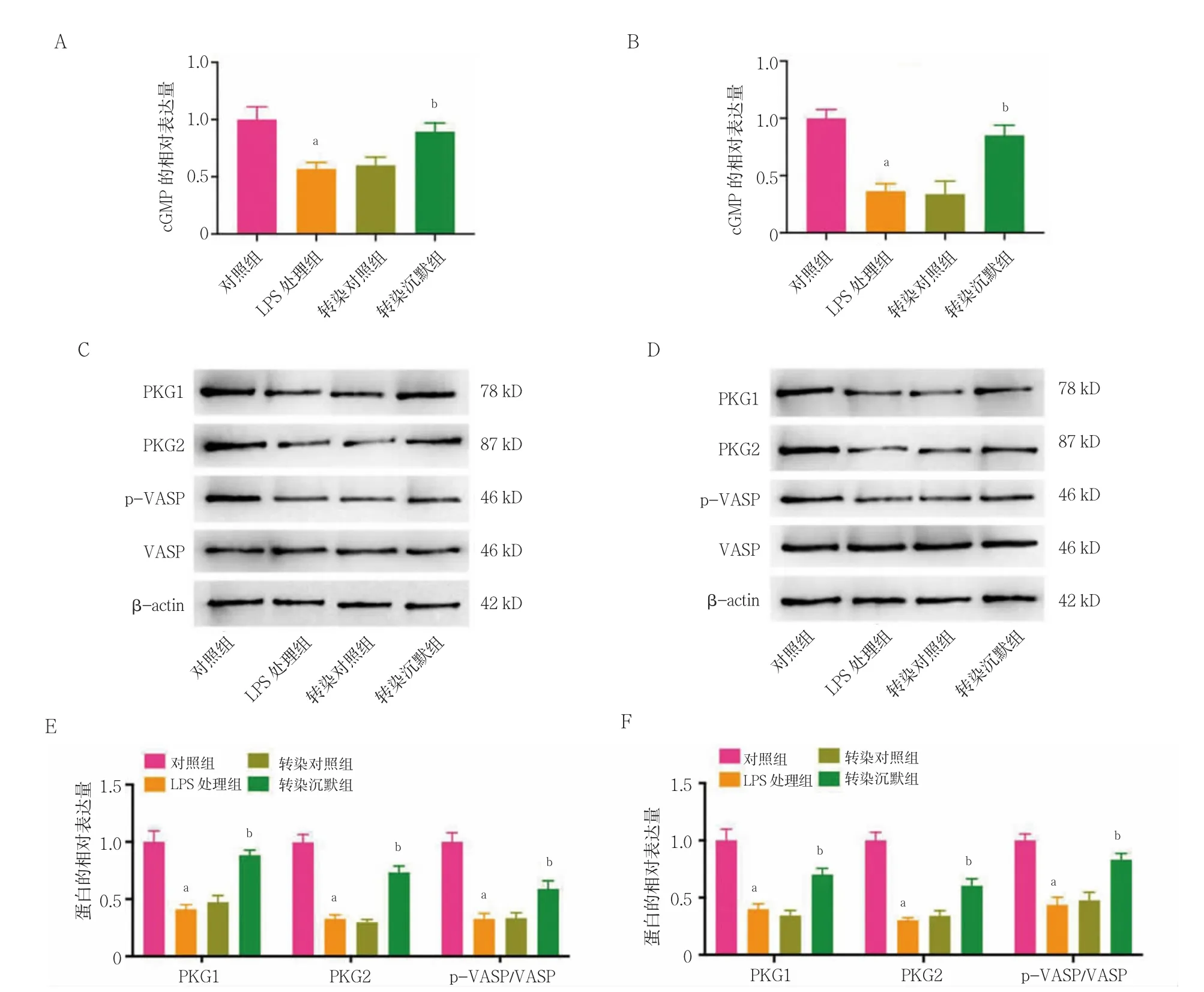
圖4 STEAP4 敲低對LPS 誘導的前列腺癌細胞中cGMP-PKG 信號途徑的影響(n=3)
3 討論
前列腺癌是世界范圍內男性發病率排名第二的惡性腫瘤[15]。近年研究報道,在前列腺癌組織中能觀察到慢性炎癥反應,被認為是前列腺癌進展的驅動因素之一[16]。另有研究報道,感染及炎癥與前列腺癌的關系是密不可分的,革蘭氏陰性桿菌的反復感染是慢性前列腺炎發病的重要原因,并且大量證據表明,感染促進了前列腺癌的發展和轉移[17-18]。LPS 作為革蘭氏陰性菌的主要化合物,能夠激活免疫細胞產生多種細胞因子和后續的炎癥反應[19]。有研究顯示,LPS 可增加前列腺癌細胞增殖的能力、遷移的能力及局部侵襲的能力,增加了癌細胞的惡性程度[20]。STEAP 家族在前列腺癌中發揮重要作用。既往研究表明,STEAP4 是受炎癥細胞因子調節的靶點[21-22];此外研究表明,在炎癥相關環境下STEAP4 在結腸癌的發展中起重要作用[12]。目前,STEAP4 在炎癥環境下對前列腺癌發展的影響的相關研究鮮見報道。
本實驗采用LPS 誘導前列腺癌模擬炎癥環境,結果顯示,LPS 處理后的前列腺癌細胞的增殖能力升高,STEAP4 蛋白的表達水平升高,差異有統計學意義(P<0.05)。轉染si-STEAP4 敲低STEAP4 能夠抑制炎癥條件下前列腺癌的細胞增殖及炎癥因子的水平,差異有統計學意義(P<0.05)。另外EdU 染色分析結果顯示,LPS 能夠促進細胞增殖,而STEAP4 沉默逆轉了這一效應。以上結果顯示,STEAP4 敲低可減輕LPS 誘導的前列腺癌增殖,提示STEAP4 在前列腺癌治療中的潛力。
本研究進一步探索了STEAP4 在前列腺癌中介導的下游途徑,并發現其可能與cGMP-PKG 信號傳導有關。cGMP 參與多個信號轉導過程,有研究表明,PKG2 可以抑制許多腫瘤的細胞增殖,如結腸癌、黑色素瘤和卵巢癌[23-25]。既往研究表明,cGMP-PKG 信號的激活有助于減少前列腺癌中的細胞增殖[26]。本研究顯示,在LPS 存在的情況下,cGMP-PKG 通路在前列腺癌中失活。本研究仍存在不足,今后仍需要進行體內實驗以進一步研究STEAP4 的潛在功能。
綜上所述,STEAP4 下調能夠抑制LPS 誘導的前列腺癌的增殖。本研究為炎癥環境下前列腺癌的進展提供了新的見解,并指出了治療前列腺癌的潛在靶點。

