LncRNA CBR3-AS1調節miR-409-3p/hnRNPA2B1軸對肝細胞癌細胞惡性生物學行為的影響
陳仕 黎慧娟 許若思 張彩英 陳露
肝細胞癌(HCC)是最常見的原發性肝癌,也是我國第二大最常見的惡性腫瘤[1,2]。肝癌細胞具有侵襲性與轉移性,這是造成肝癌發病率和死亡率不斷上升的主要原因[3],導致肝癌患者確診后的5年生存率很低[4]。近年來,通過手術、靶向治療和免疫治療肝癌的診斷和治療取得了一定的進展,但肝癌的發生機制尚不明確,且肝癌對多種治療藥物產生耐藥性,所以尋找新的分子靶標對肝癌治療具有重要的意義[5]。長鏈非編碼RNA(lncRNAs)是一組>200個核苷酸的轉錄本,已被確定為許多生理和病理過程的關鍵決定因素,特別是在癌癥的惡性進展中。lncRNA參與肝癌的發生發展并已經成為肝癌藥物干預的新靶點。例如lncRNA NHG5在肝癌細胞中高表達,抑制lncRNA NHG5的表達抑制肝癌細胞的增殖[6]。而lncRNA CBR3-AS1屬于lncRNA,有研究顯示lncRNA CBR3-AS1在膽管癌中高表達,抑制lncRNA CBR3-AS1的表達可以抑制膽管癌細胞的增殖與侵襲[7]。研究顯示,miR-409-3p在肝癌組織中的表達降低,miR-409-3p過表達能夠減少肝癌細胞的轉移和侵襲[8]。核不均一核糖蛋白A2B1(hnRNPA2B1)在肝癌細胞中表達上調,下調hnRNPA2B1的表達,促進Hep G2細胞凋亡[9]。經生物學分析顯示,miR-409-3p與lncRNA CBR3-AS1、hnRNPA2B1之間具有靶向結合位點。推測LncRNA CBR3-AS1可能通過調節miR-409-3p/hnRNPA2B1軸對肝癌細胞的發生發展產生影響。本研究探索LncRNA CBR3-AS1對肝癌細胞增殖、凋亡、遷移、侵襲及miR-409-3p/hnRNPA2B1軸的影響,為肝癌的靶向治療提供理論參考。
1 材料與方法
1.1 材料 人肝癌細胞(Hep G2)購于中國科學院細胞庫。si-NC、si-CBR3-AS1、anti-miR-NC、anti-miR-409-3p、miR-NC、miR-409-3p mimics、pcDNA、hnRNPA2B1的序列及LncRNA CBR3-AS1、miR-409-3p、hnRNPA2B1、U6、GADPH引物均由廣州市銳博生物科技有限公司設計合成。SYBR Green PCR Master Mix(SR1120)、Trizol試劑盒(15596-018)、RIPA裂解液(R0010)購于北京Solarbio;雙螢光素酶報告基因檢測試劑盒(YT273)、Lipofectamine 3000(QN2876)購于百奧萊博科技有限公司。Annexin V-FITHCA/PI細胞凋亡試劑盒(SB-F6012)購于上海Share-Bio;Transwell小室(3422)購于美國Corning Costar。GAPDH單抗(5174)、B淋巴細胞瘤(Bcl)-2(3498)、P21(2947)、Bcl-2相關X蛋白(Bax)(41162)一抗購于美國Cell Signaling Technology公司。細胞核增殖抗原標記物Ki67(sc-23900)抗體購于圣克魯斯生物技術;MMP-2(AF0234)、MMP-9(AF5234)抗體購于上海碧云天公司。
1.2 方法
1.2.1 標本來源:經本院倫理委員會批準,采集30對肝癌患者癌組織及距離腫瘤5 cm的癌旁組織,儲存于液氮中。上述組織已獲得每位患者的知情同意,且患者術前均未接受過放射療法或化學療法。
1.2.2 細胞培養與處理:Hep G2細胞接種于DMEM培養基(10%胎牛血清+1%青霉素-鏈霉素)在5% CO2、37℃、濕度飽和培養箱培養,待細胞穩定傳代后收集細胞。將si-NC、si-CBR3-AS1、si-CBR3-AS1+anti-miR-NC、si-CBR3-AS1+anti-miR-409-3p、miR-NC、miR-409-3p mimics、miR-409-3p mimics+pcDNA、miR-409-3p mimics+hnRNPA2B1質粒轉染Hep G2細胞中,分別記為si-NC組、si-CBR3-AS1組、si-CBR3-AS1+anti-miR-NC組、si-CBR3-AS1+anti-miR-409-3p組、miR-NC組、miR-409-3p mimics組、miR-409-3p mimics+pcDNA組、miR-409-3p mimics+hnRNPA2B1組。
1.2.3 qRT-PCR檢測LncRNA CBR3-AS1、miR-409-3p、hnRNPA2B1表達水平:提取各組細胞的總RNA,反轉錄成cDNA,PCR擴增。GAPDH、U6為內參,相對表達量用2-ΔΔCt法計算。LncRNA CBR3-AS1上游引物5’-3’:CAGTGGGGAACTCTGACTCG,下游引物5’-3’:GTGCCTGGTGCTCTCTTACC;miR-409-3p上游引物5’-3’:CGGAATGTTGC TCGGTGA,下游引物5’-3’:AGTGCAGGGTCCGAGGTATT;GAPDH上游引物5’-3’:GTCTCCTCTGACTTCAACAGCG,下游引物5’-3’:ACCACCCTGTT GCTGTAGCCAA;U6上游引物5’-3’:CTCGCTTCGGCAGCACAT,下游引物5’-3’:TTTGC GTGTCATCCTTGCG。
1.2.4 雙熒光素酶報告基因檢測:Starbase預測LncRNA CBR3-AS1、hnRNPA2B1與miR-409-3p之間有靶向結合位點。將LncRNA CBR3-AS1和hnRNPA2B1的野生型(WT)和突變型(MUT)熒光素酶表達載體分別與miR-NC和miR-409-3p mimics共同轉染Hep G2細胞,37℃ 5% CO2培養箱培養48 h,檢測細胞熒光素酶活性。
1.2.5 平板克隆形成實驗:將轉染細胞接種于6孔板,培養14~18 d,固定染色后對細胞菌落進行拍照計數。
1.2.6 Annexin V-FITC/PI法檢測細胞凋亡率:轉染后Hep G2細胞用結合緩沖液重懸,參照Annexin V-FITHCA/PI細胞凋亡試劑盒說明書操作,流式細胞儀檢測細胞凋亡。
1.2.7 劃痕實驗:取長滿培養皿的轉染后各組Hep G2細胞,用200 μL槍頭垂直劃痕,拍照記錄劃痕情況,在含胎牛血清的培養基培養1 d,拍照記錄各組細胞愈合情況,分析計算劃痕愈合率。
1.2.8 Transwell侵襲實驗:在Transwell上室鋪上基質膠后,添加200 μL細胞懸液,下室添加500 μL含10% FBS的培養基,37℃孵育24 h。取出小室固定染色,光學顯微鏡下隨機抽取6個視野拍照計數。
1.2.9 蛋白免疫印跡分析實驗:在轉染后的各組Hep G2細胞懸液中加入RIPA裂解液,10% SDS-PAGE電泳分離蛋白,結束后轉移至PVDF膜,然后用50 g/L 脫脂奶粉封閉,1 h后加入一抗,4 ℃下孵育24 h,洗膜后加入二抗,室溫2 h,滴加ECL,暗室曝光顯影,應用Quantityone軟件分析蛋白相對表達。
1.2.10 裸鼠移植瘤:20只4周齡BALB/c裸鼠由中國科學院上海藥物研究所提供[生產許可SCXK:(滬)2020-0005],適應飼養一段時間,將小鼠平均分成2組分別注射si-NC或si-CBR3-AS1感染的Hep G2細胞,每5天觀察1次移植瘤的生長。30 d后結束觀察并處死大鼠分離腫瘤,測量腫瘤質量與體積,檢測移植瘤組織中LncRNA CBR3-AS1、miR-409-3p、hnRNPA2B1的表達情況。
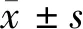
2 結果
2.1 LncRNA CBR3-AS1、miR-409-3p在癌旁組織和肝癌組織中的表達 與癌旁組織比較,癌組織中LncRNA CBR3-AS1表達顯著升高,miR-409-3p表達顯著降低(P<0.05)。見表1。
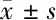
表1 LncRNA CBR3-AS1和miR-409-3p在癌旁組織和肝癌組織中的表達比較 n=30,
2.2 LncRNA CBR3-AS1靶向調控miR-409-3p表達 StarBase預測顯示LncRNA CBR3-AS1與miR-409-3p有靶向結合位點。雙熒光素酶實驗顯示,miR-409-3p mimics與LncRNA CBR3-AS1-WT共轉染Hep G2細胞相對熒光素酶活性顯著降低(P<0.05)。與si-NC組比較,si-CBR3-AS1組LncRNA CBR3-AS1表達明顯下降,miR-409-3p表達明顯上升(P<0.05);與si-CBR3-AS1+anti-miR-NC組比較,si-CBR3-AS1+anti-miR-409-3p組miR-409-3p表達明顯下降(P<0.05)。見圖1,表2、3。

圖1 LncRNA CBR3-AS1與miR-409-3p結合位點預測
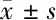
表2 雙熒光素酶檢測LncRNA CBR3-AS1與miR-409-3p靶向關系 n=6,
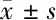
表3 4組細胞LncRNA CBR3-AS1、miR-409-3p表達水平 n=6,
2.3 LncRNA CBR3-AS1靶向miR-409-3p對HCC細胞的惡性生物學影響 與si-NC組比較,si-CBR3-AS1組Hep G2細胞集落形成數、劃痕愈合率、侵襲數量及Ki67、Bcl-2、MMP-2、MMP-9表達水平顯著降低,細胞凋亡率及P21、Bax蛋白表達水平顯著升高(P<0.05);與si-CBR3-AS1+anti-miR-NC組比較,si-CBR3-AS1+anti-miR-409-3p組Hep G2細胞集落形成數、劃痕愈合率、侵襲數量及Ki67、Bcl-2、MMP-2、MMP-9表達水平顯著升高,細胞凋亡率及P21、Bax蛋白表達水平顯著降低(P<0.05)。見表4。

表4 4組細胞集落形成、凋亡、劃痕愈合率、侵襲及相關蛋白表達比較 n=6,
2.4 miR-409-3p靶向調控hnRNPA2B1表達 生物信息學分析顯示miR-409-3p與hnRNPA2B1有靶向結合位點。雙熒光素酶實驗顯示,miR-409-3p mimics與hnRNPA2B1-WT共轉染Hep G2細胞相對熒光素酶活性顯著降低(P<0.05)。與miR-NC組比較,miR-409-3p mimics組miR-409-3p表達明顯上升,hnRNPA2B1表達明顯下降(P<0.05);與miR-409-3p mimics+pcDNA組比較,miR-409-3p mimics+hnRNPA2B1組hnRNPA2B1表達明顯上升(P<0.05)。見圖2,表5、6。

圖2 miR-409-3p與hnRNPA2B1結合位點預測
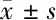
表5 雙熒光素酶檢測miR-409-3p與hnRNPA2B1靶向關系 n=6,
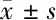
表6 4組細胞miR-409-3p和hnRNPA2B1表達水平 n=6,
2.5 miR-409-3p靶向hnRNPA2B1對肝癌細胞的惡性生物學影響 與miR-NC組比較,miR-409-3pmimics組細胞集落形成、劃痕愈合率、侵襲數量及Ki67、Bcl-2、MMP-2、MMP-9表達水平顯著降低,細胞凋亡率及P21、Bax蛋白表達水平顯著升高(P<0.05);與miR-409-3p mimics+pcDNA組比較,miR-409-3p mimics+hnRNPA2B1組細胞集落形成、劃痕愈合率、侵襲數量及Ki67、Bcl-2、MMP-2、MMP-9表達水平顯著升高,細胞凋亡率及P21、Bax蛋白表達水平顯著降低(P<0.05)。見表7。

表7 4組細胞集落形成、凋亡、劃痕愈合及相關蛋白表達比較 n=6,
2.6 LncRNA CBR3-AS1對裸鼠移植瘤生長的影響 與si-NC組比較,小鼠注射轉染si-CBR3-AS1的細胞后,移植瘤體積生長緩慢。與si-NC組比較,si-CBR3-AS1組移植瘤中LncRNA CBR3-AS1表達水平下降,miR-409-3p表達水平升高(P<0.005)。免疫組化檢測結果顯示,si-CBR3-AS1組移植瘤中,hnRNPA2B1蛋白表達水平顯著降低(P<0.005)。見圖3,表8。

圖3 免疫組化檢測移植瘤組織中hnRNPA2B1蛋白表達(×400)
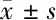
表8 LncRNA CBR3-AS1對裸鼠移植瘤生長及LncRNA CBR3-AS1、miR-409-3p、hnRNPA2B1蛋白表達的影響 n=10,
3 討論
越來越多的研究表明,長鏈非編碼RNA(lncRNAs)在許多人類癌癥中起著重要的調節作用。最近發現CBR3-AS1是與癌癥相關的lncRNA。目前lncRNA CBR3-AS1在肝癌中的作用機制尚未研究,但在其他癌癥的發展進程中已經有研究。在胃癌細胞中,lncRNA CBR3-AS1表達上調,抑制lncRNA CBR3-AS1的表達可抑制胃癌細胞增殖、遷移及侵襲[10]。在結直腸癌細胞中,敲低lncRNA CBR3-AS1可顯著抑制CRC細胞的增殖、遷移、侵襲,促進CRC細胞的凋亡[11]。在骨肉瘤細胞中,lncRNA CBR3-AS1表達上調,抑制lncRNA CBR3-AS1的表達可抑制骨肉瘤細胞增殖[12]。本文研究發現lncRNA CBR3-AS1在肝癌組織中表達上調,下調lncRNA CBR3-AS1的表達可抑制肝癌細胞的增殖、遷移與侵襲,促進凋亡,與lncRNA CBR3-AS1在其他癌組織中的研究結果一致。本研究在Hep G2細胞中干擾lncRNA CBR3-AS1的表達,miR-409-3p表達上調,肝癌細胞增殖、遷移與侵襲細胞量顯著下降,細胞凋亡率顯著升高,且Ki67、Bcl-2、MMP-2、MMP-9表達水平顯著降低,P21、Bax表達水平顯著升高。Ki67是DNA合成相關酶,其表達水平的高低可以用以判斷細胞增殖活性,而P21可負向調控細胞周期,抑制肝癌細胞增殖[13,14]。Bcl-2是抗凋亡蛋白可抑制細胞凋亡,而Bax屬于促凋亡蛋白可促進細胞凋亡。MMP-2、MMP-9均屬于MMP家族,參與肝癌細胞遷移和侵襲[15]。說明下調lncRNA CBR3-AS1可抑制肝癌細胞的增殖、遷移與侵襲。
MicroRNAs(miRNAs)在多種人類癌癥的生理和病理過程發揮重要作用。有研究顯示,miR-409-3p在肝癌組織中的表達降低,上調miR-409-3p表達抑制肝癌細胞的增殖、遷移與侵襲[16]。本文研究發現miR-409-3p在肝癌組織中表達下調,上調miR-409-3p表達抑制肝癌細胞增殖、遷移與侵襲,與之前的研究結果一致。另外研究發現miR-409-3p還在結直腸癌癌、胃癌等多種癌癥中充當抑癌因子[17-19]。越來越多的文章表明,位于細胞質中的lncrna總是以序列特異性的方式與mirna競爭,發揮著分子海綿的作用。有研究顯示,lncRNA CBR3-AS1通過調節miR-409-3p表達調控非小細胞肺癌的生長[20]。本研究通過生物學預測、雙熒光素酶檢測和熒光定量證明,lncRNA CBR3-AS1與miR-409-3p之間存在結合位點。miR-409-3p在肝癌細胞中表達下調,抑制miR-409-3p的表達可部分逆轉抑制lncRNA CBR3-AS1表達對肝癌細胞增殖、遷移與侵襲的抑制作用。揭示lncRNA CBR3-AS1可通過調控miR-409-3p的表達調控肝癌細胞的增殖、遷移與侵襲。
hnRNPA2B1是一種RNA結合蛋白,參與異質核RNA加工成成熟mRNA、RNA剪接、基因表達、蛋白翻譯調控等多種生物學過程。有研究表明,hnRNPA2B1在肝癌細胞中高表達,抑制hnRNPA2B1的表達,可抑制肝癌細胞增殖與遷移[21,22]。本研究通過生物學預測和雙熒光素酶檢測證明,miR-409-3p與hnRNPA2B1之間存在結合位點,在Hep G2細胞中miR-409-3p過表達可顯著下調hnRNPA2B1的表達,hnRNPA2B1過表達可部分逆轉中miR-409-3p過表達對肝癌細胞增殖、遷移與侵襲的抑制作用。本研究還顯示,在Hep G2細胞中,下調lncRNA CBR3-AS1表達可顯著上調miR-409-3p的表達,上調miR-409-3p的表達可顯著下調hnRNPA2B1的表達,說明下調lncRNA CBR3-AS1表達可促進miR-409-3p的表達,進而抑制hnRNPA2B1的表達。
綜上所述,在肝癌細胞中,下調lncRNA CBR3-AS1通過調節miR-409-3p/hnRNPA2B1軸抑制肝癌細胞惡性生物學行為。本研究還存在一定的局限性,lncRNA CBR3-AS1是否可以通過調節其他的miRNA來參與肝癌的惡性進展,miR-409-3p的其他靶向蛋白是否也參與肝癌細胞的進展過程。因此,需要進一步研究lncRNA CBR3-AS1在肝癌細胞中的作用機制。

