視網膜靜脈阻塞繼發黃斑水腫發病的危險因素及與血漿Hcy的相關性
霍紅 何敬 馬楠 王淑珍 王春利 張潔 侯麗萍
作為常見、多發的一種視網膜血管性疾病,視網膜靜脈阻塞(retinal vein obstructive RVO)的病因病機復雜,伴有不同程度的視力改變,患病率位居糖尿病視網膜病變(diabetes retinopathy,DR)之后[1],僅次之,嚴重影響患者生活。據報道,視網膜分支靜脈阻塞(branch retinal vein occlusion,BRVO)、視網膜中央靜脈阻塞(central retinal vein obstruction,CRVO)和RVO在2015年全球30~89歲人群中的患病率就達到了0.64%、0.13%和0.77%[1]。截止目前,BRVO、CRVO和RVO的患病率依舊處于遞增狀態[2,3],年齡越大患病率越高[4]。視網膜靜脈阻塞繼發黃斑水腫(retinal vein occlusion-macular edema,RVO-ME)是一種常見、多發的RVO并發癥,對視力損害極大[5]。結合目前國內外RVO-ME的治療情況來看,雖然治療方法[如地塞米松植入劑、抗血管內皮生長因子(vascular endothtial growth foltor,VEGF治療等[6]]較多,但標準治療方案依舊尚缺,加之國內外相關專家對RVO-ME的起始和轉換治療看法存異[7],RVO-ME的相關病理作用機制仍不清楚,故其治療仍未達成共識,形成權威的診治指南,因此探索RVO-ME發病的相關危險因素有其必要性。研究證實,RVO-ME患者血漿Hcy表達水平較單純RVO及健康人更高,RVO-ME嚴重程度與血漿Hcy可能存在相關性[8]。因此,本研究探討RVO-ME發病的相關危險因素與血漿Hcy表達水平之間相關性,以期為臨床提供參考。報告如下。
1 資料與方法
1.1 一般資料 選取2020年1月至2022年1月確診的RVO患者74例(74眼)患者,設為對照組,同期確診的RVO-ME患者85例(85眼)患者,設為試驗組。課題經本院醫學倫理委員會批準,課題符合《赫爾辛基宣言》[9]醫學研究準則。
1.2 納入與排除標準
1.2.1 納入標準:①視力嚴重下降,視網膜靜脈呈臘腸狀,顯著迂曲、擴張;②視網膜(病變區)滲出、水腫,有火焰狀出血;③棉絨斑(視網膜血管旁);④CMT>250 μm,經OCT、FFA診斷為視網膜受累靜脈充盈時間延遲,無灌注、管壁滲漏(視網膜毛細血管),新生血管形成及RVO-ME及RVO者。
1.2.2 排除標準:①合并其他病因(糖尿病、高血壓等)引起的視網膜病變,黃斑變性、葡萄膜炎等引起的黃斑水腫(ME);②青光眼、黃斑前膜、玻璃體黃斑牽引綜合征、高眼壓、視網膜脫離等眼部病變或疾病;③各種眼部疾病治療史或手術史,如玻璃體視網膜治療、白內障手術等;④合并糖尿病、高血壓、心肌梗死、腦梗死等疾病者;⑤妊娠期、哺乳期女性;⑥未簽署《知情同意書》且臨床資料不完整者。
1.3 方法
1.3.1 樣本采集:記錄各研究對象(試驗組:85例RVO-ME患者,對照組:74例RVO患者)的姓名、年齡、性別、既往病史、RVO或RVO-ME患病情況(有無眼前段炎癥、晶狀體渾濁程度、眼別、眼壓(10 mm Hg≤正常參考值≤21 mm Hg)、RVO分型、黃斑中心凹厚度(CMT)值、視力等相關資料)。根據所有受試者的臨床表現、眼底照相結果、OCT和FFA檢查結果對RVO-ME患者進行分類:BRVO-ME、CRVO-ME、MBRVO-ME。
1.3.2 炎癥細胞因子檢測:①采集入組后此日清晨的適量(5 ml)空腹靜脈血,置入無菌試管中,離心處理(離心速率:3 000 r/min,離心時間:5 min),收集上清液,置于冰箱(4℃)保存,待檢,7 d內送檢。②利用酶聯免疫吸附法(enzyme linked immunosorbent assay,ELISA)及其配套試劑盒檢測房水中的VEGF、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)、白細胞介素-1β(interleukin-1β,IL-1β)及同型半胱氨酸(homocysteine,Hcy)等表達水平。
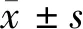
2 結果
2.1 RVO-ME發病與臨床指標的關系 對照組與試驗組間性別、病程、吸煙和喝酒情況,左右眼區別、眼前段炎癥情況、眼壓視力、高反射性、ME和RVO-ME分型的差異無統計學意義(P>0.05),年齡、既往眼病史、治療方式、CMT值、視網膜內層結構紊亂、TNF-α、IL-1β、IL-6、VEGF、Hcy是影響RVO-ME發病的單因素,差異有統計學意義(P<0.05)。見表1。

表1 2組各項臨床資料比較
2.2 RVO-ME發病的危險因素分析 將2.1中有統計學意義(P<0.05)的各指標設置為自變量,將RVO-ME設置為因變量進行Logistic回歸分析。結果發現,年齡、CMT、IL-1β、IL-6、VEGF和Hcy是影響RVO-ME發病的獨立危險因素(OR=5.268、5.623、6.514、8.562、3.264、6.598,P<0.05)。見表2。

表2 RVO-ME發病的危險因素分析
2.3 RVO-ME發病的危險因素與血漿Hcy的相關性分析 影響RVO-ME發病的獨立危險因素年齡(r=0.6892,P<0.001)、CMT(r=0.8125,P<0.001)、IL-1β(r=0.7534,P<0.001)、IL-6(r=0.7358,P<0.001)、VEGF(r=0.6580,P<0.001)與血漿Hcy水平呈正相關。見圖1。

圖1 RVO-ME發病的危險因素與血漿Hcy水平的相關性分析
3 討論
3.1 RVO-ME發病與各臨床指標的關系分析 通過分析發現,在所納入的各項指標中與RVO-ME發病相關的臨床指標涉及年齡、既往眼病史、治療方式、CMT、視網膜內層結構紊亂、TNF-α、IL-1β、IL-6、VEGF、Hcy等10項。研究證實,年齡越高RVO-ME復發率則越高,與本文中實驗組的年齡較對照組更高基本吻合,原因與老年患者靜脈狹窄(視網膜靜脈交叉處)相關,形成視網膜循環障礙[10],與本文結果相近。CMT、視網膜內層結構紊亂(disorganization of retinal inner layers,DRIL)及高反射灶是三種黃斑區超微結構,對RVO-ME的發生有影響。既往大量研究數據證實,CMT與ME復發相關,CMT越厚的RVO-ME患者重復注射VEGF的風險越高,部分患者注射之后可能存在短時間的CMT變薄的現象[11,12]。
DRIL最初作為預測糖尿病性ME預后的標志物出現,但隨著研究的深入,越來越多的研究數據證實,其與視網膜異常的血流[13,14]存在相關性,原因可能與RVO-ME可引起黃斑部視網膜的多種纖維結構改變有關,加之DRIL的發生與血流異常有相關性,受其影響的區域易致VEGF過表達[7],但具體因素有待更多研究佐證。針對眼內細胞因子與RVO-ME之間的相關性,研究數據證實,VEGF在RVO-ME發病機制中的作用舉足輕重,故而成為全球ME治療的一線方法。Noma等[15]發現,BRVO-ME患者不僅IL-6、IL-8表達升高(與本研究結果相近)及血小板衍生生長因子-AA(Platelet derived growth factor-AA,PDGF-AA)表達同樣會升高,提示炎癥細胞因子不僅參與RVO-ME的形成,還與ME的嚴重程度和復發存在相關性。RVO-ME的治療方式較多,大致可分為藥物單用和聯合治療兩類,由于ME發病機制復雜,故聯合治療RVO-ME的效果較單藥單用效果更佳。研究證實,抗VEGF與激光療法結合,可顯著降低抗VEGF藥物的注射次數[7]。
3.2 影響RVO-ME發病的獨立危險因素及其與血清Hcy的相關性分析 陸寅等[16]證實,年齡(≥60歲)、黃斑中心凹視網膜下出血和CMT(≥500 μm)是影響RVO-ME患者經康柏西普治療后ME消除效果的相關影響因素(P<0.05)。年齡≥60歲患者的視網膜反射點低于青壯年人群,加上該人群多伴有基礎疾病,RVO-ME發生后,視網膜炎癥反應往往更嚴重。CMT≥500 μm,黃斑中心凹視網膜下出血,均意味著RVO-ME患者的黃斑水腫情況更嚴重,視力損傷明顯,治療難度增大,預后受影響[17]。Logistic回歸分析發現,年齡、CMT(OR=5.268、5.623)與RVO-ME發病相關,佐證了上述分析,不再探討。
IL-1β、IL-6和均是白細胞介素家族的重要成員,前者由小膠質細胞和巨噬細胞分泌而來,后者由多種細胞產生并作用于多種細胞。李靈健[6]研究發現,實驗組(RVO患者35例35眼)的IL-1β、IL-6表達與對照組(單純特發性黃斑裂孔及白內障患者16例16眼)相比更高(P<0.05)。本文研究發現,RVO-ME患者的IL-1β、IL-6表達與RVO患者相比均顯著升高,Logistic回歸分析表明,IL-1β、IL-6均是影響RVO-ME發病的獨立危險因素(OR=6.514、8.562)。研究表明,在視網膜病變中IL-1β通過刺激視網膜色素上皮層(retinal pigment epithelium,RPE)和Müller細胞,促進趨化因子表達[18],而在這種情況下,白細胞會產生黏附與聚集,減緩血流速度。
而N-乙酰通過對NLP3/TLR-4/NF-κB信號通路參與IL-1β的調控,促進視網膜神經節細胞存活,減輕視網膜損傷。Pearlstein等[19]發現,IL-1β作為IL-6(視網膜Müller細胞)表達的有效誘導因子,激活p38絲裂原活化蛋白激酶。缺氧環境中IL-6miRNA(內皮細胞)的轉錄會隨著缺氧時間的延長而增加,誘導蛋白激酶R的激活,最終損傷視網膜神經節細胞[20],但在RVO-ME中,由于肌動蛋白絲的重排受IL-6的調控,細胞間的縫隙連接通透性會增加,故而參與ME的發生與發展[21]。本研究Logistic回歸分發現,VEGF也是影響RVO-ME發病的獨立危險因素(OR=3.264)。研究發現,當視網膜缺血缺氧時,VEGF通過一系列的生物學反應參與炎癥細胞因子表達的調控,如IL-6的炎癥作用便與之相關,進而實現介導和破壞血-視網膜屏障(Blood-retinal barrier,BRA)的目的[22]。而IL-1β、TNF-α等生成及炎癥反應的發生又與VEGFR-1和人胎盤生長因子(placental growth factor,PLGF)的特異性結合相關[23],VEGF和PLGF表達增加可產生黏附聚集,從而減緩血流速,加重視網膜的缺血缺氧,形成一個正反饋[6]。此外,又與VEGF介導的炎癥細胞因子表達升高,機體的炎癥反應又會再次加強,又形成另一正反饋[24,25]。
總之,隨著RVO-ME病情的不斷演進,VEGF及其炎癥細胞因子表達也會隨之遞增,是部分ME持續、反復的關鍵所在。pearson相關性分析表明,年齡、CMT、IL-1β、IL-6、VEGF均與血清Hcy存在相關性(r=0.6892、0.8125、0.7534、0.7358、0.6580,P<0.001),與既往研究數據基本吻合[26,27],但對于這些獨立危險因素與血清Hcy的具體作用機制,仍有待更大樣本佐證。

