無機聲敏劑在腫瘤治療和診斷中的研究進展

關鍵詞無機聲敏劑;聲動力治療;成像診斷;評述
惡性腫瘤是威脅人類生命健康的第一殺手,開發高效的惡性腫瘤治療手段至關重要。傳統的治療手段主要包括手術、化療和放療,均存在一些弊端,如侵入性治療、創面大、毒副作用大和恢復慢等,還存在引發第二原發癌的風險[1-3]。納米科學的進步以及納米技術與生物醫學工程的交叉融合為腫瘤精準診療帶來了新機遇,各種新興的腫瘤治療方法不斷涌現。相較于手術對人體造成的重大創傷,以及放療和化療對正常組織也同時造成大范圍損傷的治療方式,非侵入性光療法以外源性的光為刺激源,實現對病灶部位的定點治療,極大地減少了對正常組織的損傷。然而,光療法嚴重依賴于光的組織穿透性,對于深部腫瘤通常不能達到良好的治療效果,具有一定的局限性。聲動力治療(SDT)以超聲波(Ultrasound,US)為外部刺激源,其組織穿透深度比光療法更深,并且可以通過調節超聲的頻率和強度精確聚焦到腫瘤部位,最大限度減少對正常組織的損傷,具有傳統治療方法和光療法不可比擬的優勢。
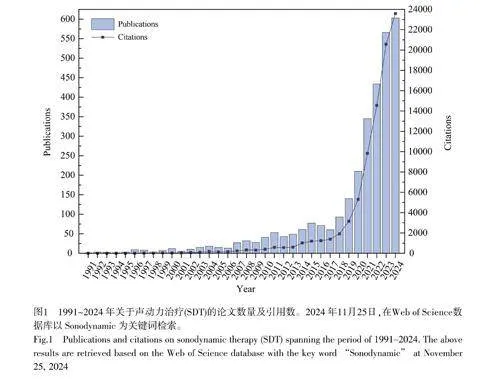
SDT是與光療法類似的非侵入性治療方法,其不同點在于SDT以超聲為刺激,激活聲敏劑在腫瘤部位產生具有細胞毒性的活性氧(ROS)進而誘導癌細胞死亡。1989年,Yumita等[4]研究發現血卟啉與超聲協同作用可以有效殺死腫瘤細胞,揭開了SDT的研究序幕。1991年召開的超聲波研討會首次提出了SDT的概念。在之后的三十多年,SDT進入了蓬勃發展的時期(圖1),各種超聲響應的有機物與無機物相繼被報道。
超聲響應的有機物包括最早發現的卟啉類物質[4-6]、5-氨基乙酰丙酸[7]、酞菁[8-9]、一些天然產物[10-11]和喹諾酮類抗生素[12-13]等。有機聲敏劑存在光毒性、不穩定性、水溶性差或腫瘤靶向性差等問題[14];相比之下,無機聲敏劑的尺寸與形態可控、易于修飾、物理與化學性質優異,并且具有高腫瘤靶向性,在腫瘤診療領域顯示出獨特的優勢。
本文概述了近年來無機聲敏劑在腫瘤治療和診斷中的研究進展。首先介紹了聲動力治療的基本原理,討論了影響聲動力治療效果的因素,并總結了提升SDT效果的策略;其次,歸納了不同體系無機聲敏劑的研究進展和抗腫瘤機制,并概述了無機聲敏劑在腫瘤成像方面的研究進展和應用原理;最后,針對無機聲敏劑存在的問題及未來發展方向進行了總結和展望。
1聲動力治療的機理及其一般原則
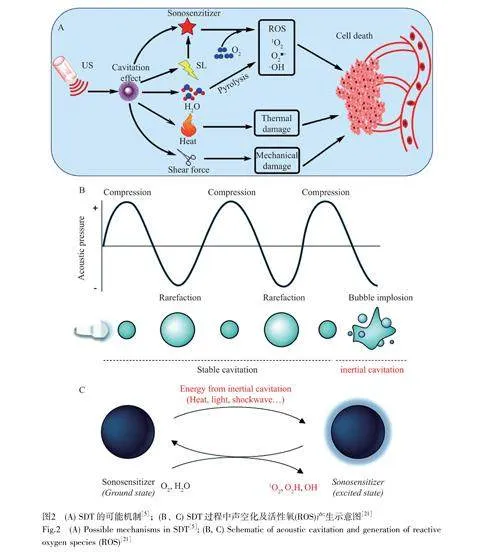
超聲波是一種波長極短的機械波,被廣泛應用于醫學診斷和治療。相較于光波,超聲波具有更好的組織穿透性(紫外或可見光:0.5~2.5mm;近紅外光:~1cm;超聲波:gt;10cm)[15-17]。近年來,以超聲波敏化聲敏劑產生ROS來殺死癌細胞的SDT被廣泛研究[18]。1989年,Yumita等[4]研究了血卟啉、超聲以及二者共存時對腫瘤細胞的影響,證明血卟啉增加了腫瘤細胞對超聲的敏感性。該研究表明只有低功率的超聲波存在時不足以損壞大部分腫瘤細胞,而聲敏劑與超聲波同時作用時的治療效果遠超對照組,這與SDT的機制有關。如圖2A所示,SDT的可能機制包括超聲誘導的細胞死亡、超聲空化和聲化學效應[19]。首先,超聲可以直接誘導細胞死亡[20];其次,超聲空化和聲化學效應相結合可以產生ROS以殺死腫瘤細胞。SDT過程中產生ROS的機制如圖2B和2C所示。對于無機聲敏劑,電子從基態轉移到激發態有兩種方式:一是聲敏劑直接被超聲活化激發;二是超聲波在溶液中傳播使空化氣泡形成及崩潰,即超聲空化現象。空化過程中伴隨有聲致發光,電子也可被聲致發光激發至激發態而形成負電子,留下正空穴。負電子可以還原氧氣而產生超氧自由基陰離子,正空穴可以氧化水和氫氧根離子生成羥基自由基和過氧化氫分子。此外,電子和空穴可以復合形成激子,伴隨有光子的發射,進而激發基態氧形成單線態氧[21]。通過以上過程生成具有高細胞毒性的ROS,能夠誘導DNA片段化、細胞骨架收縮和染色質收縮,從而導致細胞死亡[19,22]。此外,空化氣泡的破裂在原位產生熱量和強烈的剪切力,對細胞骨架和細胞膜造成嚴重的熱和機械損傷,從而引發腫瘤細胞死亡。
基于SDT的治療機制,可以通過以下兩種方法增強SDT的治療效果。(1)通過調節聲敏劑的帶隙結構,促進電子-空穴對的分離速率,捕獲光激發電子,防止電子-空穴對復合,提高ROS的產生水平。Cao等[23]在TiO2邊緣選擇性生長Au得到Au-TiO2。在超聲照射下,Au-TiO2的ROS生成效率比純TiO2高,這是因為負載的Au阻止受激的電子-空穴快速復合。(2)可以通過調節腫瘤微環境(TME)增強SDT的治療效果。TME具有乏氧、弱酸性、谷胱甘肽(GSH)過表達等特征,SDT過程中產生ROS的來源為氧氣,然而TME乏氧條件極大地限制了ROS的產生;此外,TME中高表達的GSH作為細胞內抗氧化劑,可以增強ROS的清除率。因此,可以通過耗竭GSH和緩解TME乏氧鞏固并提升SDT的治療效果。基于以上策略,Liang等[24]開發了氫化中空的Pt-TiO2異質結(HPT)。修飾的Pt作為納米酶催化內源性的H2O2分解產生O2,緩解腫瘤的乏氧環境,從而增強SDT的治療效果。此外,有研究者合成了富含氧缺陷的MnWOx-PEG,MnWOx表面的W6+可以被GSH還原為W5+,因此,MnWOx-PEG能夠通過消耗GSH提升SDT的治療效果[25-26]。
2無機聲敏劑在腫瘤治療中的應用
相較于有機聲敏劑,無機聲敏劑具有穩定性好和化學物理性質可控等優勢,在腫瘤治療方面展現出極大的應用潛力。目前,發展最成熟的無機聲敏劑是鈦基聲敏劑(最常見的是基于TiO2的聲敏劑),其次是基于其它金屬的聲敏劑,還有一部分是非金屬基聲敏劑。在無機聲敏劑的開發過程中,通常通過調控無機聲敏劑的結構和組成促進US誘導的電子與空穴分離,提高ROS的產生效率,進而增強SDT的治療效果。
2.1鈦基聲敏劑
2011年,Harada等[27]首次報道了純TiO2在超聲照射下對黑色素瘤細胞(C32)和皮下C32實體瘤的治療效果。此后,基于TiO2的聲敏劑研究進入了快速發展時期。2012年,Ninomiya等[28]采用乙型肝炎病毒L蛋白的一部分修飾TiO2,實現了對HepG2細胞的特異性識別,從而進行SDT。然而,TiO2作為聲敏劑具有一些局限性,如電子-空穴的快速復合((50±30)ns)導致ROS產率較低及帶隙寬等問題[1,29]。針對以上問題,研究者提出了不同的解決方法。
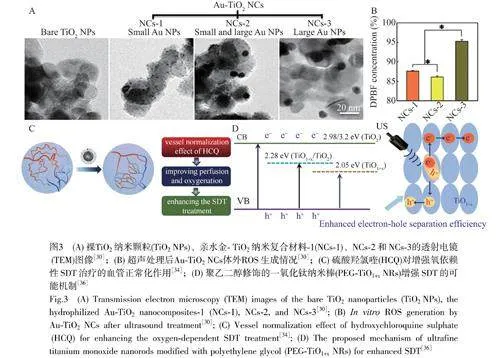
當金屬納米顆粒(NPs)與TiO2復合或者在TiO2中摻雜金屬離子時,可以顯著提高ROS產率,進而增強SDT的治療效果。2016年,Deepagan等[30]通過在TiO2表面沉積金納米顆粒(AuNPs)增強SDT的治療效果,考察了負載小顆粒、小/大顆粒和大顆粒AuNPs的TiO2(3種代表性復合物分別命名為NC-1、NC-2和NC-3,如圖3A所示)對SDT治療效果的影響。該研究發現水介質中的聲致發光強度在較短波長處較高。小顆粒Au能夠增加較短波長區域(lt;450nm)中的吸光度,并將激發的電子泵入TiO2,但是,由于小顆粒Au態密度低不能充當電子陷阱以防止電子-空穴復合;大顆粒Au可以充當電子陷阱,但是其等離子體誘導的電子注入僅發生在可見光區域(gt;500nm)。因此,小/大顆粒Au共載的TiO2的SDT的治療效果比只負載其中一種的效果更顯著(圖3B)。2020年,Bai等[31]通過在TiO2中摻雜鐵離子得到Fe-TiO2,由于鐵離子的摻雜使得TiO2的帶隙從3.2eV減小到2.3eV,Fe-TiO2納米點表現出比純TiO2更好的SDT治療效果。類似地,V5+和Gd3+摻雜都可以賦予TiO2更優的SDT性能[32-33]。
改變TiO2的形態結構也可以提高SDT的治療效果。2019年,Feng等[34]報道了一種裝載自噬抑制劑、癌細胞膜包被的基于中空介孔二氧化鈦納米顆粒的仿生納米平臺(CCM-HMTNPs/HCQ)。硫酸羥氯喹(HCQ)可以干擾細胞內Notch1的運輸和信號傳導,從而表現出血管正常化效應(圖3C),緩解了腫瘤缺氧,增強了強氧依賴性HMYNPs介導的SDT的治療效果。
構造缺陷是鞏固聲敏劑產生ROS性能的有效手段。2018年,Han等[35]在TiO2表面覆蓋一層TiO2-x得到黑色核殼結構的無序晶體(TiO2@TiO2-x)。在外部超聲照射下,具有豐富氧缺陷的TiO2-x層可以促進能帶結構中電子與空穴分離,顯著提高SDT的治療效果。2020年,Wang等[36]設計了超細的PEG-TiO1+x納米棒用于增強SDT。如圖3D所示,PEG-TiO1+x的帶隙低于TiO1+x/TiO2納米復合物和TiO2NRs,這可能是因為缺氧誘導的缺陷態與半導體帶邊的重疊。以上研究表明,TiO1+x作為電荷陷阱限制了電子-空穴對復合,更有效地產生活性氧,提高了SDT的性能。
除了TiO2基聲敏劑,科研人員還開發出了其它鈦基化合物聲敏劑。2021年,Geng等[37]通過在Ti3C2Tx表面進一步組裝NIR-Ⅱ響應的碳點(CD)得到0D/2D雜化CD@Ti3C2Tx異質結,用于深部腫瘤的高效SDT治療。CDs的CB底(0.63V)位于Ti3C2Tx的CB底(0.49V)上,形成能量差,驅動激發電子從CDs快速遷移到Ti3C2Tx納米片。轉移到Ti3C2Tx上的US活化電子將進一步與氧氣反應,產生大量的1O2。在CD@Ti3C2Tx界面處形成電子流,有效增強了電子轉移,阻止了電子空穴復合,顯著提高了Ti3C2Tx的ROS生成能力。2022年,Li等[38]開發了Ti3C2納米片聲敏劑,實現了光熱增強的SDT。除了碳化鈦外,科研人員還設計了其它鈦基半導體,以期得到更好的SDT治療效果。通過液相剝離法制備的氫化鈦TiH1.924納米點[39]以及TiN納米點[40]均能夠通過減小帶隙,抑制電子-空穴復合,實現SDT高效治療效果。
聯合/協同治療也是提高聲敏劑腫瘤治療效果的有效途徑。2019年,Gao等[41]合成了二氧化鈦包覆的金納米片異質結構(AuNPL@TiO2),實現了光熱治療和SDT的協同治療。此外,在V-TiO2中,V5+可以催化H2O2生成·OH,實現化學動力學與SDT的協同治療。2015年,Shi等[42]研制了一種新型介孔二氧化鈦納米顆粒MTN,MTN負載多西紫杉醇(DTX),再以β-環糊精(β-CD)封口得到MTN@DTX-CD,DTX在超聲觸發下被釋放,實現了化學治療和SDT治療。2021年,Tan等[43]合成了一種可轉化的核殼納米超聲增敏劑(TiO2@CaP),與抗PD1抗體組合使用,實現了SDT與免疫治療的協同治療。
2.2其它金屬基聲敏劑
隨著SDT研究不斷發展,其它金屬基聲敏劑也相繼出現。從金屬種類方面,已報道的作為聲敏劑的金屬元素包括Zn、Mo、Bi、Sn、V、Au、Ag、Pt、Co、Ni和Cu等;按化合物種類分類,大致可分為金屬氧化物、金屬硫(屬)化物以及復合物聲敏劑等。
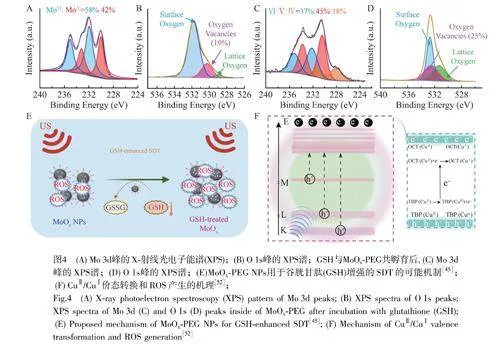
其它金屬基聲敏劑多數為金屬氧化物,金屬氧化物聲敏劑又可分為單金屬氧化物和雙金屬氧化物。2020年,Liu等[44]采用缺陷工程合成了Gd3+摻雜的氧化鋅納米子彈(D-ZnOx:Gd)。D-ZnOx:Gd具有豐富的氧空位,能夠提供電子俘獲位點,促進超聲照射后電子與空穴的分離。此外,D-ZnOx:Gd對氧氣和水分子具有更強的吸附作用,能夠進一步增強ROS產生能力。D-ZnOx:Gd在近紅外二區(NIR-Ⅱ)生物窗口具有良好的吸收,在NIR-Ⅱ激光照射下能有效地將光轉化為熱,進一步消除腫瘤細胞。Wang等[45]合成了MoOx-PEG,MoOxNP中的“X”值約為2.80(圖4A和4B),表明MoOxNP中存在多價Mo元素和氧缺陷。如圖4C和4D所示,與GSH共孵育后,Mo的價態整體降低,氧空位比例增加,以上結果都證明了GSH具有還原性。如圖4E所示,MoOxNP的氧空位可以顯著延遲電子-空穴對的復合,有利于提高ROS的產生水平,增強SDT。Cao等[46]開發了氧化鉍納米超聲增敏劑(Bi-Hj),在Bi-Hj中同時構建了肖特基異質結和氧空位,促進了超聲觸發的電子-空穴對分離,提高了電荷利用效率。此外,Bi-Hj具有多孔結構,可以負載代謝調節藥物阿托伐醌(ATO)以阻斷線粒體呼吸,導致耗氧量減少,增強SDT的治療效果。2021年,Dong等[47]合成了Bi2MoO6納米帶(BMONRs)。BMONRs可以消耗GSH,破壞氧化還原穩態;其氧空位還可作為電子捕獲位點抑制電子-空穴對重組;超聲波還導致壓電極化和能帶傾斜。基于以上原因,BMONRs具有出色的產生ROS的能力。2023年,Zhang等[48]開發了ZnSnO3:Nd納米粒子。利用Nd3+取代Zn2+使得O2p非鍵合態向費米能級移動,減小帶隙。不等電荷取代還可以形成電子陷阱和氧空位,縮短電子遷移距離,加速電子-空穴分離,抑制載流子復合,提高聲靈敏度,增強SDT效應。
近年來,金屬硫屬化物聲敏劑也被廣泛研究。Liang等[49]設計了多功能的Pt-VS4。由于VS4具有窄帶隙(1.12eV),其電子和空穴在超聲照射下可以輕易分離,產生1O2。助催化劑鉑有助于捕獲電子,GSH則可捕獲空穴,因而Pt-VS4復合材料可以延長電荷的壽命,高效產生ROS。Li等[50]將PluronicF-127修飾的Ag2SQD包裹在紅細胞囊泡中得到(Ag2SQDs@P)R,利用Ag2S量子點作為聲敏劑產生ROS,紅細胞中的過氧化氫酶催化內源性H2O2,改善腫瘤缺氧,實現酶增強的SDT。除此之外,其它金屬硫屬化合物也被研究用于惡性腫瘤的SDT治療。本研究組開發了一種富含缺陷的非晶態IrTe2(G-IrTe2)聲敏劑[51]。在超聲波刺激下,非晶態IrTe2中Ir-Te鍵極易斷裂,釋放的自由電子與氧氣反應生成單線態氧(1O2)。G-IrTe2具有類過氧化氫酶活性,能夠提供豐富的氧氣,增強SDT的治療效果。
除了上述基于金屬化合物的聲敏劑外,還有基于單一金屬的聲敏劑以及復合聲敏劑。2022年,Feng等[52]開發了集聲動力和催化效應于一個活性中心的銅納米點(CuNDs)。如圖4F所示,CuNDs中的Cu占據兩種類型的非等效晶體學位置,包含八面體銅(OCTCuⅡ)和三角雙錐銅(TBPCuⅡ)。在超聲誘導聲致發光條件下,超聲通過光電流觸發CuNDs的電子發射,導致高能電子-空穴對分離,并伴隨低能電子-空穴對雪崩。來自TBPCuⅡ的超聲激活電子轉移到每個相鄰的OCTCuⅡ,產生OCTCuⅠ(電子)和TBPCuⅢ(空穴)。當電子下降到最低的未占據帶OCTCuⅠ時,無法返回到相鄰的TBPCuIII,O2和H2O得到因上述過程而產生的能量以產生ROS。因此,超聲誘導的CuⅡ到CuⅠ的轉變可以催化H2O2轉化為·OH;同時,價態轉變導致的電子-空穴對的分離促進了用于SDT的ROS的產生。2023年,Zhang等[53]合成了Au@Co3O4-PVP(AC-PVP)作為金基聲敏劑,在超聲下可以產生·O2–和·OH。此外,AC-PVP還可以作為葡萄糖氧化酶催化產生H2O2,Co3O4具有類過氧化氫酶活性,催化H2O2產生氧氣,Co3O4還可降低細胞內GSH原位催化反應的水平,防止生成的ROS被GSH消耗,進一步增強ROS依賴性SDT的效果。
2.3非金屬基聲敏劑
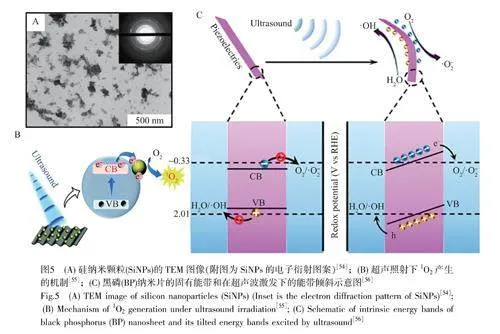
基于非金屬納米結構的無機聲敏劑目前也有少量研究。2014年,Osminkina等[54]制備了硅納米顆粒(SiNPs),SiNPs可作為超聲誘導抑制Hep-2癌細胞活力(圖5A)。2018年,Jiang等[55]首次合成了基于黑磷(BP)納米片的2D聲敏劑。如圖5B所示,BP納米片是二維半導體,具有高效的單重態-三重態交叉和激發三重態的長壽命(高達100μs),這有助于其與氧氣相互作用產生1O2。2020年,Li等[56]研究了黑磷納米片在超聲下的ROS產生性能。如圖5C所示,對于固有能帶不利于ROS產生的BP,超聲波將機械應變引入BP納米片,導致能帶傾斜,有利于產生ROS。
3無機聲敏劑在腫瘤成像診斷中的應用
腫瘤的早發現和早治療具有重大的臨床意義,能夠顯著改善預后和提高生存率。腫瘤的診療一體化也成為目前的研究熱點之一。目前,利用無機聲敏劑進行成像診斷的方式主要包括計算機斷層掃描成像(CT)、磁共振成像(MRI)、超聲成像(USI)、光聲成像(PAI)和熒光成像(FLI)等。
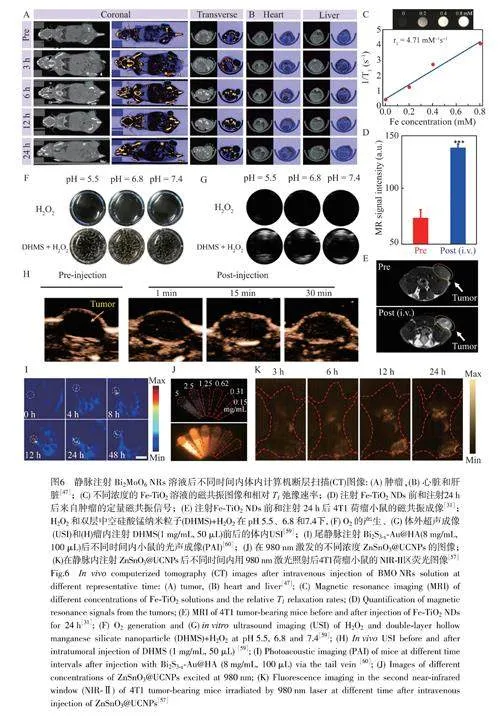
CT成像根據不同器官對X射線的吸收或衰減能力不同,利用計算機處理從不同角度采集的X射線圖像的組合,形成掃描對象的解剖圖片。目前,具備CT成像和SDT功能的無機診療一體化試劑主要是基于具有高X射線吸收系數的元素所制備的納米材料。Dong等[47]設計了Bi2MoO6納米帶(BMONRs)。由于高原子序數的Bi元素具有超高的X射線衰減能力,因此BMONRs能夠實現對比增強的CT成像(圖6A和6B)。同樣,鉍基納米聲敏劑(Bi-HJ)也具有CT成像能力[46]。此外,含有稀土元素[48,57]、Au[23]和Ag[58]等元素的無機聲敏劑也能夠實現CT成像。
MRI是體內氫質子在外磁場作用下沿著一個方向排列,施加射頻脈沖后質子自旋偏轉,在恢復到初始狀態的過程中即可產生縱向弛豫時間T1和橫向弛豫時間T2,經過采集編碼計算反映組織結構的T1和T2值的信號即可得到MRI圖像。MRI造影劑可分為T1磁共振造影劑、T2磁共振造影劑以及T1/T2雙加權造影劑。T1和T2弛豫時間與磁性有關,產生磁性的條件是具有未成對電子,因此含有Gd、Mn和Fe等元素的無機聲敏劑成為了MRI成像造影劑的候選材料。如圖6C~6E所示,Fe-TiO2NDs中鐵離子的摻雜不僅增強了TiO2本身的SDT性能,還賦予該納米點MRI成像能力[31]。同樣,Gd離子的摻雜也可以得到SDT性能更優的具有MRI成像能力的聲敏劑[33]。
USI通過USI造影劑對超聲波的強散射線來提高超聲成像的清晰度和分辨率。USI造影劑主要分為以下三類:基于氣體(微泡)的USI造影劑、具有特殊形狀或結構的納米材料和具有液體核和固體殼的復合納米粒子。2020年,Pan等[59]制備了雙層空心硅酸錳納米顆粒(DHMS),光學顯微鏡圖像顯示在pH6.8條件下產生的氣泡量最大(圖6F~6H)。對于含有H2O2和DHMS的溶液,捕獲的USI圖像對比度顯著增強,表明DHMS可作為USI造影劑。
PAI的原理是激光照射內源性發色團或外源性造影劑使得光子能量轉化為熱量,從而導致膨脹產生超聲波,根據超聲波信號可以重建出組織的光吸收分布圖像。常用的PAI造影劑分為兩類:(1)基于內源性發色團的造影劑,如黑色素和血紅蛋白等;(2)具有高穩定性的外源性造影劑,即具有高光學吸收系數和高光熱轉換效率的分子或納米材料。Meng等[60]合成了具有優異的近紅外吸收和光熱性能的Bi2S3-x-Au@HA。由圖6I可知,Bi2S3-x-Au@HA注射12h后腫瘤部位的PA信號達到最大值,表明Bi2S3-x-Au@HA可作為NIR-IIPAI造影劑。
FLI是指在激光照射下電子從基態躍遷到激發態而后又返回基態時,以光子釋放能量,發出熒光用以成像。Yang研究組[57]報道了類西瓜結構的聲敏劑ZnSnO3@UCNPs(NaYF4:19%Yb,4.78%Tm,1.2%Er記為UCNPs)。由于ZnSnO3@UCNPs中存在Er3+,在980nm激發下能夠實現1525nm的近紅外發光,進而實現深層組織穿透,用于NIR-Ⅱ區熒光成像。如圖6J~6K所示,NIR-Ⅱ熒光強度與ZnSnO3@UCNPs的濃度呈線性相關,靜脈注射12h后,小鼠腫瘤部位的熒光信號達到最大值。此外,Yang研究組還報道了鈣鈦礦型的ZnSnO3:Nd[48],Nd3+摻雜能夠實現位于1064nm的NIR-Ⅱ區熒光發射,使其可作為NIR-Ⅱ熒光成像造影劑。
除上述的單一模式成像外,無機聲敏劑還能夠實現雙模式成像,為臨床診斷提供更多的信息。2019年,Zhong等[61]制備了具有PAI/CT雙模成像能力的PtCu3-PEG納米籠。由于PtCu3-PEG在近紅外區具有高的吸光度,因此PtCu3-PEG可用作PAI造影劑,并且PAI信號可在腫瘤區域持續至少3d(圖7A)。由于Pt強大的X射線衰減能力,PtCu3-PEG還可作為CT成像造影劑(圖7B)。同年,Lin等[62]設計合成了PEG和ROS敏感聚合物包覆JanusAu-MnO納米粒子形成納米囊泡(JNPVes)。在超聲刺激下,囊泡分解為較小的JanusAu-MnONPs,隨后GSH引發MnO降解,釋放出Mn2+和Au。采用原位肝荷瘤小鼠模型證明了JNPVes的體內治療和成像效果(圖7C)。如圖7D所示,降解釋放的Mn2+可作為T1加權MRI,靜脈注射后,隨時間延長,腫瘤T1MRI信號強度顯著增加。此外,該智能納米平臺還實現了NIR-Ⅱ區的PAI成像。如圖7E所示,分別檢測了808和1260nm處的PAI圖像,后者顯示出可忽略的背景干擾和精確的腫瘤定位能力。如圖7F所示,注射JNPVes后,1260nm處的PAI信號隨時間延長而增加,表明JNPVes具有高腫瘤積累和滲透率。因此,采用JanusAu-MnO實現了MRI/PAI雙模成像。
目前報道的無機聲敏劑已能夠實現腫瘤的CT、MRI、FLI、PAI和USI等成像診斷。通常情況下,含有高X射線吸收系數元素的無機聲敏劑具有良好的CT成像效果。若無機聲敏劑含具有未成對電子的Gd、Mn、Fe等元素,能夠實現T1或T2加權MRI。FLI要求無機聲敏劑具有熒光發射,特別是近紅外熒光發射。具有高光學吸收系數和高光熱轉換效率的無機聲敏劑通常具有良好的PAI能力。能夠實現USI的無機聲敏劑一般具有特殊的結構。目前,無機聲敏劑用于CT和MRI腫瘤診斷的研究已較普遍,能夠實現FLI和PAI的無機聲敏劑的報道相對較少,而用于腫瘤USI的無機聲敏劑則有待進一步研究和開發。
4總結與展望
無機聲敏劑的結構和性能穩定,制備方法多樣,具有可調控的腫瘤靶向性,相較于有機聲敏劑具有諸多優勢。本文按照無機聲敏劑的分類對其在腫瘤治療方面的研究進展進行了評述。此外,按照成像方式的不同,綜述了無機聲敏劑在腫瘤成像診斷方面的進展。基于SDT的作用機理,可以通過摻雜、組分和結構調控、構造缺陷等手段對無機聲敏劑進行合理的材料設計,實現高效的SDT和高分辨的成像診斷。雖然無機聲敏劑的研究已取得了很大的進步,但其在以下方面還需要進一步探索和優化。(1)無機聲敏劑依然存在靶向能力差、敏化效率低和治療機制不夠清楚等問題。對此,開展跨學科合作研究可能是較好的選擇。(2)制備生物安全的無機聲敏劑納米平臺至關重要,應全面系統地評價聲敏劑的長期毒性、急性毒性、生殖毒性、藥代動力學等毒性和藥理作用,促進聲敏劑發展。(3)由于超聲波具有深層組織穿透性,SDT具有廣闊的臨床應用前景,目前關于聲敏劑的臨床研究主要集中在有機物,無機聲敏劑的臨床研究嚴重缺乏,對于無機聲敏劑在SDT中的臨床應用性和有效性的認識還有限。因此,需要對更多的臨床樣本進行研究,以提高SDT的普適性和治療效果。

