羅望子種子中木葡聚糖的提取工藝優(yōu)化
孫 婷,劉桂亭,林莎莎,鄒圣燦,王寶群
(青島琛藍(lán)海洋生物工程有限公司,山東青島 266104)
羅望子(Tamarindus indica L.) 是蘇木科(Cae salpiniaceae) 酸豆屬(Tamarindus) 的常綠大型喬木[1],主要產(chǎn)于印度、孟加拉國(guó)、緬甸等地,在我國(guó)云南、廣西等地區(qū)也有種植[2-4]。羅望子種子中的多糖含量高達(dá)60%[5],其中木葡聚糖(Xyloglucan,XG) 是羅望子種子中的主要成分之一。因XG 資源豐富、工業(yè)生產(chǎn)成本低,又具有穩(wěn)定、增稠等性質(zhì),可被用于代替果膠、明膠等作為一種食品添加劑,廣泛應(yīng)用于各種飲品、食品中。除此之外,XG 還有著良好的流變特性[6-7]、凝膠性[8-12]、黏附性[13]、生物相容性[14],以及藥物緩釋[15-20]、降血糖血脂[21-22]、調(diào)節(jié)膽汁代謝[23]、體內(nèi)防粘連[24-25]等生物活性,使眾多學(xué)者越來(lái)越關(guān)注其在生物醫(yī)藥、醫(yī)用材料等領(lǐng)域的應(yīng)用。
羅望子種子中雖含有大量木葡聚糖,但其仍含有蛋白質(zhì)(15.0%~20.0%)[26]、脂肪(3.0%~7.5%)[27]、纖維(2.5%~8.0%)[28]等雜質(zhì)。蛋白質(zhì)和脂肪是羅望子木葡聚糖提取過(guò)程中需重點(diǎn)去除的對(duì)象,相比之下,脂肪較易去除,而蛋白質(zhì)則較為困難。羅望子種子中的蛋白質(zhì)約有61%為可溶性蛋白,39%為不可溶性蛋白。同時(shí),可溶性蛋白由約21%的鹽溶性蛋白、19%的水溶性蛋白、17%的堿溶性蛋白及4%的醇溶性蛋白組成。因此,想要獲得高純度木葡聚糖的關(guān)鍵是在不引起多糖損失的前提下,高效去除羅望子種子中水溶性蛋白質(zhì)。目前,對(duì)于羅望子木葡聚糖的提取純化方法有2 種,分別是經(jīng)典的水提醇沉法和有機(jī)酸提取法。水提醇沉法主要是通過(guò)醇沉將大部分多糖提取出來(lái),而有機(jī)酸提取法則是通過(guò)等電點(diǎn)沉降法去除蛋白質(zhì),2 種方法均可去除羅望子木葡聚糖中部分蛋白質(zhì)。通過(guò)這2 種方法制備的多糖,有著溶解性差、純度不高等缺點(diǎn),極大地限制了羅望子木葡聚糖在生物醫(yī)藥和醫(yī)用材料中的應(yīng)用,尤其是對(duì)于植入體內(nèi)應(yīng)用的第三類醫(yī)用材料,因?yàn)檩^高的蛋白質(zhì)殘留有導(dǎo)致免疫反應(yīng)的風(fēng)險(xiǎn),現(xiàn)亟需一種可以制備高純度羅望子木葡聚糖的方法。采用酸、堿處理,結(jié)合活性炭吸附、透析的方法去除多糖中的蛋白質(zhì),并對(duì)工藝進(jìn)行初步研究,為木葡聚糖的提取工藝提供新思路,為其在生物醫(yī)藥、醫(yī)用材料、食品、造紙、紡織等領(lǐng)域的應(yīng)用提供思路。
1 材料與方法
1.1 材料
1.1.1 材料與試劑
羅望子,云南貓哆哩集團(tuán)提供;醋酸(分析純)、考馬斯亮藍(lán)G-250、85%磷酸(分析純)、無(wú)水乙醇(分析純)、氫氧化鈉(分析純),國(guó)藥集團(tuán)化學(xué)試劑有限公司提供;活性炭,福建元力活性炭股份有限公司提供;透析袋(50 kDa),湖南羽博生物科技有限公司提供;牛血清白蛋白,北京索萊寶科技有限公司提供;鱟試劑(0.1 mL/支)、細(xì)菌內(nèi)毒素檢測(cè)用水、內(nèi)毒素標(biāo)準(zhǔn)品(10 EU /支),湛江博康海洋生物有限公司提供。
1.1.2 儀器與設(shè)備
SF-2000 型高速粉碎機(jī),上海市藥材有限公司產(chǎn)品;HH-1 型數(shù)顯恒溫水浴鍋,常州丹瑞實(shí)驗(yàn)儀器設(shè)備有限公司產(chǎn)品;AR224CN 型電子天平,奧豪斯儀器(常州) 有限公司產(chǎn)品;JSB6-02 型電子計(jì)重秤,上海浦春計(jì)量?jī)x器有限公司產(chǎn)品;DZ267-32C10 型離心機(jī),上海安亭科學(xué)儀器廠產(chǎn)品;Master-E plus UF 型純水機(jī),上海和泰儀器有限公司產(chǎn)品;LYO-100FS 型冷凍干燥機(jī),北京開元永盛凍干技術(shù)有限公司產(chǎn)品;T6 型新世紀(jì)紫外可見(jiàn)分光光度計(jì),北京普析通用儀器有限責(zé)任公司產(chǎn)品;雷磁PHS-3E型pH 計(jì),上海儀電科學(xué)儀器股份有限公司產(chǎn)品;Alpha 型傅里葉變換紅外光譜儀,美國(guó)Bruker 公司產(chǎn)品;AVANCE III HD 400 MHz 型核磁共振譜儀,美國(guó)Bruker 公司產(chǎn)品。
1.2 試驗(yàn)方法
1.2.1 羅望子木葡聚糖的提取工藝流程
將羅望子種子經(jīng)過(guò)烘炒、粉碎、過(guò)篩、脫脂處理得到羅望子多糖粗粉;精確稱取一定量的羅望子多糖粗粉,在高溫下,按一定比例用水溶解,將溶液離心取上清液,得到羅望子多糖水提液;向水提液中加入醋酸,調(diào)節(jié)pH 值至2.5~4.5,靜置沉降;再取上清液加入氫氧化鈉,調(diào)節(jié)pH 值至10.5~12.5,靜置沉降;取上清液加入活性炭吸附,離心后將上清液裝入50 kDa 透析袋中透析;將透析后的溶液經(jīng)過(guò)冷凍干燥得到羅望子木葡聚糖。
1.2.2 單因素試驗(yàn)
(1) 料液比對(duì)羅望子木葡聚糖純度的影響。分別選取料液比為1∶1,1∶2,1∶3,1∶4,1∶5,酸處理pH 值為3,堿處理pH 值為12,在其他步驟不變的條件下進(jìn)行提取,測(cè)定樣品蛋白質(zhì)殘留量。
(2) 酸處理pH 值對(duì)羅望子木葡聚糖純度的影響。分別選取酸處理pH 值為2.5,3.0,3.5,4.0,4.5,料液比為1∶1,堿處理pH 值為12,在其他步驟不變的條件下進(jìn)行提取,測(cè)定樣品蛋白質(zhì)殘留量。
(3) 堿處理pH 值對(duì)羅望子木葡聚糖純度的影響。分別選取堿處理pH 值為10.5,11.0,11.5,12.0,12.5,料液比1∶1,酸處理pH 值為3,在其他步驟不變的條件下進(jìn)行提取,測(cè)定樣品蛋白質(zhì)殘留量。
1.2.3 正交試驗(yàn)
根據(jù)單因素試驗(yàn)結(jié)果,設(shè)計(jì)正交試驗(yàn)。
L9(34)正交試驗(yàn)因素與水平設(shè)計(jì)見(jiàn)表1。
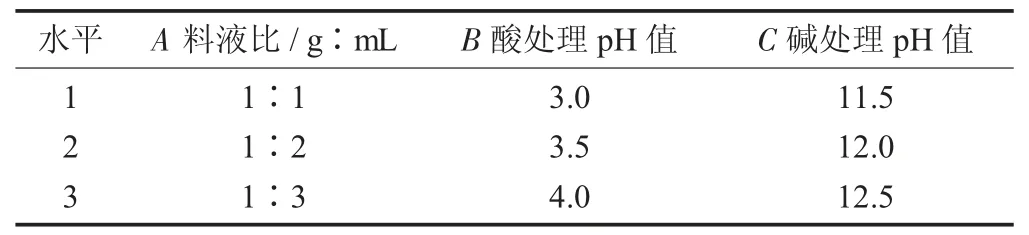
表1 L9(34)正交試驗(yàn)因素與水平設(shè)計(jì)
1.2.4 多糖含量檢測(cè)
依據(jù)“苯酚- 硫酸法”測(cè)定樣品中多糖含量。
1.2.5 蛋白質(zhì)殘留量檢測(cè)
依據(jù)《中華人民共和國(guó)藥典》 (2020 版) 四部通則0731 蛋白質(zhì)含量測(cè)定法中第五法“考馬斯亮藍(lán)法(Bradford 法)”測(cè)定樣品中蛋白質(zhì)殘留量。
1.2.6 細(xì)胞內(nèi)毒素檢測(cè)
依據(jù)《中華人民共和國(guó)藥典》 (2020 版) 四部通則1143 細(xì)菌內(nèi)毒素檢查法中方法2“光度檢測(cè)法”測(cè)定樣品中細(xì)菌內(nèi)毒素含量。
1.2.7 紫外吸收光譜
將所得木葡聚糖配制成質(zhì)量濃度4 mg/mL 的水溶液,待充分溶解后進(jìn)行紫外光譜掃描,波長(zhǎng)范圍為200~400 nm。
1.2.8 紅外吸收光譜
將所得木葡聚糖與溴化鉀按比例(1∶100) 混勻、研磨、壓片后進(jìn)行紅外光譜掃描,掃描的范圍為4 000~500 cm-1。
2 結(jié)果與分析
2.1 單因素試驗(yàn)結(jié)果
2.1.1 料液比對(duì)羅望子木葡聚糖純度的影響
分別選取料液比為1∶1,1∶2,1∶3,1∶4,1∶5(g∶mL),對(duì)羅望子木葡聚糖純度的影響。
料液比對(duì)羅望子木葡聚糖純度的影響見(jiàn)圖1。
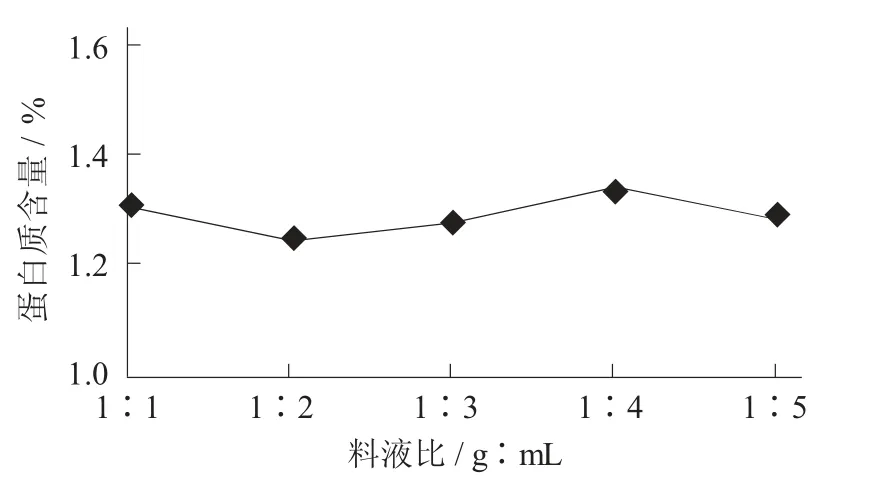
圖1 料液比對(duì)羅望子木葡聚糖純度的影響
由圖1 可知,料液比對(duì)羅望子木葡聚糖蛋白質(zhì)含量的影響并不顯著,當(dāng)料液比為1∶2 時(shí),蛋白質(zhì)含量最低,為1.25%。因此,選擇1∶2 為最佳料液比。
2.1.2 酸處理pH 值對(duì)羅望子木葡聚糖純度的影響
分別選取酸處理pH 值為2.5,3.0,3.5,4.0,4.5,對(duì)羅望子木葡聚糖純度的影響。
酸處理pH 值對(duì)羅望子木葡聚糖純度的影響見(jiàn)圖2。
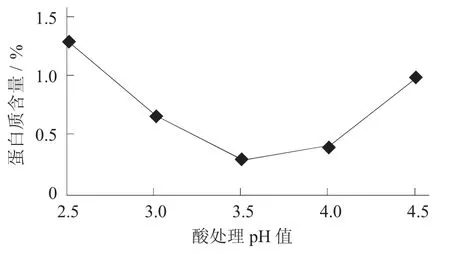
圖2 酸處理pH 值對(duì)羅望子木葡聚糖純度的影響
羅望子粗粉中含有大量水溶性蛋白質(zhì),通過(guò)調(diào)節(jié)pH 值至蛋白質(zhì)的等電點(diǎn)(Protein isoelectric point,PI),使蛋白質(zhì)溶解性變小,形成容易去除的沉淀物。由圖2 可知,酸處理pH 值對(duì)羅望子木葡聚糖蛋白質(zhì)含量的影響較大,隨著pH 值升高,蛋白質(zhì)含量先降低后升高,在pH 值為3.5 時(shí)蛋白質(zhì)含量最低,說(shuō)明大部分帶負(fù)電荷的蛋白質(zhì)被去除。因此,選擇pH 值3.5 為最佳酸處理pH 值。
2.1.3 堿處理pH 值對(duì)羅望子木葡聚糖純度的影響
分別選取堿處理pH 值為10.5,11.0,11.5,12.0,12.5,對(duì)羅望子木葡聚糖純度的影響。
堿處理pH 值對(duì)羅望子木葡聚糖純度的影響見(jiàn)圖3。

圖3 堿處理pH 值對(duì)羅望子木葡聚糖純度的影響
由圖3 可知,堿處理pH 值對(duì)羅望子木葡聚糖蛋白質(zhì)含量的影響較大,隨著pH 值升高,蛋白質(zhì)含量先降低后升高,在pH 值為12 時(shí)達(dá)到最低值,說(shuō)明大部分帶正電荷的蛋白質(zhì)被去除。因此,選擇pH 值12 為最佳堿處理pH 值。
2.2 羅望子木葡聚糖純度正交試驗(yàn)結(jié)果
為優(yōu)化羅望子木葡聚糖的提取工藝,選取對(duì)提取工藝影響最大的3 個(gè)因素,每個(gè)因素設(shè)置3 個(gè)水平:料液比(1∶1,1∶2,1∶3)、酸處理pH 值(3.0,3.5,4.0)、堿處理pH 值(11.5,12.0,12.5)進(jìn)行L9(34)正交試驗(yàn)。
L9(34)正交試驗(yàn)結(jié)果與分析見(jiàn)表2。

表2 L9(34)正交試驗(yàn)結(jié)果與分析
由表2 可知,羅望子木葡聚糖最佳提取工藝為料液比1∶3,酸處理pH 值3.5,堿處理pH 值12.0。通過(guò)計(jì)算極差可知酸處理pH 值對(duì)羅望子木葡聚糖純度的影響最大,其次為堿處理pH 值,而料液比的影響最小。
2.3 驗(yàn)證性試驗(yàn)
羅望子木葡聚糖最佳提取工藝正交試驗(yàn)中,因此需在該條件下再進(jìn)行驗(yàn)證試驗(yàn):將羅望子多糖粗粉按料液比為1∶3 進(jìn)行溶解,待樣品溶解后將溶液離心取上清液,得到“羅望子多糖水提液”;向水提液中加入醋酸,調(diào)節(jié)pH 值至3.5,靜置沉降;再取上清液加入氫氧化鈉,調(diào)節(jié)pH 值至12.0,靜置沉降;隨后,取上清液加入活性炭吸附,離心后將上清液裝入50 kDa 透析袋中透析;最后,將透析后的溶液經(jīng)過(guò)冷凍干燥得到“精制羅望子木葡聚糖”。
2.3.1 理化指標(biāo)檢測(cè)
經(jīng)檢測(cè)精制羅望子木葡聚糖的蛋白質(zhì)含量為0.2%,細(xì)菌內(nèi)毒素含量為150 EU/g,總糖含量為99.63%。
2.3.2 紫外吸收光譜檢測(cè)
羅望子木葡聚糖的紫外吸收光譜見(jiàn)圖4。
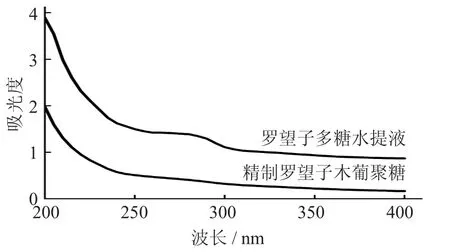
圖4 羅望子木葡聚糖的紫外吸收光譜
由圖4 可知,羅望子多糖水提液于波長(zhǎng)260 nm處無(wú)吸收峰,但在波長(zhǎng)280 nm 處有較大吸收峰,證明該溶液含有大量蛋白質(zhì)。精制羅望子木葡聚糖于波長(zhǎng)260 nm 和280 nm 處均無(wú)吸收峰,表示樣品中不含有蛋白質(zhì)和核酸,或含量很少,與正交試驗(yàn)結(jié)果相同。
2.3.3 紅外吸收光譜檢測(cè)
羅望子木葡聚糖的紅外吸收光譜見(jiàn)圖5。

圖5 羅望子木葡聚糖的紅外吸收光譜
由圖5 可知。表3 列舉了部分峰的具體峰位置。2 個(gè)樣品在3 600~3 200 cm-1處有O-H 伸縮振動(dòng)的吸收峰,在3 000~2 800 cm-1處有C-H 伸縮振動(dòng)的吸收峰,以上2 個(gè)峰為糖類物質(zhì)的特征吸收峰。同時(shí),2 個(gè)樣品在1 380~1 370,1 040~1 030,940,890 cm-1處均有木葡聚糖的特征峰,其中1 380~1 370 cm-1為木葡聚糖中CH2彎曲振動(dòng)[29],1 040~1 030 cm-1為木葡聚糖中的C-O-C 伸縮振動(dòng),940 cm-1為葡萄糖的環(huán)振動(dòng),890 cm-1為葡萄糖和木糖β 端基的鏈接。說(shuō)明2 個(gè)樣品中均含有木葡聚糖。此外,羅望子多糖水提液在1 530 cm-1處有N-H 彎曲振動(dòng)吸收峰,在1 250 cm-1處有C-N 伸縮振動(dòng)峰,這2 個(gè)峰為蛋白質(zhì)或多肽的特征吸收峰,而在精制羅望子木葡聚糖中不存在這2 個(gè)峰,說(shuō)明經(jīng)最佳提取方案制備的精制羅望子木葡聚糖其純度大幅度提高,而蛋白質(zhì)含量較低,與正交試驗(yàn)、紫外吸收光譜結(jié)果相似。

表3 羅望子木葡聚糖的紅外測(cè)試結(jié)果/ cm-1
羅望子木葡聚糖的紅外測(cè)試結(jié)果見(jiàn)表3。
3 結(jié)論
以羅望子種子為原料,利用羅望子木葡聚糖耐熱、耐酸堿的特性,采用酸、堿處理,結(jié)合活性炭吸附、透析的方法去除多糖中的蛋白質(zhì),優(yōu)化了羅望子木葡聚糖的提取工藝。在單因素試驗(yàn)的基礎(chǔ)上,通過(guò)正交試驗(yàn)分析料液比、酸處理pH 值、堿處理pH 值3 種因素對(duì)木葡聚糖純度的影響。試驗(yàn)結(jié)果表明,該提取工藝的最佳條件為料液比1∶3,酸處理的pH 值3.5,堿處理的pH 值12.0;各因素對(duì)木葡聚糖純度影響的大小順序?yàn)樗崽幚韕H 值>堿處理pH 值>料液比。經(jīng)驗(yàn)證,在最佳條件下,羅望子木葡聚糖的細(xì)菌內(nèi)毒素含量為150 EU/g,總糖含量為99.63%,其蛋白質(zhì)含量大幅度降低,含量為0.2%,與紅外吸收光譜和紫外吸收光譜結(jié)果相類似。通過(guò)此工藝提取的木葡聚糖純度較高,為木葡聚糖的提取工藝提供了新思路,也對(duì)其在生物醫(yī)藥、醫(yī)用材料、食品、造紙、紡織等領(lǐng)域的應(yīng)用作出貢獻(xiàn)。

