氯化鎂熔鹽水合物的電化學性質研究
董明哲,李可昕,4,葉秀深,馬 珍,李生廷,李 權,吳志堅
(1.中國科學院青海鹽湖研究所,中國科學院鹽湖資源綜合高效利用重點實驗室,青海西寧 810008;2.青海省鹽湖資源化學重點實驗室,青海西寧 810008;3.青海鹽湖工業股份有限公司,青海格爾木 816000;4.中國科學院大學,北京 100049)
熔鹽水合物一般是指水鹽物質的量比小于或等于陽離子水合數或配位數的無機鹽熔體,其狀態介于稀水溶液和無水熔鹽之間[1]。理想熔鹽水合物定義為只有離子-水直接接觸、沒有離子-離子直接接觸、沒有水分子之間線性接觸的熔體。就結構而言,這意味著水合作用較強的陽離子僅被一層水合層屏蔽,不與陰離子直接接觸。熔鹽水合物中水鹽物質的量比值R等于陽離子水合數或配位數,對于理想MgCl2·6H2O熔鹽水合物,R值為6[2]。
國內外對稀水溶液和熔鹽體系的研究相對較多,而對熔鹽水合物的研究較少。目前,國內外對無機熔鹽水合物的研究報道主要是將熔鹽水合物用作相變儲能材料[3-4],研究其熱力學和相轉變性質[5],或者將熔鹽水合物作為化學反應介質,用于纖維素降解[6]、菊粉生物質降解[7]、TiO2制備[8]等。對于無機熔鹽水合物電化學性質的研究主要涉及其在鋰離子電池中的應用,研究其作為鋰離子電池電解液的可能性及電化學性質,同時對其組成和結構等也進行了一些考察[9]。
由于無機鹽在水中溶解度受限,能形成熔鹽水合物的無機鹽種類有限。其中,MgCl2·6H2O因其可用作熱化學相變儲能材料[3,10],也可脫水制備無水氯化鎂而受到了持續關注[11]。在對MgCl2·6H2O 進行熱處理脫水的過程中,前面4個結晶水容易脫除;由于在氯化鎂熔鹽水合物中存在水分子和氯離子與鎂離子的絡合競爭反應,后面2 個結晶水脫除困難[12],需要在氯氣或氯化氫氣氛下進行熱處理,才能得到無水氯化鎂[13],否則會生成Mg(OH)Cl 和MgO[14-18]。因此,調控鎂離子的化學環境,使得鎂離子更傾向于與氯離子絡合,有助于控制MgCl2·6H2O脫水得到無水氯化鎂[19]。基于此,本文通過循環伏安實驗對氯化鎂熔鹽水合物的電化學性質進行了綜合研究,深入了解熔鹽水合物中水分子的存在狀態與電化學反應、氯離子和水分子與鎂離子的絡合競爭反應等,以期對氯化鎂脫水過程有深入的認識,從而對控制MgCl2·6H2O 脫水得到無水氯化鎂的過程有所幫助。
1 實驗部分
1.1 實驗試劑及儀器
試劑:六水合氯化鎂(MgCl2·6H2O),分析純,將一定量的MgCl2·6H2O 定容至500 mL 后,再通過電感耦合等離子體發射光譜儀(ICP-OES)測試Mg2+、Cl-濃度后計算得到n(Mg2+)∶n(Cl-)∶n(H2O);氯化鉀(KCl),分析純;去離子水,實驗室自制。
儀器:Sevenexcellence 型電導率儀、IKA 5 digital型磁力攪拌器、DHG-40A型鼓風干燥箱、CR-020型超聲波清洗機、ME204E 型電子天平、DH7006 型電化學工作站、AvioTM 200 型電感耦合等離子體發射光譜儀、STA449F3型同步熱分析儀。
1.2 不同組成的MgCl2-H2O 體系以液態存在的最低溫度
按照n(MgCl2)∶n(H2O)分別為1∶20、1∶15、1∶10、1∶9、1∶8、1∶7、1∶6.5、1∶6配制MgCl2-H2O混合體系,將混合體系在磁力攪拌、油浴加熱下以0.1 ℃/min的速率升溫,直至固體全部熔融。記錄從濃溶液至熔鹽轉變過程中保持熔融時的最低溫度。
1.3 電導率測量
將電導率儀測試探頭置于不同水鹽物質的量比的熔鹽水合物中,測試穩定狀態下的電導率。
1.4 循環伏安實驗
采用三電極體系對熔鹽水合物的電化學性質進行表征,并對不同組成的熔鹽水合物進行循環伏安測試。其中,工作電極為φ1 mm×1 cm 鉑絲電極,對電極為2 cm×2 cm×0.2 cm 鉑片電極,參比電極為φ1 mm×1 cm 銀絲電極,實驗使用50 mL 電解池,電極間距為17 mm。實驗前,所有電極需使用5 000目SiC 砂紙打磨光滑后,再使用無水乙醇對其超聲5 min除油,然后使用去離子水超聲5 min洗去乙醇,最后在60 ℃下干燥20 min。電極體系在水合熔鹽中穩定1 h后測試,循環掃描伏安曲線測試的電位掃描順序從2 V 開始負向掃描至-2 V,再正向掃描回到2 V,掃描速率為50 mV/s。MgCl2濃溶液測試溫度為25 ℃,MgCl2熔鹽水合物測試溫度為120 ℃,MgCl2·6H2O+KCl熔鹽中KCl質量分數為0.5%或1%。
1.5 熱重測試
分別向MgCl2·6H2O 中添加質量分數為9.1%、16.7%、23.1%、28.6%的KCl,經過研磨使其混合均勻,然后在氮氣氣氛中以10 ℃/min的升溫速率升至設定溫度并記錄數據。
2 結果與討論
2.1 不同組成的MgCl2-H2O 體系以液態存在的最低溫度
以25 ℃為室溫基準溫度,測試了不同組成的MgCl2-H2O體系以液態存在的最低溫度,結果如圖1所示。由圖1 可知,MgCl2-H2O 體系熔融的最低溫度隨著MgCl2含量的增加而逐漸升高。當n(MgCl2)∶n(H2O)為1∶20 時,MgCl2-H2O 體系以溶液形式存在;當n(MgCl2)∶n(H2O)為1∶6 時,MgCl2-H2O 體系呈液態的最低溫度為116 ℃,此時體系呈熔鹽水合物狀態。以圖1 測得的溫度為參考,研究氯化鎂濃溶液和熔鹽水合物的電化學性能。
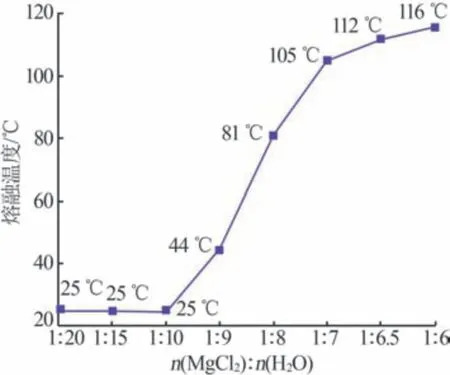
圖1 不同組成的MgCl2-H2O體系以液態存在的最低溫度Fig.1 Lowest temperature of MgCl2-H2O system with different compositions in liquid state
2.2 不同組成的MgCl2-H2O 體系在不同溫度下的電導率
不同組成的MgCl2-H2O體系在不同溫度下的電導率如圖2所示。由圖2可知,在n(MgCl2)∶n(H2O)=(1∶20)~(1∶9)時,溶液濃度相對于熔鹽水合物濃度較低,在此濃度范圍內,相同溫度下電導率隨著含水量的降低先增大后逐漸減小;在含水量相同的情況下,電導率隨著溫度的升高逐漸增大。在n(MgCl2)∶n(H2O)=(1∶8)~(1∶6)時,溶液逐漸向熔鹽水合物過渡,在此濃度范圍內,相同溫度下電導率隨著含水量的降低逐漸減小;在含水量相同的情況下,電導率仍隨著溫度的升高逐漸增大。無機鹽的水溶液通過溶液中解離的陰離子和陽離子導電。在電場作用下,陰離子向逆電場的方向移動,陽離子沿著電場的方向移動。無機鹽水溶液中的陰、陽離子都與水分子發生水合作用。一般來說,陽離子的水合作用強于陰離子。在MgCl2水溶液中,Mg2+的水合作用很強,與水分子形成共價鍵,并以[Mg(H2O)6]2+的形式存在;而Cl-的水合作用很弱,不能與水分子形成共價鍵,只能發生一般的水合作用,通常認為Cl-的水合數為1[20],水合離子之間存在靜電作用。離子在電場作用下的定向移動受其周圍水分子和其他離子影響。在稀溶液中,與離子發生水合的水分子在所有水分子中所占比例較小,某一離子與其他離子之間的距離較遠,離子之間的靜電作用較弱,溶液的黏度較小,離子在電場作用下遷移,受到的阻力相對較小;隨著鹽溶液濃度的增加,導電的陰、陽離子數量增加,電導率也逐漸增大。在濃溶液中,與離子發生水合的水分子在所有水分子中所占比例較高,某一離子與其他離子之間的距離較近,離子之間的靜電作用較強,溶液的黏度較大,離子在電場作用下遷移,受到的阻力相對較大;當溶液濃度增加到一定程度時,繼續增加溶液濃度,陰、陽離子在電場作用下的定向移動受到的阻力增大,溶液的電導率減小。在無機鹽溶液濃度相同的情況下,升高溫度會加快離子和水分子的熱運動速率,有利于離子的移動,因此隨著溶液溫度的升高,溶液的電導率逐漸增大。
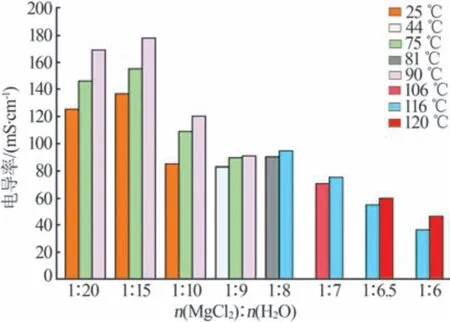
圖2 不同組成的MgCl2-H2O體系在不同溫度下的電導率Fig.2 Electrical conductivity of MgCl2-H2O system with different compositions at different temperatures
2.3 循環伏安實驗結果
120 ℃下含水量不同的MgCl2溶液及熔鹽水合物在相同測試條件下的循環伏安曲線如圖3 所示。由圖3a 可知,在MgCl2稀溶液中,當電位由2 V 掃描至0.94 V 時,陽極電流逐漸減小;當電位為-0.6~0.94 V時,無電化學反應發生,熔鹽體系處于穩定狀態;當電位由-0.6 V掃描至-2 V時,陰極電流逐漸增大,出現一個還原峰(峰值電流見表1)。由于H+在水溶液和水合熔鹽中的還原電位高于Mg2+的還原電位,因此該還原峰為熔鹽中H+的還原峰。當正向掃描至0.94 V 時,出現一個氧化峰,對應于Cl-的氧化,所涉及的電極反應為:2Cl--2e→Cl2(陽極)、2H++2e→H2(陰極)。由于電極上氣體產物的逸出,電極反應為完全不可逆反應。在MgCl2稀溶液中,當n(MgCl2)∶n(H2O)=1∶20 時,其與n(MgCl2)∶n(H2O)=1∶15 具有相似的陰極和陽極電流,當n(MgCl2)∶n(H2O)≥1∶9 時,電導率減小,且陽極和陰極電流均明顯減小(見表1)。由圖3b 可知,當n(MgCl2)∶n(H2O)由1∶9逐漸增大到1∶6時,體系逐漸由濃溶液向水合熔鹽過渡;當電位由2 V 掃描至0.94 V時,陽極電流逐漸減小;當電位為-0.17~0.94 V時,無電化學反應發生,熔鹽體系處于穩定狀態;當電位由-0.17 V 掃描至-1 V 時,陰極電流逐漸增大,出現第一個還原峰,記為陰極峰值電流1;當電位由-1 V 掃描至-2 V 時,陰極電流逐漸增大,出現第二個還原峰,記為陰極峰值電流2,這是因為隨著電壓的負向移動,水合離子運動速率加快,電極反應速率增大,因此出現第二個還原峰。在相同溫度下,隨著MgCl2熔鹽體系水分含量的降低,體系黏度逐漸增大,電導率逐漸降低,陰極氫的還原更加困難,同時陽極氯的氧化也更加困難。
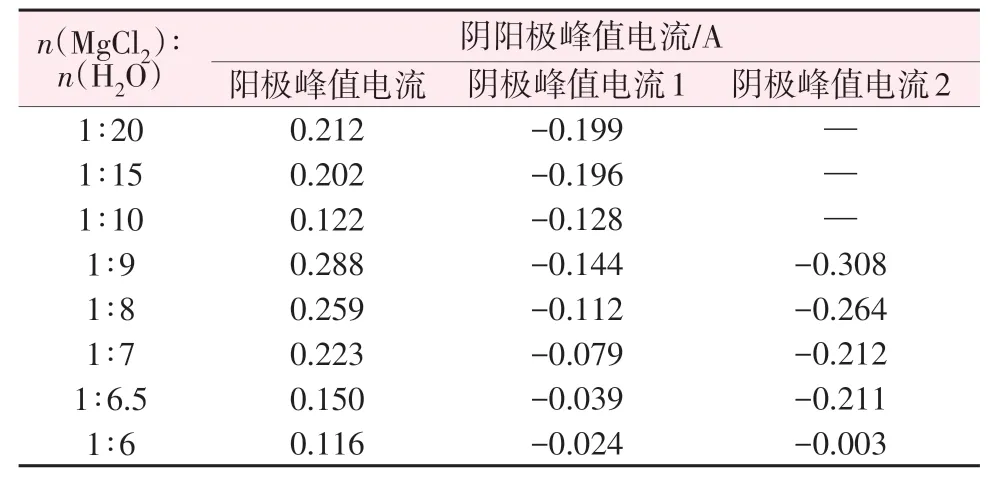
表1 MgCl2溶液及熔鹽水合物的循環伏安曲線峰值電流Table 1 Cyclic voltammetric peak currents of MgCl2 solutions and molten salt hydrates
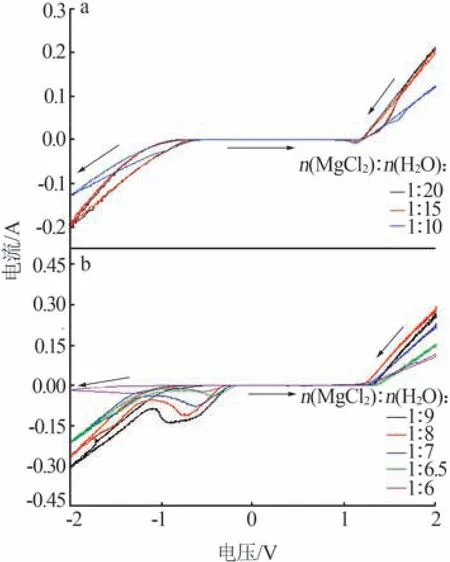
圖3 MgCl2溶液(a)及熔鹽水合物120 ℃下(b)的循環伏安曲線(vs.Ag參比電極)Fig.3 Cyclic voltammetry curves of MgCl2 solutions(a) and molten salt hydrates(b) at 120 ℃(vs.Ag reference electrode)
1 個H2O 與1 個Li+的平均結合能為1.0 eV,1 個H2O與另1個H2O之間的平均結合能為0.27 eV。因此,H2O 更傾向于與Li+結合形成水合鋰離子,而不是水分子之間形成氫鍵。當n(Li+)∶n(H2O)為(1∶4)~(1∶2)時,所有的H2O都與Li+結合,沒有可以形成氫鍵的水分子。水分子被束縛在鋰離子周圍形成水合鋰離子后,水分子的電化學惰性增強[9]。Li+和Mg2+的裸離子半徑分別為0.068 nm 和0.065 nm,由于Mg2+的裸離子半徑較小,所帶電荷較高,因此Mg2+的水合作用強于Li+。實際上,Mg2+與水分子形成的是[Mg(H2O)6]2+,Mg2+與水分子中氧原子之間存在共價鍵作用[21]。由此可以推測,對于MgCl2水溶液及其熔鹽水合物,當n(MgCl2)∶n(H2O)由1∶9逐漸增大到1∶6 時,非絡合及非水合的水分子數(自由水分子數)逐漸減少,在n(MgCl2)∶n(H2O)為1∶6 的熔鹽水合物中,所有的水分子都與Mg2+絡合,沒有非絡合的可形成氫鍵的水分子。與LiNO3熔鹽水合物的情況類似,在MgCl2熔鹽水合物中,水分子被束縛在Mg2+周圍形成絡離子后,水分子的電化學惰性增強,使陰極氫的還原更加困難。
在120 ℃下向MgCl2熔鹽水合物中加入KCl后的循環伏安曲線如圖4 所示。由圖4 可知,向n(MgCl2)∶n(H2O)為1∶6的MgCl2熔鹽水合物中加入質量分數為0.5%的KCl后,起始還原電位由-0.248 V提高至-0.050 V,還原峰電流由0.024 A 增加至0.044 A,氫的還原和氫氣的生成更加容易。同時,Cl-初始氧化電位由1.20 V 提高至1.35 V。向n(MgCl2)∶n(H2O)為1∶6的MgCl2熔鹽水合物中加入質量分數為1.0%的KCl后,其循環伏安曲線與加入質量分數為0.5%的KCl的MgCl2熔鹽水合物具有相似的趨勢與初始氧化還原電位。加入KCl 后,由于熔鹽水合物體系中Cl-濃度增大,部分置換了與Mg2+絡合的水分子[1]{[Mg(H2O)6-nCln]2-n+mCl-?[Mg(H2O)6-m-nClm+n]2-m-n+mH2O},被置換的水分子脫離鎂離子絡合,因此反應活性增強,使氫的還原和氫氣的生成更容易。在熔鹽水合物體系中,由于Cl-與H2O 的絡合作用,增加了Cl-氧化難度,因此提高了初始氧化電壓。
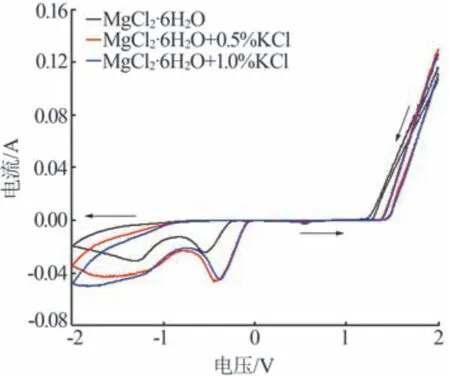
圖4 120 ℃下不同KCl含量的MgCl2熔鹽水合物循環伏安曲線(vs.Ag參比電極)Fig.4 Cyclic voltammetry curves of MgCl2·6H2O MSHs with different KCl contents at 120 ℃(vs.Ag reference electrode)
在MgCl2·6H2O 和鉀光鹵石、銨光鹵石等含鎂復鹽脫水過程的對比研究中發現,復鹽脫水比MgCl2·6H2O脫水更容易,并且復鹽中的鎂離子在脫水過程中更不容易水解[11,22],這可能是由于在含鎂復鹽脫水過程中Cl-置換了與鎂離子絡合的水分子,抑制了鎂離子的水解。結合圖4 的電化學分析可知,Cl-在MgCl2·6H2O熔鹽中可置換Mg(H2O)62+中的H2O,同時結合MgCl2·6H2O和含鎂復鹽的脫水情況,推測Cl-可促進MgCl2·6H2O 的加熱脫水反應。基于此,在MgCl2·6H2O 中添加不同量的KCl 后,通過熱重實驗分析KCl 對MgCl2·6H2O 的影響進而判斷Cl-對其脫水的影響。在MgCl2·6H2O 中分別添加質量分數為9.1%、16.7%、23.1%、28.6%的KCl后,其熱重曲線(TG)與熱重微分曲線(DTG)如圖5所示。由圖5a 可知,隨著KCl 添加量的增加,25~200 ℃下失重速率逐漸增大。由圖5b可知,隨著KCl 添加量的增加,第一失重峰由108 ℃逐漸降低至98 ℃,第二失重峰由180 ℃逐漸降低至148 ℃。該結果進一步表明,在MgCl2·6H2O 脫水過程中氯離子改變了鎂離子的化學環境,使與鎂離子絡合的水分子更多地被氯離子置換,抑制了水解反應,更有利于MgCl2·6H2O 的脫水完全[23]。
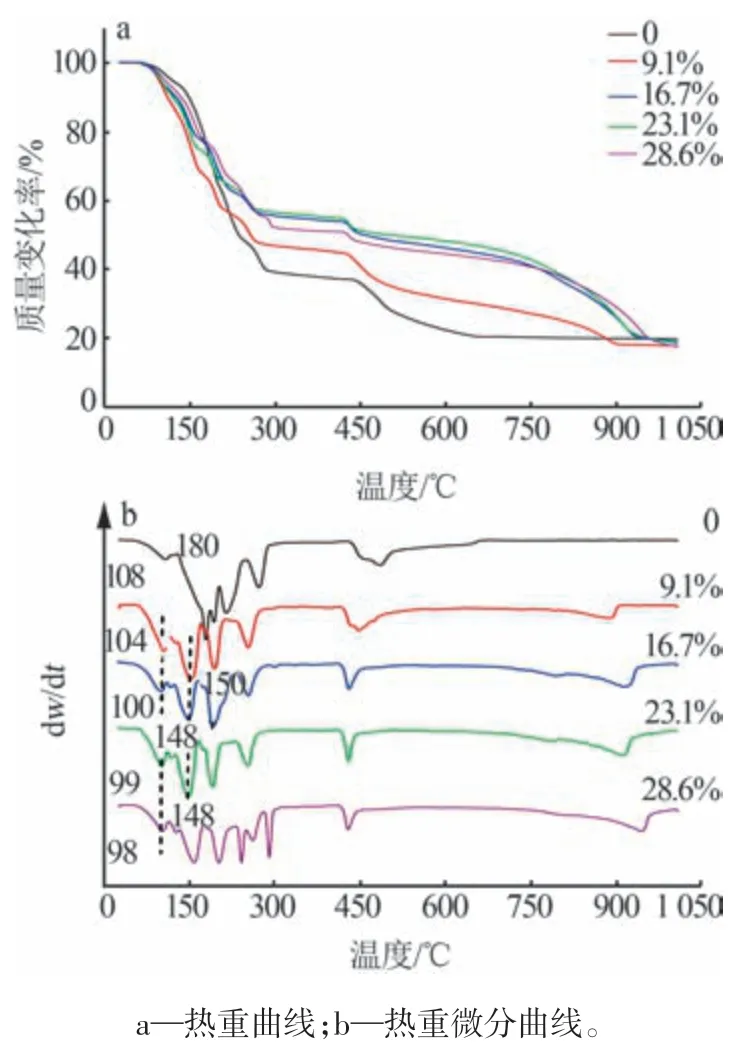
圖5 KCl添加量對MgCl2·6H2O失水溫度的影響Fig.5 Effect of KCl addition on water loss temperature of MgCl2·6H2O
3 結論
1)隨著n(MgCl2)∶n(H2O)逐漸增大,MgCl2-H2O體系以液態存在的最低溫度逐漸升高。當n(MgCl2)∶n(H2O)為1∶20時,MgCl2-H2O體系在室溫(25 ℃)下以溶液形式存在;當n(MgCl2)∶n(H2O)為1∶6 時,MgCl2-H2O 體系呈液態的最低溫度為116 ℃,此時該體系呈熔鹽水合物狀態。
2)在MgCl2稀溶液中,相同溫度下隨著MgCl2-H2O體系含水量的降低,電導率先增大后逐漸減小;在含水量相同的情況下,電導率隨著溫度的升高逐漸增大。在濃溶液和熔鹽水合物中,相同溫度下電導率隨著含水量的降低逐漸減小;在含水量相同的情況下,電導率仍隨著溫度的升高逐漸增大。在MgCl2稀溶液中,隨著MgCl2溶液濃度的增大,電導率也隨之增大;在MgCl2濃溶液和熔鹽水合物中,離子之間距離較近,離子之間的靜電作用較強,因此當MgCl2溶液濃度增大到一定程度時,繼續增加溶液濃度,陰、陽離子在電場作用下的定向移動受到的阻力逐漸增大,導致溶液的電導率逐漸減小。因此,在含水量相同的情況下,隨著溫度的升高,MgCl2-H2O體系的電導率逐漸增大。
3)對于MgCl2-H2O 體系,當達到氧化或還原電位時,隨著含水量的增加,陽極和陰極電流都明顯增大。在MgCl2熔鹽水合物中加入KCl 后,體系中Cl-濃度增大,置換了水合鎂離子中的部分水分子,使氫的還原更容易發生。因此,在MgCl2·6H2O脫水過程中,Cl-的加入可抑制鎂離子的水解反應,更有利于MgCl2·6H2O的脫水過程。

