不同化療方案治療晚期尿路上皮癌的效果及對免疫功能的影響
謝騏同
(惠州市中心人民醫院泌尿外科,廣東 惠州 516001)
尿路上皮癌是指發生于尿路上皮發生的癌癥,即發生在腎盞、腎盂、膀胱、輸尿管等上皮部位的癌癥,此類惡性腫瘤早期發病時并無特異性癥狀,一經確診多為中晚期。晚期尿路上皮癌的治療原則為盡可能延長患者生存期,提高患者生活質量[1]。臨床上該病的主要治療手段為全身化療,多采用甲氨蝶呤+順鉑+表阿霉素+長春新堿(MVAC)方案,其療效顯著,可有效抑制患者惡性腫瘤進展。但該方案涉及的藥物毒副作用較大,且該病以老年患者居多,耐受性差,易中斷化療進程,影響治療效果[2]。有研究指出,吉西他濱+順鉑(GC)方案的毒副反應發生率較低,但其對于尿路上皮癌的療效如何,仍需進一步研究[3]。基于此,本研究團隊進行探討不同化療方案治療晚期尿路上皮癌的效果及對其免疫功能的影響。
1 資料與方法
1.1一般資料:選取惠州市中心人民醫院2019年1月~2021年1月收治的103例晚期尿路上皮癌患者,按照隨機數字表法分為兩組,MVAC組51例,男34例,女17例;年齡50~80歲,平均(65.47±5.66)歲;病程2~30 d,平均(14.63±2.52)d;癌癥類型:輸尿管癌4例,腎盂癌5例,膀胱癌40例,其他2例;卡氏評分(KPS)60~90分,平均(76.12±4.57)分。GC組52例,男36例,女16例;年齡50~80歲,平均(66.21±5.98)歲;病程2~30 d,平均(14.57±2.77)d;癌癥類型:輸尿管癌6例,腎盂癌4例,膀胱癌39例,其他3例;KPS評分60~90分,平均(75.84±4.30)分。兩組患者基線資料比較,差異無統計學意義(P>0.05),有可雙性。本研究已取得我院倫理委員會批準。納入標準:①符合晚期尿路上皮癌[4]診斷標準;②可耐受化療,且均為初次化療;③KPS評分為60~90分;④能配合治療,正確表達自身不適癥狀。排除標準:①對本研究所用藥物過敏者;②合并腦、心、肺、肝等其他器官功能障礙者;③合并血液系統、免疫系統疾病等或其他部位惡性腫瘤患者。剔除標準:預計生存質量<3個月。脫落標準:中途退出本研究者。
1.2方法:MVAC組予以MVAC方案化療,具體內容如下:第1、15、22天予以靜脈滴注30 mg/m2的甲氨蝶呤[批準文號:H20140206,生產批號:FM6541,Pfizer(Perth) Pty Limited,規格50 mg/2 ml];第1~3天予以靜脈滴注25 mg/m2的順鉑(國藥準字H20043889,云南生物谷藥業,規格10 mg/2 ml);第2、15、22天予以靜脈滴注1.4 mg/m2的長春新堿(國藥準字H20058597,陜西博森生物制藥,規格1 mg);第2天予以靜脈滴注30 mg/m2的表阿霉素(鹽酸表柔比星,國藥準字H20183145,規格10 mg)。28 d為1個治療周期。GC組予以GC方案化療,具體內容如下:第1、8天予以靜脈滴注1 g/m2的吉西他濱(國藥準字H20093403,南京正大天晴制藥,規格1 g),0.5~1 h滴注完成;第1~3天予以靜脈滴注25 mg/m2的順鉑。21 d為1個治療周期。兩組均治療4個周期。
1.3觀察指標和評價標準:觀察兩組患者臨床療效、腫瘤標志物、免疫功能、生存質量以及毒副反應。①臨床療效[5]:根據世界衛生組織(WHO)推薦的實體腫瘤療效可將其分為疾病進展(PD)、疾病穩定(SD)、部分緩解(PR)、完全緩解(CR),其中疾病控制率(DCR)=(SD例數+PR例數+CR例數)/總例數×100%,客觀緩解率(ORR)=(PR例數+CR例數)/總例數×100%。②腫瘤標志物:治療前及治療4個周期后,抽取患者肘部靜脈血3 ml,檢測兩組組織多肽抗原(TPA)、鱗狀細胞癌抗原(SCC-Ag)、β2-微球蛋白(β2-MG)、細胞角蛋白19片段(CYFRA21-1)水平,檢測方法為酶聯免疫吸附法。③免疫功能:治療前及治療4個周期后,抽取患者肘部靜脈血3 ml,采用流式細胞儀(賽默飛世爾科技,型號:Attune NxT)檢測兩組NK細胞、CD3+細胞、CD4+細胞、CD8+細胞水平。④生存質量:治療前及治療4個周期后,采用癌癥患者生存質量量表(QLQ-C30)[6],該量表分值范圍為0~100分,分值越高,生活質量越好。⑤毒副反應:治療期間,觀察兩組惡心嘔吐、貧血、白細胞減少、發熱、粒細胞減少、肝腎功能異常的發生情況。
1.4統計學方法:數據錄入SPSS22.0軟件中分析,采用χ2及t檢驗,若不符合采用四分位數法表示,采用非參數檢驗。
2 結果
2.1兩組臨床療效比較:GC組DCR、ORR與MVAC組比較,差異無統計學意義(P>0.05)。見表1。

表1 兩組臨床療效比較[n(%)]
2.2兩組腫瘤標志物比較:治療前,兩組TPA、SCC-Ag、β2-MG、CYFRA21-1水平比較,差異無統計學意義(P>0.05),治療4個周期后,兩組TPA、SCC-Ag、β2-MG、CYFRA21-1水平均降低,差異有統計學意義(P<0.05),但組間比較,差異無統計學意義(P>0.05)。見表2。
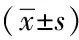
表2 兩組腫瘤標志物比較
2.3兩組免疫功能比較:治療前,兩組NK細胞、CD3+、CD4+、CD8+水平比較,差異無統計學意義(P>0.05),治療4個周期后,兩組NK細胞、CD3+、CD4+、CD8+水平均降低,差異有統計學意義(P<0.05),但GC組高于MVAC組,差異有統計學意義(P<0.05)。見表3。

表3 兩組免疫功能比較
2.4兩組生存質量比較:治療前,GC組QLQ-C30評分(63.26±8.64)分與MVAC組(61.98±7.86)分比較,差異無統計學意義(t=0.787,P=0.433),治療4個周期后,兩組QLQ-C30評分均降低,但GC組(58.63±6.32)分高于MVAC組(52.32±7.19)分,差異有統計學意義(t=4.727,P<0.001)。
2.5兩組毒副反應比較:GC組各毒副反應發生率均低于MVAC組,差異有統計學意義(P<0.05)。見表4。

表4 兩組毒副反應比較[n(%)]
3 討論
晚期尿路上皮癌常表現消瘦、乏力、血尿、排尿困難等癥狀,嚴重影響患者的生命安全和日常生活[7]。MVAC化療方案是晚期尿路上皮癌患者治療的傳統標準化方案,可明顯降低患者死亡風險。但由于晚期尿路上皮癌患者多發于老年人,具有年齡大、耐受能力差、免疫功能下降的劣勢,而MVAC化療方案引起的毒副反應又多又劇烈,故嚴重限制其在臨床上的應用[8]。GC化療方案中吉西他濱不僅可阻斷腫瘤細胞中DNA合成,還可抑制被其他細胞周期抗腫瘤藥物影響的DNA再次合成;順鉑可通過破壞腫瘤細胞中DNA鏈條合成干擾DNA復制、轉錄過程而影響腫瘤細胞增殖,兩種藥物可起協同作用,且不良反應發生率較低[9],可能更適用于晚期尿路上皮癌患者。腫瘤標志物是指特征性存在于惡性腫瘤細胞異常轉化過程中的物質,可反映腫瘤發生、發展的進程,對評估患者療效、預后、生存期具有重要的意義。TPA是多存在于惡性腫瘤細胞質和細胞膜中,可在膀胱癌、腎盂癌等惡性腫瘤中成高表達水平;SCC-Ag廣泛存在于鱗狀上皮細胞癌的細胞漿中,可作為子宮頸癌、肺癌、腎癌、膀胱癌的輔助診斷和預后監測指標,其血清中濃度可隨惡性腫瘤病情發展、加重而增高,若治療有效,則降低;若再度升高,則提示復發或轉移;β2-MG屬于人體白細胞抗原小分子蛋白,在膀胱癌、輸尿管癌患者血液和尿液中其水平明顯升高,且與腫瘤疾病發展有關;CYFRA21-1是細胞角蛋白19的可溶性片段,且可由上皮性腫瘤細胞降解釋放,在腎相關腫瘤、膀胱癌等中高度表達[10-11]。吉西他濱屬于特異性細胞周期抗代謝類抗腫瘤藥物,可通過殺傷處于DNA復制過程S期的細胞或阻斷細胞GI期進展為S期的過程而抑制腫瘤細胞DNA合成,干擾細胞周期,進而達到抑制腫瘤細胞增殖的目的;順鉑為細胞周期非特異性抗癌藥物,可干擾DNA鏈間及鏈內交鏈,生成DDP~DNA復合物,破壞DNA結構和功能,干擾DNA復制,從而起到抗腫瘤的作用。本研究說明兩種化療方案治療晚期尿路上皮癌均可降低腫瘤標志物水平,臨床療效相當。
化療期間,各化療藥物在發揮抑制腫瘤細胞增殖的作用時,也會對機體的免疫功能造成不同程度的損傷,而免疫功能降低會使患者化療方案中止,影響治療效果。因此,在化療期間需選擇合適的化療方案,不僅需殺傷癌細胞,還需最大程度減少對免疫系統的影響[12]。本研究說明GC方案化療治療晚期尿路上皮癌有助于保護機體免疫功能,提高患者生活質量。可能的原因是GC方案可可通過逆轉晚期尿路上皮癌患者Th1/Th2偏移狀態,干預T淋巴細胞介導的免疫應答過程,而達到保護機體免疫功能,增強免疫力的目的,從而使患者以更強的身體狀態面對化療,提升生存質量。王麗麗等[13]研究中指出,GC化療方案組的免疫功能指標水平明顯優于MVAC組,可起到保護機體免疫功能,提高治療耐受性的作用。
本研究說明GC方案化療治療晚期尿路上皮癌有助于減少毒副反應發生。可能的原因是GC方案中吉西他濱與順鉑均為高活性細胞周期抗腫瘤藥物,但藥理機制不同,并不疊加毒副反應[14],也可能與GC方案中使用的化療藥物種類較少有關。張新軍[15]通過對62例患者進行隨機對照試驗發現,GC新輔助化療方案可明顯改善晚期局部膀胱癌患者預后情況,延長生存期,且具有較高的安全性。
綜上所述,兩種化療方案治療晚期尿路上皮癌均可降低腫瘤標志物水平,臨床療效相當,但GC化療方案有助于保護機體免疫功能,減少患者毒副反應發生,提高患者生活質量。

