免疫指標及肝病相關抗體與自身免疫性肝病相關性
曾麗梅,馮陽修,謝銀光,梁建尤,高志芳,劉金蓮,邵金揚,范秀冰
(肇慶市廣寧縣中醫院,廣東 肇慶 526300)
自身免疫性肝病(AILD)是一種表現為肝功、膽功損傷的發病機制與自身免疫密切相關的疾病,根據病理類型可分為自身免疫性肝炎(AIH)、原發性膽汁性肝硬化(PBC)及原發性硬化性膽管炎(PSC),其中AIH及PBC發病率相對較高,是全球范圍內醫學界學者研究的重點[1]。AILD具有早期癥狀不典型、病情較重等特點,早期診斷AILD并鑒別分型對指導治療方案、提高預后等具有重要意義。目前研究表明,AILD機體存在免疫耐受平穩紊亂等情況,可表現自身抗體陽性及免疫球蛋白(Ig)異常表達等,同時體內補體活化也可能參與AILD的發生及發展過程[2-3]。AILD是肝衰竭的重要誘因之一,可出現肝功異常情況,長期可表現肝纖維化、肝衰竭等,檢測肝功相關指標可輔助評估AILD患者病情變化[4]。本研究選擇AILD患者50例為觀察對象,旨在基于免疫指標及肝病相關抗體探討其與AILD的相關性。
1 資料與方法
1.1一般資料:選取2021年5月~2022年10月就診于我院的AILD患者50例為研究組,納入標準:①AIH患者均符合美國肝病學會(AASLD)發表的AIH診療指南相關診斷標準;②PBC患者符合AASLD制定相關診斷標準;③患者及家屬知情,依從性良好,可配合檢查及治療,簽署知情同意書。排除標準:①合并胰蛋白酶缺乏癥、遺傳性血色病等遺傳代謝性疾病;②合并重要器官嚴重功能障礙;③合并其他自身免疫性疾病;④酒精性或中毒性肝病;⑤合并乙肝、丙肝等肝病。根據病理分為AIH組17例、PBC組33例,同期選擇50例健康體檢者為對照組。研究組患者男22例,女28例;年齡41~79歲,平均(52.64±4.32)歲。對照組男20例,女30例;年齡38~75歲,平均(51.81±4.60)歲。兩組性別、年齡等基線資料比較差異無統計學意義(P>0.05),有可比性。本研究經本醫院倫理會批準同意。
1.2方法:采集受檢者空腹靜脈血,3 000 r/min離心10 min分離上清,于-80℃冰箱中冷凍保存,生化分析儀檢測3組受檢者血清中總膽紅素(TBIL)、谷氨酸轉移酶(ALT)、天冬氨酸轉氨酶(AST)水平,采用透射比濁法檢測血清補體C3、血清補體C4、IgA、IgG及IgM水平。間接免疫熒光法檢測3組受檢者血清中抗線粒體抗體(AMA)、抗核抗體(ANA)、抗平滑肌抗體(ASMA),以抗體滴度>1∶100為陽性,采用免疫印跡法檢測受檢者血清中抗線粒體抗體M2亞型(AMA-M2)、抗可溶性肝抗原/肝胰抗原(SLA/LP)、抗肝細胞漿抗體(LC-1)、抗肝腎微粒體抗體(LKM)表達情況。
1.3觀察指標:分析比較3組受檢者生化指標(ALT、AST、TBIL)、免疫學指標(補體C3、血清補體C4、IgA、IgG及IgM)水平及自身抗體(ANA、ASMA、AMA、LC-1、SLA/LP、LKM、AMA-M2)陽性情況,分析AIH、PBC患者生化指標、免疫學指標、自身抗體差異。
1.4統計學方法:采用SPSS20.0軟件對本研究數據進行分析。采用t及χ2檢驗。
2 結果
2.1三組受檢者自身抗體檢測結果比較:AIH組ASMA、SLA/AP、LKM、ANA、AMA陽性比例明顯高于對照組,ASMA、SLA/AP、LKM陽性比例明顯高于PBC組;PBC組ASMA、AMA、SLA/AP、AMA-M2陽性比例明顯高于對照組,AMA、AMA-M2陽性比例明顯高于AIH組,差異均有統計學意義(P<0.05)。見表1。

表1 三組受檢者自身抗體檢測結果比較[n(%)]
2.2三組受檢者ALT、AST、TBIL水平比較:AIH組、PBC組ALT、AST、TBIL水平明顯高于對照組,AIH組患者ALT水平明顯高于PBC組,PBC組患者TBIL水平明顯高于AIH組,差異均有統計學意義(P<0.05)。見表2。
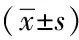
表2 三組受檢者ALT、AST、TBIL水平比較
2.3三組受檢者免疫指標比較:相較于對照組,AIH組、PBC組的C3、C4水平出現大幅度降低,IgG、IgG4、IgM水平出現大幅度升高;AIH組IgA水平明顯高于對照組及PBC組,C4水平明顯低于PBC組,IgG、IgG4水平明顯高于PBC組,差異均有統計學意義(P<0.05)。見表3。
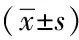
表3 三組受檢者免疫及補體情況比較
3 討論
AILD病理可表現肝細胞或膽管上皮細胞損傷,目前發病機制尚不明確,但部分研究認為AILD的發生與機體免疫功能紊亂密切相關,其中AIH及PBC發病率相對較高,病理顯示AIH主要表現為界面性肝炎,匯管區和肝實質內多有漿細胞的浸潤情況;而PBC多見肝內膽漏或小膽管及細膽管狹窄,若不給予及時處理可能出現肝功損傷及腹膜炎,嚴重出現傳染中毒性休克,兩者臨床表現不典型,臨床確診均需創傷性肝臟穿刺,無法普及作為常見手段[5],因此尋找其他診斷AILD及判斷分型的方法具有重要意義。
目前研究表明,AIH、PBC雖均屬于AILD,但兩者發病機制、病理表現及免疫變化均不相同[6-7]。AILD作為一種免疫性疾病,可能在機體遭受病毒感染后誘導自身抗原修飾導致自身免疫激發紊亂而發病,分析機體自身抗體變化可能有助于診斷及鑒別AILD。ANA、LKM是臨床研究常見的自身抗體,多見于各種自身免疫性疾病。ANA的陽性多提示肝硬化風險大,預后更差。ASMA的表達與肝細胞質膜存在密切聯系,其與ANA相同,ASMA陽性表達多見于Ⅰ型AIH;LKM是Ⅱ型AIH的標志抗體;SLA/LP特異性高,檢出率低,僅見于AIH,為Ⅲ型AIH的標志抗體,在鑒別AILD具有重要意義[8]。AMA的陽性表達多見于PBC,且具有較高的敏感性和特異性,同時AMA-M2或AMA-M4抗體滴度升高可預示PBC可能處于進展階段[9]。本研究說明AILD機體存在自身免疫紊亂情況,同時AIH患者多見于ASMA、SLA/AP、LKM陽性表達,PBC患者主要以AMA、AMA-M2陽性表達為主。提示AILD患者可通過檢測自身抗體陽性情況鑒別分型,與張春來等[10]研究結果相近,張春來等研究認為抗核抗體等相關自身抗體檢測有助于抗體表達陰性患者PBC的診斷。
AILD主要表現肝區不適、肝功異常等癥狀,肝功生化多異常表現,監測生化指標有助于鑒別診斷。本研究中AIH組患者ALT水平明顯高于PBC組,PBC組患者TBIL水平明顯高于AIH組。說明AIH病變部位多以肝細胞為主,慢性發展可導致肝硬化,因此表現ALT水平異常表達,PBC以肝內淤膽為主要特征,TBIL明顯升高,早期監測生化指標變化有助于指導治療方案。目前研究認為,漿細胞也參與AILD的發生及發展過程,AIH多以肝細胞損傷為主,而IgG可反映肝內炎性反應水平,因此IgG水平與AIH存在密切聯系,張麗麗等[11]研究認為AIH歸屬于IgG相關疾病。目前普遍認為IgM可作為PBC輔助診斷參數,IgM變化與PBC患者長期預后存在一定聯系[12]。本研究中相較于AIH組,PBC組IgM水平出現大幅度升高,同時 IgG、IgG4水平也明顯低于AIH組,也證實以上猜測。補體也參與機體的免疫功能變化,其中C3、C4的激活可參與機體免疫應答及炎癥反應,而肝臟是補體合成的重要器官,AILD機體肝功下降,合成C3、C4能力降低,而C3、C4活化水平減少可嚴重影響機體免疫功能平衡,加重患者病情。本研究中AIH組、PBC組患者C3、C4水平明顯低于對照組,提示C3、C4水平變化也可作為評估AILD病情嚴重指標之一。
綜上所述,AILD可表現肝功、免疫指標及肝病相關抗體異常表達,綜合分析肝功、免疫指標及肝病相關抗體等指標在鑒別AILD類型具有重要意義,有助于提高診斷準確度。但由于本研究時間較短,尚未分析不同預后AILD患者肝功、免疫指標及肝病相關抗體異常表達情況,未來將擴大研究對象及增加研究時間進行深入探究。

