致病疫霉菌效應(yīng)蛋白Pi05440毒性功能驗(yàn)證及寄主候選靶標(biāo)篩選
張 蝶 陳勝男 趙 迪 王薈潔 王洪洋 劉 晶
(云南師范大學(xué),云南省馬鈴薯生物學(xué)重點(diǎn)實(shí)驗(yàn)室,云南 昆明 650500)
馬鈴薯(Solanumtuberosum)富含碳水化合物、維生素、礦物質(zhì)和抗氧化物質(zhì)等營(yíng)養(yǎng)成分,對(duì)人類健康和可持續(xù)農(nóng)業(yè)發(fā)展至關(guān)重要[1]。然而,馬鈴薯生產(chǎn)過(guò)程中會(huì)面臨許多病害的威脅,其中最為嚴(yán)重的是由致病疫霉菌(Phytophthorainfestans)引起的晚疫病。致病疫霉菌是一種卵菌,可以通過(guò)空氣、土壤、水體等途徑進(jìn)行傳播,侵染馬鈴薯塊莖、莖、葉片等組織,嚴(yán)重發(fā)生時(shí)可造成馬鈴薯絕收[2]。
為了成功入侵植物,致病疫霉菌會(huì)分泌一系列效應(yīng)蛋白進(jìn)入寄主細(xì)胞,通過(guò)操縱寄主靶標(biāo)抑制植物免疫反應(yīng)。根據(jù)作用部位不同,可將效應(yīng)蛋白分為質(zhì)外體效應(yīng)蛋白和胞質(zhì)效應(yīng)蛋白兩大類。質(zhì)外體效應(yīng)蛋白主要為一些蛋白酶抑制子,如葡聚糖酶、半胱氨酸蛋白酶抑制子及NEP1-like 家族蛋白等。胞質(zhì)效應(yīng)蛋白主要包括RxLR和CRN類效應(yīng)蛋白[3],其中,P.infestans菌株T30-4中RxLR類效應(yīng)蛋白有563個(gè),研究發(fā)現(xiàn)RxLR類效應(yīng)蛋白顯著影響P.infestans的致病性[4],而CRN蛋白家族可以使寄主葉片皺縮和壞死[5-7]。
相較于胞質(zhì)效應(yīng)蛋白,質(zhì)外體效應(yīng)蛋白的研究較少,但其在植物病原菌致病過(guò)程中具有一定重要性。大豆疫霉菌(Phytophthorasojae)產(chǎn)生的效應(yīng)蛋白PsAvh240,通過(guò)抑制大豆(Glycinemax)植物免疫系統(tǒng)中的天冬氨酸蛋白酶GmAP1的分泌來(lái)破壞植物免疫力,從而促進(jìn)感染。PsAvh240 位于質(zhì)外體并與GmAP1 在質(zhì)膜上進(jìn)行相互作用。研究表明,PsAvh240 在質(zhì)膜上的定位和二聚化是其發(fā)揮致病作用的關(guān)鍵[8]。蛋白酶抑制子在病原菌致病性方面扮演著重要的角色,一些病原菌會(huì)通過(guò)分泌蛋白酶抑制子來(lái)抑制植物的防御反應(yīng),從而促進(jìn)病原菌自身的生長(zhǎng)和侵染[9]。EPICs 是一類由P.infestans分泌的半胱氨酸蛋白酶抑制子。EPICs 通過(guò)靶向半胱氨酸蛋白酶C14 干擾植物的免疫反應(yīng)[10]。P.infestans分泌的半胱氨酸蛋白酶抑制子EPIC2B與番茄中的半胱氨酸蛋白酶PhytophthoraInhibited Protease 1(PIP1)發(fā)生互作并抑制PIP1的酶活[11]。
前期研究發(fā)現(xiàn),質(zhì)外體效應(yīng)蛋白編碼基因Pi05440(Genbank: XM_002999037.1,EPI6)是一種Kazal型絲氨酸蛋白酶抑制子[12]。Pi05440在致病疫霉菌侵染馬鈴薯36 h 時(shí)上調(diào)表達(dá)[13],說(shuō)明該基因參與致病疫霉菌侵染過(guò)程。然而,有關(guān)效應(yīng)蛋白Pi05440 在植物體內(nèi)的靶標(biāo)蛋白和如何發(fā)揮毒性功能尚不清楚。因此,本研究對(duì)Pi05440 進(jìn)行生物信息學(xué)分析和毒性功能鑒定,并以Pi05440 為誘餌篩選其在馬鈴薯中的寄主靶標(biāo)蛋白,旨在為進(jìn)一步揭示效應(yīng)蛋白Pi05440 調(diào)控植物免疫分子機(jī)理提供依據(jù)。
1 材料與方法
1.1 材料與試劑
致病疫霉菌株88069 由云南師范大學(xué)云南省馬鈴薯生物學(xué)重點(diǎn)實(shí)驗(yàn)室(本實(shí)驗(yàn)室)保存,菌株生長(zhǎng)和保存采用黑麥培養(yǎng)基。本氏煙栽種于校內(nèi)恒溫育種溫室內(nèi)。
DH5α 感受態(tài)、GV3101 電擊感受態(tài)、酵母NMY51菌株、pTSU2-APP、pOst1-NubI、pNubG-Fe65、pPR3-N,購(gòu)自上海歐易生物科技有限公司。高保真酶(Phanata?Super-Fidelity DNA Polymerase)、反轉(zhuǎn)錄試劑盒、無(wú)縫克隆試劑盒,購(gòu)自南京諾唯贊生物科技股份有限公司。DNA純化回收試劑盒、酵母質(zhì)粒提取試劑盒,購(gòu)自北京天根生物技術(shù)有限公司。酵母缺陷培養(yǎng)基SD/-Leu、SD/-Trp、SD/-Leu/-Trp、SD/-Leu/-Trp/-His、SD/-Leu/-Trp/-His/-Ade、SD/-Trp/-His/-Ade 液體培養(yǎng)基、XGal、鮭魚精DNA,購(gòu)自寶生物工程(大連)有限公司。瓊脂糖凝膠DNA 回收試劑盒(增強(qiáng)型)、質(zhì)粒小提試劑盒、3-氨基-1,2,4-三唑(3-amino-1,2,4-triazole,3-AT),購(gòu)自北京天根生物技術(shù)有限公司。
1.2 儀器與設(shè)備
ZQZY-78CV震蕩培養(yǎng)箱,上海知楚儀器有限公司;WPL-230BE 電熱恒溫培養(yǎng)箱,天津泰斯特儀器有限公司;BBS-DDC 醫(yī)用潔凈工作臺(tái),濟(jì)南鑫貝西生物技術(shù)有限公司;A300DNA 擴(kuò)增儀,杭州朗基科學(xué)儀器有限公司;GelView 5000Plu 全自動(dòng)凝膠成像分析系統(tǒng)(廣州博鷺騰生物科技有限公司);Power-B 電泳儀,北京凱元信瑞儀器有限公司;NP80 Touch 超微量紫外可見(jiàn)分光光度計(jì),Implen 公司(德國(guó));LSM 900 激光共聚焦顯微鏡,Zeiss公司(德國(guó))。
1.3 試驗(yàn)方法
1.3.1 目的基因編碼的氨基酸序列分析 在NCBI中的Conserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析結(jié)構(gòu)域;預(yù)測(cè)目的基因編碼蛋白在SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)在線網(wǎng)站上預(yù)測(cè)信號(hào)肽。
1.3.2 Pi05440 表達(dá)載體的構(gòu)建 從NCBI 獲取Pi05440 的編碼序列(coding sequence,CDS)并使用SignalP 4.1在線網(wǎng)站預(yù)測(cè)其信號(hào)肽區(qū)域;將去除信號(hào)肽Pi05440 的CDS 序列插入pRI101-GFP 載體[14],構(gòu)建pRI101-GFP-Pi05440。以致病疫霉菌生理小種88069基因組DNA 為模板,以pRI101-GFP-Pi05440為基因引物(表1),使用高保真酶體系擴(kuò)增目的片段,將PCR產(chǎn)物通過(guò)電泳切膠回收純化后,測(cè)定其濃度。通過(guò)無(wú)縫克隆技術(shù)將目的基因Pi05440連接到相應(yīng)酶切位點(diǎn)的pRI101-GFP載體中,進(jìn)行大腸桿菌(E.coil)DH5α熱激轉(zhuǎn)化,倒置培養(yǎng)16 h左右,將分離的單克隆菌落用LB液體培養(yǎng)基培養(yǎng),采用菌落PCR方法對(duì)其進(jìn)行鑒定并測(cè)序。將測(cè)序正確的質(zhì)粒轉(zhuǎn)化到農(nóng)桿菌GV3101細(xì)胞中。
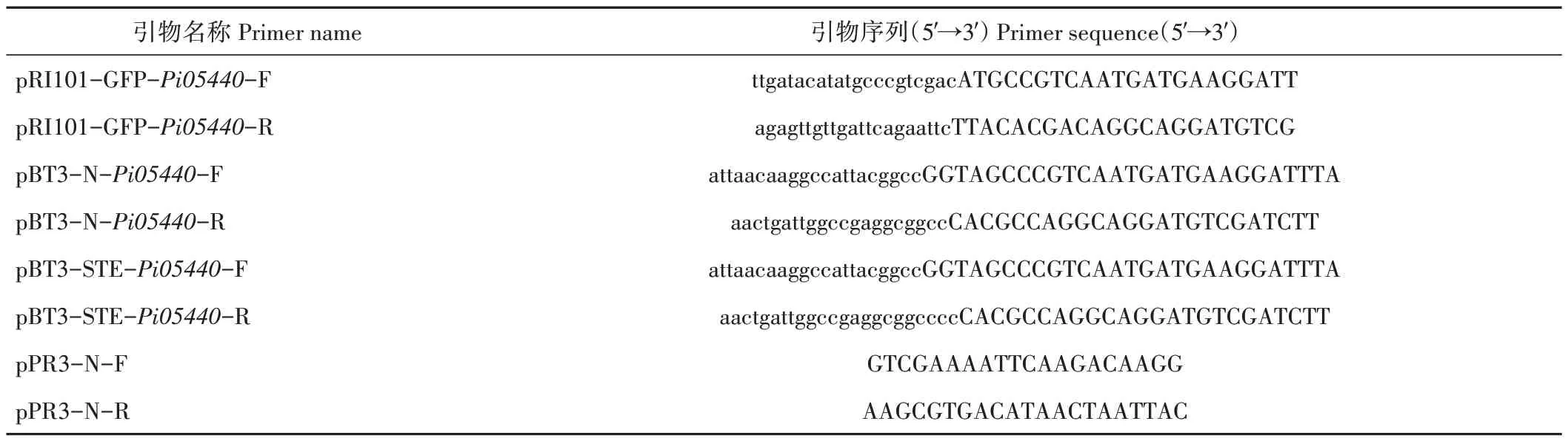
表1 引物序列Table 1 Primers used in this study
1.3.3 Pi05440亞細(xì)胞定位和毒性功能分析 將含有pRI101-GFP、GFP-Pi05440 以及轉(zhuǎn)錄沉默抑制子P19[15]的農(nóng)桿菌在含有50 mg·mL-1卡那和25 mg·mL-1利福平抗生素的LB 平板上進(jìn)行活化。參照孫春蓮等[15]方法進(jìn)行操作,將農(nóng)桿菌pRI101-GFP、GFP-Pi05440懸浮液調(diào)至OD600=0.01 與農(nóng)桿菌P19(OD600=0.005)等體積混勻,避光靜置1~2 h 后,將混合后的菌液用去除針頭的1 mL 注射器在生長(zhǎng)4 周的本氏煙背面進(jìn)行注射,使菌液浸潤(rùn)整個(gè)葉片,每株取3 片葉,重復(fù)3 次,共9 株。表達(dá)2 d 后,用鑷子撕取葉片下表皮并用4%NaCl 處理15 min 后進(jìn)行熒光顯微鏡觀察。另將pRI101-GFP、GFP-Pi05440 與P19 農(nóng)桿菌懸浮液OD600值調(diào)至0.1 后等體積混勻,將混合液分別注射至本氏煙左右兩邊,瞬時(shí)表達(dá)24 h 后,接種孢子量約為100~150 個(gè)的致病疫霉菌88069,24 h 黑暗處理,接種6 d后,用游標(biāo)卡尺測(cè)量病斑面積(S=1/4×π×長(zhǎng)×寬),用Excel 2021 軟件對(duì)病斑面積進(jìn)行t測(cè)驗(yàn)(兩尾檢驗(yàn)),分析其差異顯著性。
1.3.4 Pi05440誘餌載體的構(gòu)建 根據(jù)酵母雙雜交膜系統(tǒng)cDNA 文庫(kù)篩庫(kù)要求,誘餌蛋白需要先構(gòu)建在pBT3-N 和pBT3-STE 這2 種誘餌載體上,以驗(yàn)證誘餌蛋白是否能夠在酵母中正常表達(dá),從而進(jìn)行后續(xù)酵母篩庫(kù)試驗(yàn)。根據(jù)2 種誘餌載體的多克隆位點(diǎn),分別設(shè)計(jì)Pi05440基因引物(表1),以致病疫霉菌生理小種88069基因組DNA為模板進(jìn)行PCR擴(kuò)增。之后使用限制性核酸內(nèi)切酶SfiI 對(duì)pBT3-N、pBT3-STE 質(zhì)粒及Pi05440基因擴(kuò)增產(chǎn)物進(jìn)行酶切。最后用T4 DNA ligase 對(duì)酶切后的Pi05440基因產(chǎn)物和線性化載體進(jìn)行重組連接,連接后轉(zhuǎn)化至大腸桿菌DH5α 中,篩選陽(yáng)性克隆并鑒定。
1.3.5 誘餌載體功能驗(yàn)證及自激活檢測(cè) 質(zhì)粒組合pTSU2-APP+pNubG-Fe65 為陽(yáng)性對(duì)照,質(zhì)粒組合pTSU2-APP+pPR3-N 為陰性對(duì)照,將構(gòu)建好的pBT3-STE-Pi05440 和 pOst1-NubI、pBT3-N-Pi05440 和pOst1-NubI分別加入到制備好的酵母感受態(tài)中進(jìn)行功能驗(yàn)證,同時(shí)按照相同轉(zhuǎn)化方法將質(zhì)粒組合pBT3-STE-Pi05440+pPR3-N、pBT3-N-Pi05440+pPR3-N 分別轉(zhuǎn)化進(jìn)行自激獲驗(yàn)證。之后將菌液涂布至營(yíng)養(yǎng)缺陷型平板上SD-Trp-Leu(DDO)、SD-Trp-Leu-His(TDO)及SD-Trp-Leu-His-Ade(QDO),培養(yǎng)3~5 d后,觀察酵母生長(zhǎng)情況。所有DDO 平板應(yīng)出現(xiàn)100~1 000 個(gè)克隆,若低于此數(shù)量則說(shuō)明轉(zhuǎn)化效率低,需重新轉(zhuǎn)化;在陽(yáng)性對(duì)照和陰性對(duì)照生長(zhǎng)情況符合條件情況下,若在TDO、QDO 平板生長(zhǎng)率達(dá)到10%~100%,則說(shuō)明誘餌蛋白在膜體系酵母雙雜中功能正確表達(dá);若在TDO、QDO平板上無(wú)生長(zhǎng)則說(shuō)明誘餌蛋白不存在自激活,反之則需要進(jìn)行篩選合適濃度的3-AT抑制自激活。
1.3.6 篩選合適3-AT濃度 通過(guò)醋酸鋰法將自激活較弱的pBT3-STE-Pi05440 質(zhì)粒轉(zhuǎn)入NMY51 酵母菌株,再將質(zhì)粒pPR3-N 轉(zhuǎn)入含誘餌質(zhì)粒pBT3-STEPi05440 的NMY51 酵母菌株,分別涂布于含0、0.25、0.5、1、1.5、2、3、4 mol·L-13-AT 的TDO 平板上,同時(shí)轉(zhuǎn)化pTSU2-APP和pNubG-Fe65作為陽(yáng)性對(duì)照用以驗(yàn)證轉(zhuǎn)化體系,將其涂布于不含3-AT 的TDO 平板。上述平板均倒置于30 ℃恒溫培養(yǎng)箱培養(yǎng)3~5 d,觀察酵母生長(zhǎng)情況,按照自激活酵母單克隆生長(zhǎng)量最少確定合適的3-AT濃度。
1.3.7 酵母雙雜交膜系統(tǒng)cDNA 文庫(kù)篩選 將含有pBT3-STE-Pi05440 質(zhì)粒的NMY51 酵母在SD/-Leu 液體培養(yǎng)基中過(guò)夜培養(yǎng),測(cè)量OD546值,計(jì)算OD546值所需菌液數(shù)量;將菌體重懸于30 ℃預(yù)熱的2×酵母膏胨葡萄糖腺嘌呤(yeast peptone dextrose adenine,YPDA)液體培養(yǎng)基中使得菌液OD546值為0.15,恒溫?fù)u床培養(yǎng)3~5 h至OD546值為0.6~0.7。以馬鈴薯栽培種合作88葉片為材料,采用Gateway 技術(shù)對(duì)葉片總RNA 處理后將其克隆到pPR3-N 載體中形成膜文庫(kù)質(zhì)粒。將誘餌載體和膜文庫(kù)質(zhì)粒共轉(zhuǎn)化到酵母菌中,涂布在DDO 平板,用于驗(yàn)證轉(zhuǎn)化效率;將剩余重懸菌液涂布于含20 mg·L-1X-gal和3-AT的TDO平板上,倒置于30 ℃恒溫培養(yǎng)箱培養(yǎng)3~5 d,觀察菌落生長(zhǎng)情況。挑取TDO平板上長(zhǎng)出的藍(lán)色單克隆,在含20 mg·L-1和X-gal 的QDO 平板上劃線,倒置于30 ℃恒溫培養(yǎng)箱培養(yǎng)3~5 d 觀察酵母生長(zhǎng)及變藍(lán)情況。
為了驗(yàn)證酵母雙雜交初篩陽(yáng)性克隆是否與Pi05440發(fā)生互作,將陽(yáng)性克隆質(zhì)粒與誘餌質(zhì)粒pBT3-STEPi05440 進(jìn)行酵母回補(bǔ)驗(yàn)證。陽(yáng)性對(duì)照為pTSU2-APP+pNubG-Fe65,陰性對(duì)照為pTSU2-APP+pPR3-N,涂布在DDO 平板和含有3-AT 和20 mg·L-1X-gal 的QDO 平板上。30 ℃倒置培養(yǎng)3~5 d,根據(jù)生長(zhǎng)情況,判斷初篩互作蛋白是否與Pi05440發(fā)生互作。
2 結(jié)果與分析
2.1 效應(yīng)蛋白Pi05440的生物信息學(xué)分析
2.1.1 效應(yīng)蛋白Pi05440 的保守結(jié)構(gòu)域分析 基因Pi05440全長(zhǎng)969 bp,通過(guò)NCBI 比對(duì)得到效應(yīng)蛋白Pi05440 氨基酸序列,該效應(yīng)蛋白共編碼322 個(gè)氨基酸,含有典型的KAZAL 區(qū)域,是KAZAL 型絲氨酸蛋白酶抑制子家族蛋白,可作為絲氨酸蛋白酶抑制子(圖1)。
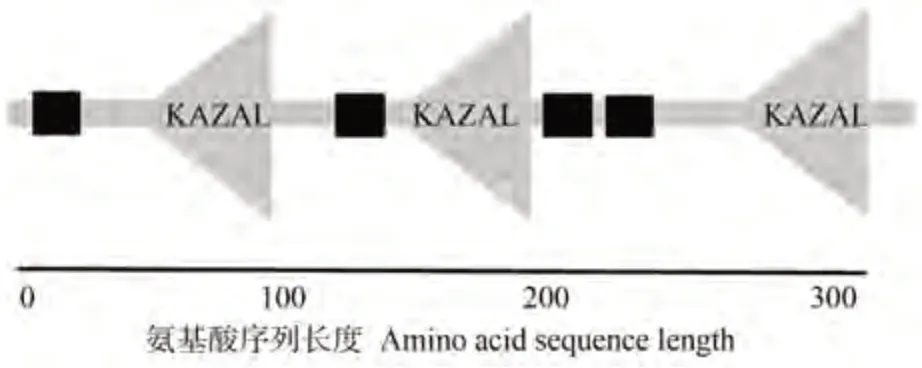
圖1 效應(yīng)蛋白Pi05440的保守結(jié)構(gòu)域分析Fig.1 Conserved structural domain analysis of effector protein Pi05440
2.1.2 效應(yīng)蛋白Pi05440的信號(hào)肽分析 經(jīng)SignalP4.1在線網(wǎng)站分析,發(fā)現(xiàn)效應(yīng)蛋白Pi05440 信號(hào)肽的長(zhǎng)度為20個(gè)氨基酸。信號(hào)肽切割位點(diǎn)C的最高值為0.684,位于第20 位氨基酸;而信號(hào)肽分?jǐn)?shù)S 的最高值為0.880,位于第1 位氨基酸。合并后的切割位點(diǎn)Y 在第20 位氨基酸處,最高值約為0.740。預(yù)測(cè)表明Pi05440信號(hào)肽序列為1~20位氨基酸(圖2)。
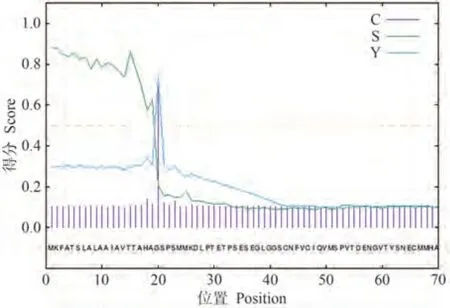
圖2 效應(yīng)蛋白Pi05440信號(hào)肽預(yù)測(cè)Fig.2 Effector protein Pi05440 signal peptide prediction
2.2 效應(yīng)蛋白Pi05440毒性功能分析
將含有GFP、GFP-Pi05440 質(zhì)粒的農(nóng)桿菌菌液與含有P19 的農(nóng)桿菌按照等體積混勻,分別注射至本氏煙的左右兩邊,瞬時(shí)表達(dá)24 h 后,接種致病疫霉菌88069,6 d 后觀察發(fā)病情況。與對(duì)照GFP 相比,表達(dá)GFP-Pi05440的發(fā)病面積極顯著增大(圖3),結(jié)果說(shuō)明瞬時(shí)表達(dá)該基因可以促進(jìn)致病疫霉菌定殖。
圖3 效應(yīng)蛋白Pi05440對(duì)致病疫霉菌侵染的作用Fig.3 Effect of effector protein Pi05440 to P.infestans colonization
2.3 效應(yīng)蛋白Pi05440定位
為了探究效應(yīng)蛋白Pi05440 在植物細(xì)胞中的定位情況,對(duì)融合蛋白GFP-Pi05440 表達(dá)的本煙細(xì)胞進(jìn)行質(zhì)壁分離,結(jié)果發(fā)現(xiàn)GFP 熒光主要在質(zhì)膜和細(xì)胞間隙中積累表達(dá)(圖4)。說(shuō)明Pi05440 是一個(gè)定位在質(zhì)膜和細(xì)胞間隙的質(zhì)外體效應(yīng)蛋白。
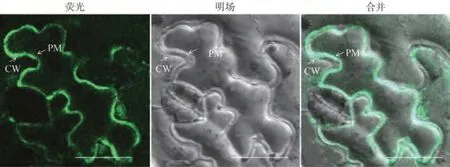
圖4 效應(yīng)蛋白Pi05440亞細(xì)胞定位Fig.4 Subcellular localization of effector protein Pi05440
2.4 誘餌載體功能驗(yàn)證與自激活檢測(cè)
將共轉(zhuǎn)后含有不同質(zhì)粒組合的NMY51 酵母菌株涂布于不同營(yíng)養(yǎng)缺陷培養(yǎng)基上,30 ℃培養(yǎng)5 d。功能驗(yàn)證反應(yīng)中,pBT3-N-Pi05440+pOst1-NubI、pBT3-STEPi05440+pOst1-NubI 在QDO 平板上均正常生長(zhǎng),這表明Pi05440基因在誘餌載體pBT3-N、pBT3-STE 下能正確表達(dá)蛋白。自激活檢測(cè)顯示,含有誘餌載體pBT3-N-Pi05440+pPR3-N 空載的酵母菌株在QDO 平板上呈強(qiáng)生長(zhǎng)現(xiàn)象,推測(cè)其在功能驗(yàn)證反應(yīng)中的出現(xiàn)的生長(zhǎng)現(xiàn)象是其自激活導(dǎo)致,表明誘餌載體pBT3-N不適用Pi05440酵母雙雜交膜系統(tǒng)的cDNA 文庫(kù)篩選。另外,含pBT3-STE-Pi05440+pPR3-N空載的酵母菌株在QDO 平板上存在較弱的自激活現(xiàn)象(圖5)。綜合考慮,選定pBT3-STE 為誘餌載體用于后續(xù)酵母雙雜交膜系統(tǒng)cDNA文庫(kù)篩選。

圖5 誘餌載體功能驗(yàn)證與自激活檢測(cè)Fig.5 Functional validation and self-activation detection of decoy carriers
2.5 篩選條件分析
使用醋酸鋰法將轉(zhuǎn)化后的酵母菌株分別涂布在含有不同濃度3-AT 的TDO 平板上。試驗(yàn)結(jié)果如圖6 所示,陽(yáng)性對(duì)照酵母正常生長(zhǎng),表明轉(zhuǎn)化體系正常。當(dāng)抑制劑3-AT 濃度設(shè)定為2 mol·L-1時(shí),可以有效抑制pBT3-STE-Pi05440 的自激活反應(yīng)。考慮到較高濃度的3-AT可能會(huì)影響存在弱互作蛋白的篩選,所以在后續(xù)的酵母雙雜交膜系統(tǒng)cDNA 文庫(kù)篩選和回補(bǔ)試驗(yàn)中均采用2 mol·L-1的3-AT濃度。
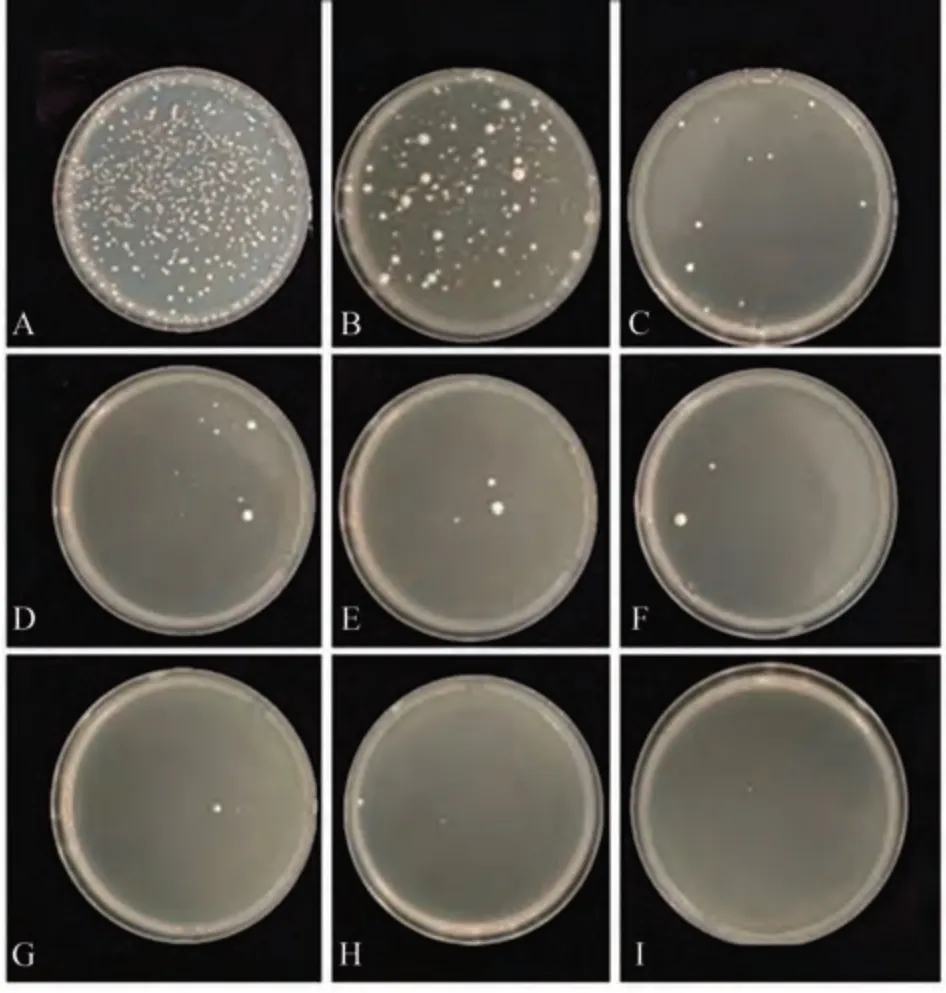
圖6 篩選條件分析Fig.6 Analysis of filtering conditions
2.6 Pi05440互作蛋白篩選及驗(yàn)證
以pBT3-STE-Pi05440 為誘餌進(jìn)行酵母雙雜交膜系統(tǒng)cDNA 文庫(kù)篩選。篩選結(jié)果表明,涂布稀釋10 倍的篩選轉(zhuǎn)化菌液平板約有900個(gè)克隆,涂布稀釋100倍的重懸菌液平板約有80 個(gè)克隆,說(shuō)明篩庫(kù)效率較好(圖7-A)。通過(guò)在含20 mg·L-1X-gal、2 mol·L-13-AT的TDO 平板篩選,獲得了藍(lán)色的酵母單克隆。挑取這些單克隆并在含20 mg·L-1X-gal、2 mol·L-13-AT 的QDO 方形平板上劃線,在30 ℃條件下培養(yǎng)5 d,生長(zhǎng)正常且變藍(lán)的酵母單克隆被認(rèn)為Pi05440 的候選互作靶標(biāo)(圖7-B)。挑取候選互作靶標(biāo)于SD/-Leu/-Trp 液體培養(yǎng)基中培養(yǎng),提取酵母質(zhì)粒,以載體克隆通用引物(pPR3-N-F 和pPR3-N-R)進(jìn)行PCR 擴(kuò)增,擴(kuò)增產(chǎn)物直接進(jìn)行純化、回收和測(cè)序。測(cè)序結(jié)果在NCBI數(shù)據(jù)庫(kù)中進(jìn)行blast 比對(duì)分析,去除相同序列的陽(yáng)性克隆,初步獲得3個(gè)候選靶標(biāo)蛋白。
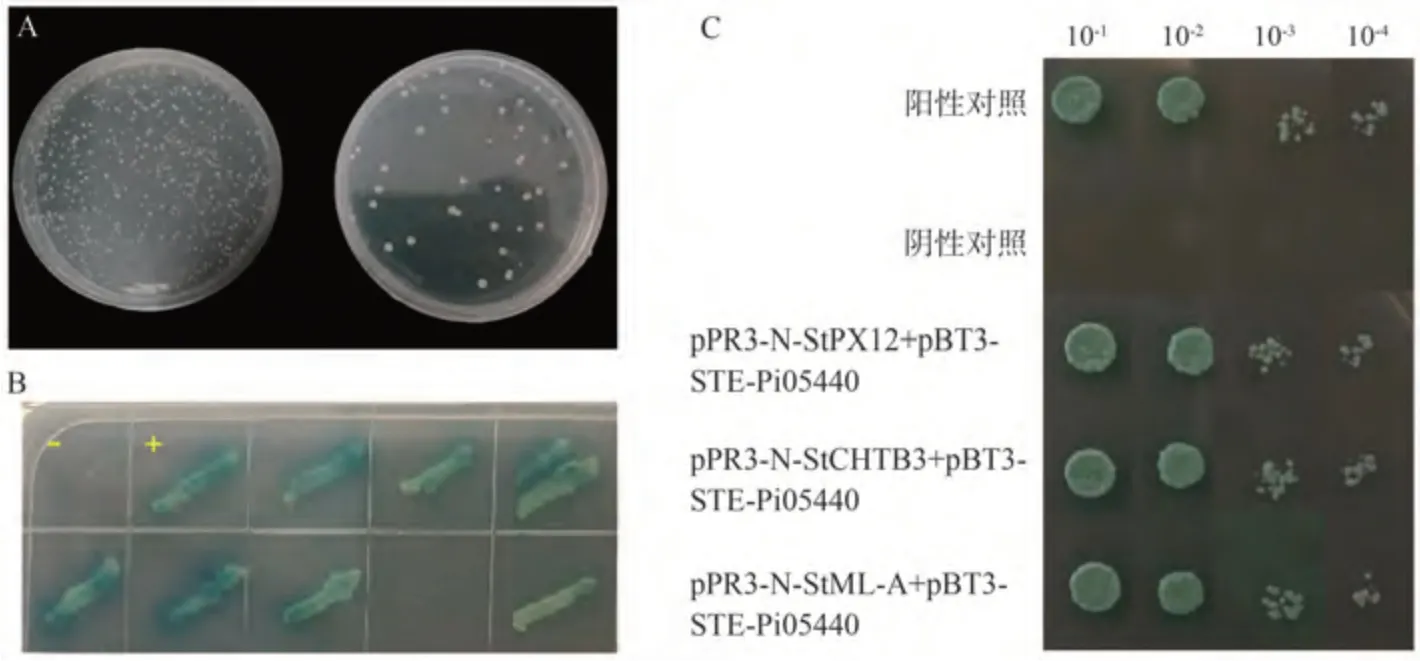
圖7 Pi05440互作蛋白篩選Fig.7 Screening of host protein of Pi05440
為了進(jìn)一步驗(yàn)證候選靶標(biāo)與Pi05440 的互作,將上述3 個(gè)候選靶標(biāo)質(zhì)粒與pBT3-STE-Pi05440 質(zhì)粒共轉(zhuǎn)化進(jìn)入NMY51 酵母感受態(tài)進(jìn)行酵母雙雜交回補(bǔ)驗(yàn)證。挑取DDO 平板上長(zhǎng)出的單菌落按10-1、10-2、10-3和10-4稀釋梯度進(jìn)行稀釋,然后點(diǎn)在含有20 mg·L-1X-gal、2 mol·L-13-AT 的QDO 平板上。結(jié)果發(fā)現(xiàn)待測(cè)酵母菌均能正常生長(zhǎng)(圖7-C),說(shuō)明這3 個(gè)候選靶標(biāo)蛋白均與效應(yīng)蛋白Pi05440互作。3個(gè)靶標(biāo)蛋白注釋分別是馬鈴薯過(guò)氧化氫酶12(Solanumtuberosumperoxidase 12)、馬鈴薯幾丁質(zhì)酶(Solanumtuberosumchitinase,chtB3)以及馬鈴薯MYB-like A 蛋白(SolanumtuberosumMYB-like protein A)(表2)。
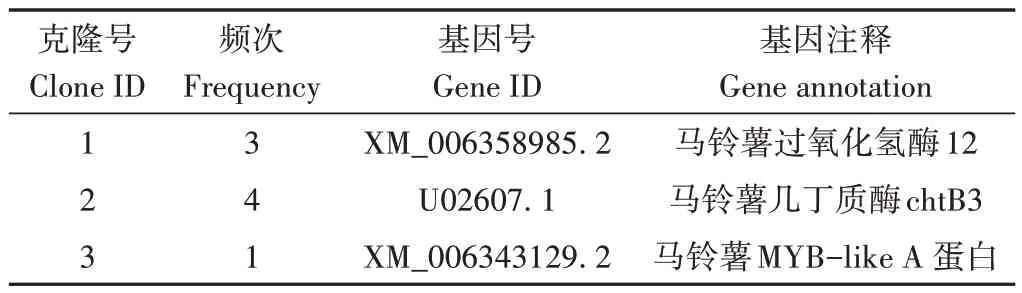
表2 馬鈴薯效應(yīng)蛋白Pi05440候選互作蛋白Table 2 The candidate interaction proteins of effector Pi05440 in potato
3 討論
在植物和病原菌的長(zhǎng)期進(jìn)化中,病原菌會(huì)釋放蛋白酶抑制子來(lái)抑制植物蛋白酶的活性[11]。例如通過(guò)蛋白互作和酶活檢測(cè)發(fā)現(xiàn),葉霉菌(Cladosporiumfulvum)分泌蛋白酶抑制子Avr2 與番茄半胱氨酸蛋白酶Rcr3pim互作并可以抑制其酶活[16]。另外,P.infestans分泌的蛋白酶抑制子EPIC1 和EPIC2B,也可同樣靶向Rcr3pim并抑制其活性,從而干擾植物免疫反應(yīng)[16]。因此,宿主蛋白酶與病原菌蛋白酶抑制子間相互作用是決定病原菌能否成功侵染的關(guān)鍵因素。通過(guò)篩選與鑒定效應(yīng)蛋白的寄主互作靶標(biāo),對(duì)進(jìn)一步揭示效應(yīng)蛋白毒性功能和P.infestans致病機(jī)理至關(guān)重要。根據(jù)效應(yīng)蛋白Pi05440 的結(jié)構(gòu)域分析,發(fā)現(xiàn)Pi05440 是一種KAZAL 型蛋白酶抑制子。通過(guò)酵母雙雜交技術(shù)初步篩選出3 個(gè)互作蛋白,分別是馬鈴薯過(guò)氧化氫酶12(Solanumtuberosumperoxidase 12)、馬鈴薯幾丁質(zhì)酶(Solanumtuberosumchitinase,chtB3)以及馬鈴薯MYBlike A 蛋白(SolanumtuberosumMYB-like protein A)。由于酵母雙雜交存在一定的假陽(yáng)性,后續(xù)需要通過(guò)雙分子熒光互補(bǔ)試驗(yàn)(Bimolecular Fluorescent Complimentary,BiFC)、熒光素酶互補(bǔ)試驗(yàn)(Luciferase Complementation Assay,LCA)和免疫共沉淀(Co-Immunoprecipitation,Co-IP)等技術(shù)驗(yàn)證候選蛋白是否與效應(yīng)蛋白Pi05440真實(shí)互作。
結(jié)合瞬時(shí)表達(dá)效應(yīng)子Pi05440和P.infestans接種鑒定結(jié)果,發(fā)現(xiàn)Pi05440可以降低植物抗病性,促使病斑面積顯著增大(圖3)。該結(jié)果與前人報(bào)道質(zhì)外體效應(yīng)蛋白作為蛋白酶抑制子促進(jìn)植物感病結(jié)果一致[9-10]。另外,亞細(xì)胞定位證明Pi054440 確實(shí)定位在細(xì)胞間隙和質(zhì)膜上,屬于P.infestans質(zhì)外體效應(yīng)蛋白(圖4)。這些結(jié)果暗示Pi05440 有可能作為蛋白酶抑制子靶向植物蛋白酶及其他因子發(fā)揮毒性功能。
過(guò)氧化物酶在植物中的作用廣泛,如調(diào)節(jié)植物對(duì)病原菌的抗性和產(chǎn)生一系列重要信號(hào)分子(過(guò)氧化氫、超氧陰離子等)[17]。如過(guò)表達(dá)過(guò)氧化物酶基因PRX33和PRX34激發(fā)過(guò)氧化氫等活性分子在植物體內(nèi)積累,從而增強(qiáng)植物對(duì)蕓薹生鏈格孢(Alternariabrassicicola)的抗性[18-19]。抑制過(guò)氧化物酶基因M21334會(huì)導(dǎo)致植株體內(nèi)H2O2積累減少和茉莉酸(jasmonic acid,JA)合成基因表達(dá)下調(diào),從而降低馬鈴薯對(duì)P.infestans的抗病性[20]。候選靶標(biāo)peroxidase 12 作為Pi05440 的互作蛋白,可能與馬鈴薯的晚疫病抗性可能存在關(guān)聯(lián),對(duì)于peroxidase 12 和Pi05440 如何協(xié)同調(diào)控馬鈴薯對(duì)晚疫病的抗性尚需深入研究。
幾丁質(zhì)酶是植物合成的一種抗真菌蛋白。在植物免疫系統(tǒng)中,幾丁質(zhì)酶通過(guò)降解病原菌細(xì)胞壁中的幾丁質(zhì)來(lái)抑制病原菌生長(zhǎng),從而提高植物的抗病性[21-22]。在辣椒中沉默幾丁質(zhì)酶編碼基因CaChiIII7會(huì)導(dǎo)致病程相關(guān)基因CaPR1和CaPR5表達(dá)下調(diào),H2O2積累、電導(dǎo)率、脯氨酸合成和根活性等顯著降低,從而增強(qiáng)植株對(duì)尖孢炭疽菌(Colletotrichumacutatum)的感病性[23]。chit36是來(lái)自棘孢木霉(Trichodermaasperelleoides)T203真菌的一種幾丁質(zhì)酶基因,過(guò)表達(dá)chit36可激發(fā)擬南芥CREK1/LysM RLK1受體激酶介導(dǎo)的信號(hào)傳導(dǎo),增強(qiáng)植株與對(duì)鹽、重金屬脅迫及灰霉菌(Botrytiscinerea)侵染的耐受性[24]。推測(cè)候選靶標(biāo)幾丁質(zhì)酶chtB3 可能參與馬鈴薯抗晚疫病抗性,而效應(yīng)蛋白Pi05440 是否通過(guò)靶向幾丁質(zhì)酶chtB3 調(diào)控馬鈴薯抗性反應(yīng)有待進(jìn)一步研究證實(shí)。
MYB 是植物中數(shù)量最多、功能最多樣化的轉(zhuǎn)錄因子家族之一,其在植物抗病防御過(guò)程中發(fā)揮重要作用[25]。過(guò)表達(dá)R2R3 型MYB 轉(zhuǎn)錄因子TaMYB391,可激活多個(gè)防御信號(hào)轉(zhuǎn)導(dǎo)通路相關(guān)基因表達(dá),其中包括活性氧,病程相關(guān)基因和絲裂原活化蛋白激酶,從而提高小麥對(duì)條銹菌(Pucciniastriiformisf.sp.tritici)的抗性[26]。擬南芥MYB 轉(zhuǎn)錄因子AtMYB44通過(guò)激活活性氧爆發(fā)和細(xì)胞死亡增加擬南芥對(duì)灰霉菌的感病性[27]。此外,MYB 轉(zhuǎn)錄因子在晚疫病抗性調(diào)控方面也有少量報(bào)道。超量表達(dá)番茄SlMYB49基因,能夠顯著增強(qiáng)番茄抗晚疫病和耐干旱能力[28]。利用基因編輯技術(shù)敲除番茄SlMYBs2基因后,發(fā)現(xiàn)抗病相關(guān)和活性氧清除相關(guān)基因表達(dá)下調(diào),降低了番茄對(duì)P.infestans的抗性[29]。上述研究證實(shí)了MYB轉(zhuǎn)錄因子是調(diào)控晚疫病抗性的重要因子。本研究發(fā)現(xiàn)作為MYB轉(zhuǎn)錄因子成員MYB-like A蛋白,可與效應(yīng)蛋白Pi05440 發(fā)生互作。這為以后研究Pi05440 除可以靶向植物蛋白酶以外,還可通過(guò)靶向其他類型蛋白調(diào)控植物免疫反應(yīng)提供參考。
4 結(jié)論
致病疫霉菌基因Pi05440全長(zhǎng)969 bp,編碼322個(gè)氨基酸。其所編碼的效應(yīng)蛋白質(zhì)包含典型KAZAL區(qū)域,屬于KAZAL型蛋白酶抑制子。效應(yīng)蛋白Pi05440可以促進(jìn)病原菌侵染,并且定位在細(xì)胞間隙和質(zhì)膜上。利用酵母雙雜交技術(shù)鑒定到3個(gè)與Pi05440互作的靶標(biāo)蛋白,分別為了馬鈴薯過(guò)氧化氫酶12、馬鈴薯幾丁質(zhì)酶、馬鈴薯MYB-like蛋白。
- 核農(nóng)學(xué)報(bào)的其它文章
- 融入思政元素的食品課程線上線下混合式教學(xué)研究
——以“全國(guó)食品類院系教學(xué)科研思政工作聯(lián)盟2021 年第一次會(huì)議”為例 - 中國(guó)食品包裝外國(guó)語(yǔ)言選擇現(xiàn)狀及完善措施
——以“2023 第六屆食品科學(xué)與營(yíng)養(yǎng)工程國(guó)際會(huì)議”為例 - 食品營(yíng)養(yǎng)學(xué)在體育訓(xùn)練中的應(yīng)用
——以“第五屆中國(guó)綠色農(nóng)業(yè)與食物營(yíng)養(yǎng)高峰論壇暨硒區(qū)圓桌會(huì)議”為例 - 基于農(nóng)業(yè)發(fā)展的職業(yè)院校電子商務(wù)物流人才培養(yǎng)建議
——以“2023 全國(guó)農(nóng)商互聯(lián)暨鄉(xiāng)村振興產(chǎn)銷對(duì)接大會(huì)”為例 - 土壤活性組分界面重金屬同位素分餾行為研究進(jìn)展
- 南疆阿拉爾墾區(qū)棉花物候期變化的關(guān)鍵氣候驅(qū)動(dòng)因子分析

