3個釀酒葡萄品種組培快繁體系的建立及優化
楊 波,王 昊,陳永偉,哈 蓉,靳 韋,徐 燦,張 敏,楊桂麗,楊宏波,馬文禮
(寧夏農墾農林牧技術推廣服務中心,寧夏銀川 750000)
0 引 言
【研究意義】葡萄(VitisviniferaL.)屬于葡萄科(Vitaceae)葡萄屬(VitisL.)落葉木質藤本植物[1]。寧夏賀蘭山東麓具有葡萄生長得天獨厚的氣候環境及地理條件[2,3]。近些年,隨著釀酒葡萄產業的規模化生產,寧夏陸續引進紫大夫、梅鹿輒、長相思等釀酒葡萄品種,以期解決釀酒葡萄品種單一與苗木質量參差不齊[4]以及葡萄病毒病發生而限制寧夏葡萄酒產業高質量發展的問題。同時,隨著對葡萄酒高品質的要求,對新釀酒葡萄品種的需求日益迫切[5],對長相思、小味兒多和紫大夫等小眾葡萄品種苗木的需求也越來越大,較為傳統的扦插繁殖雖方便簡單易操作,但該方法受品種枝條數量的限制,短期內繁殖的數量有限且苗木常攜帶病毒,且長期傳統的繁殖方法會造成葡萄品種嚴重退化現象[6]。因此,建立一套適合該品種的組培快繁脫毒體系對快速獲得無毒長相思、紫大夫等品種的優質苗木具有重要意義。【前人研究進展】鮮食葡萄陽光玫瑰[7]、紅提[8]、黑虎香[9]、夏黑、紅地球、玫瑰香、巨峰[10]等均已經建立組培快繁體系,釀酒葡萄品種赤霞珠、蛇龍珠等[11]老品種也均形成了組培快繁體系。但對于多數葡萄品種組培繼代培養時,不同品種對于培養基中細胞分裂素的需求不同。劉娜等[12]對赤霞珠、西拉、霞多麗和美樂4個釀酒葡萄品種進行組培快繁,認為半木質化莖段為外植體接種能夠提高成活率,且篩選出了適合這4個釀酒葡萄品種最佳啟動、增殖和生根培養基;徐美隆等[13]對釀酒葡萄赤霞珠組織培養快繁技術進行了優化;王婷等[14]以蛇龍珠為試驗材料,對離體快繁中的啟動、增殖培養基的種類和激素用量等關鍵技術措施進行了研究,篩選出了適于蛇龍珠的最佳組培快繁體系。【本研究切入點】雖然多個釀酒葡萄品種已經建立了組培快繁體系,但由于葡萄品種間存在一定差異,限制了釀酒葡萄的遺傳轉化等進程,需加大對釀酒葡萄新品種增殖、生根培養及脫毒影響因子的研究,提高其繁殖及脫毒效率。【擬解決的關鍵問題】以紫大夫、小味兒多和長相思3個釀酒葡萄品種為研究對象,通過研究無菌外植體消毒、啟動培養、增殖培養和再生脫毒等環節的關鍵技術,建立釀酒葡萄組培快繁體系,為釀酒葡萄新品種規模化生產提供依據。
1 材料與方法
1.1 材 料
試驗于2021年在寧夏農墾玉泉營苗木繁育有限公司組培實驗室進行,材料取自大棚生長的長相思、紫大夫和小味兒多3個釀酒葡萄品種。
1.2 方 法
1.2.1 外植體的消毒
取生長健壯植株的新生帶腋芽莖段(分割成3 cm 左右),在超凈工作臺上采用不同的消毒方式對莖段進行表面消毒,消毒后用無菌水沖洗3次,無菌濾紙吸干其表面水分,兩端分別切除5 mm左右,后接種于相應的啟動培養基上,采用3因素3水平的正交試驗設計L9(33),每個處理接種20個莖段,3次重復(下同)。觀察并統計褐化、污染及成活的外植體數,計算污染率、褐化率及成活率。表1
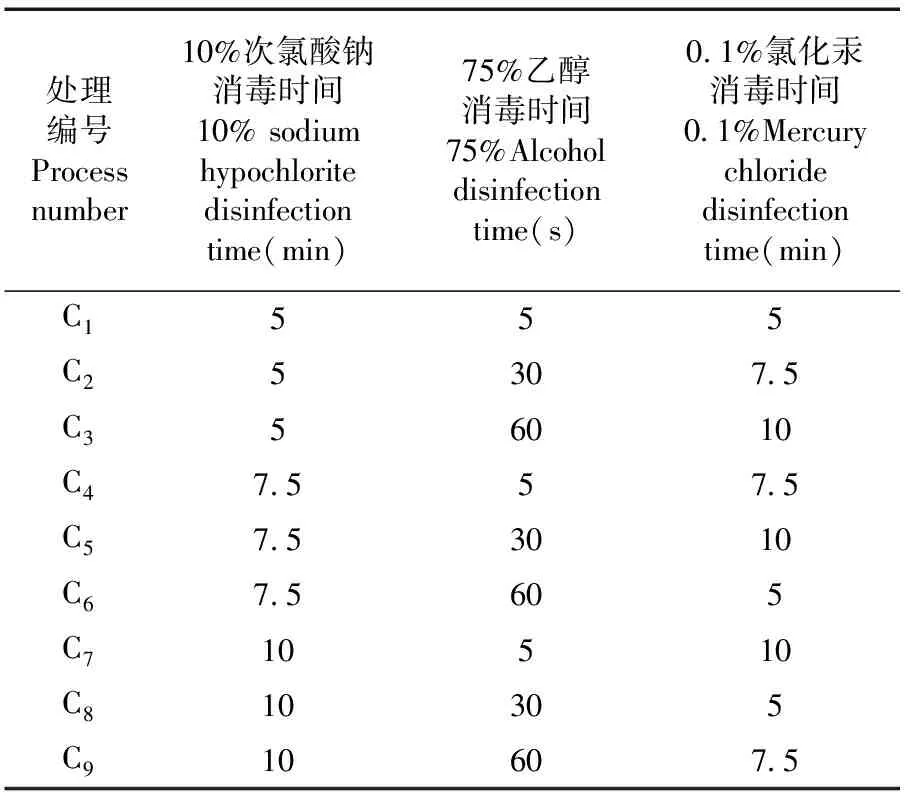
表1 不同釀酒葡萄品種外植體消毒處理
1.2.2 啟動培養基篩選
將消毒處理后的外植體接種于含有不同生長激素的不同培養基中,促其腋芽萌發。莖段離體培養20 d,腋芽萌發情況穩定,觀察并統計外植體萌芽數,計算萌芽率。培養條件:溫度(25±2)℃,光照強度2 500 lx(下同)。表2
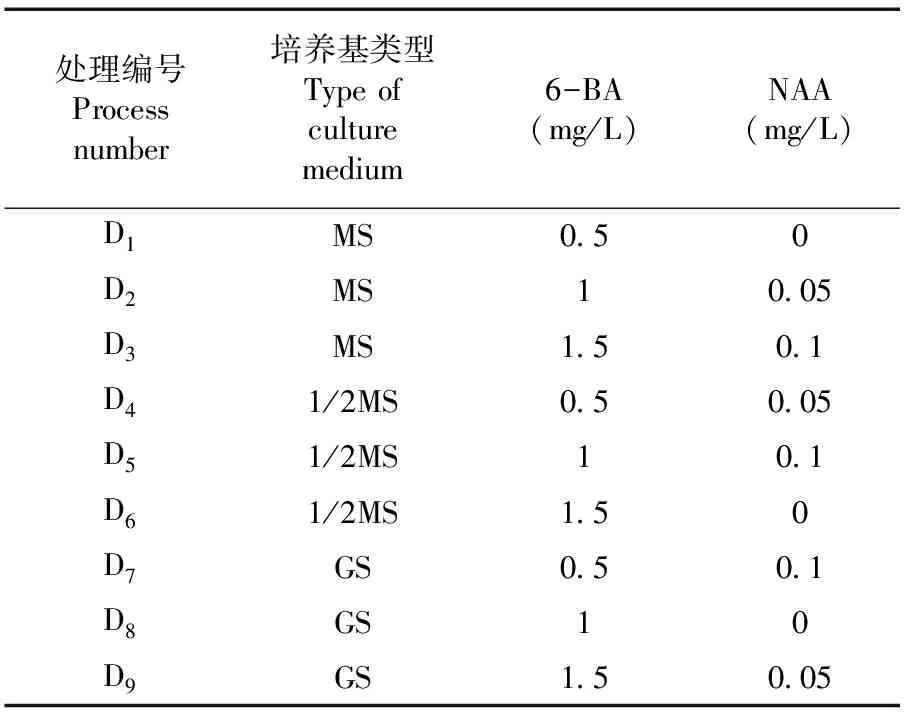
表2 不同釀酒葡萄品種外植體啟動培養基
1.2.3 繼代培養基篩選
將經初代培養獲得的無菌單芽,接種于含有不同植物生長調節劑組合的繼代培養基中,誘導不定芽產生,培養60 d,觀察并統計每個接種單芽的總芽數,計算增殖系數[15]。表3
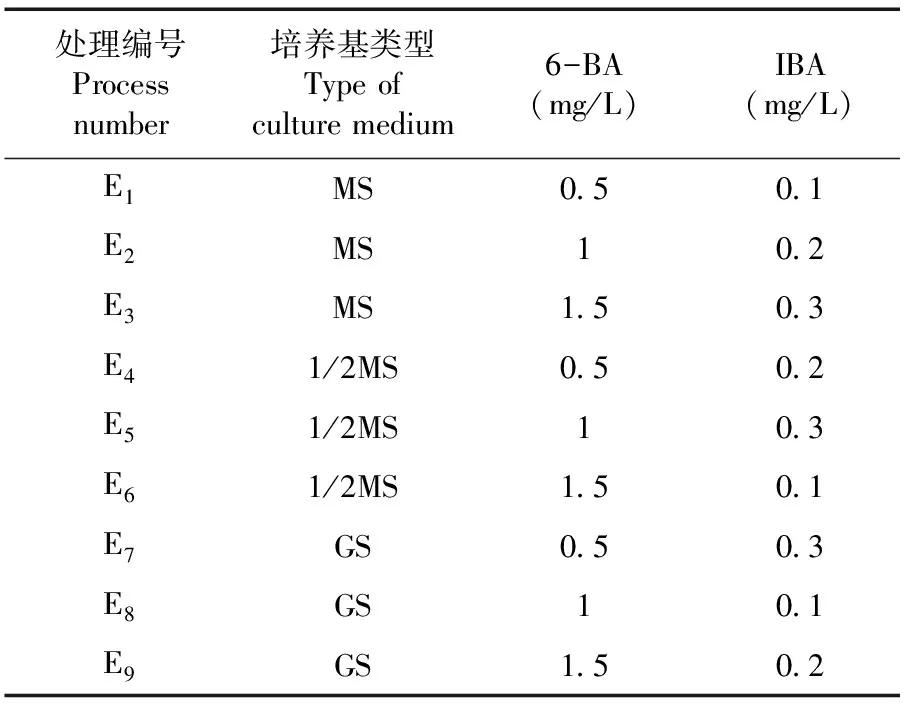
表3 不同釀酒葡萄品種繼代培養基篩選
1.2.4 生根培養基篩選
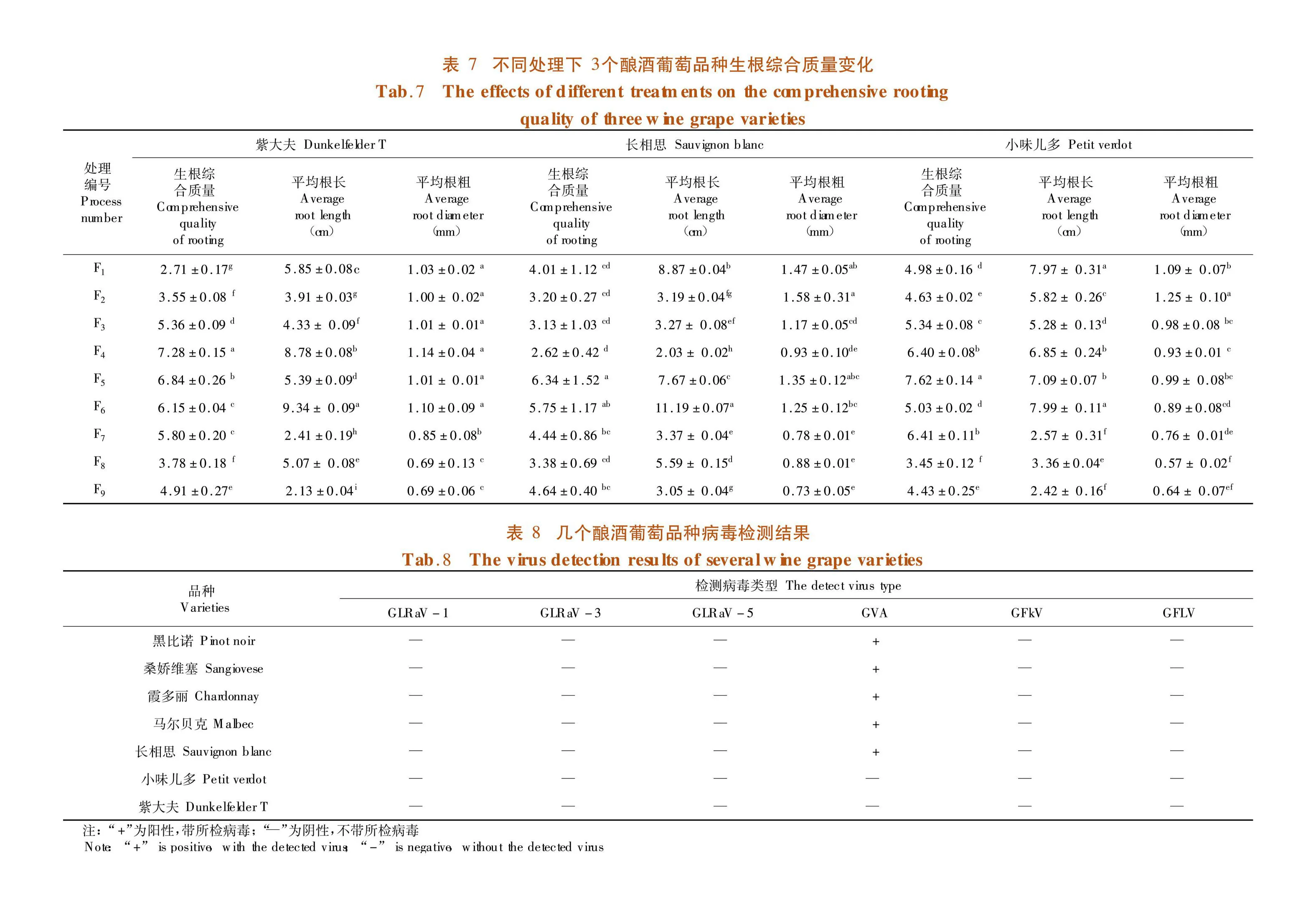
將繼代培養后的無菌單芽,接種于含有不同植物生長調節劑組合的不同繼代培養基中。培養30 d,觀察并記錄各單株的生根數、根長和根粗,計算生根率及生根綜合質量[16]。表4
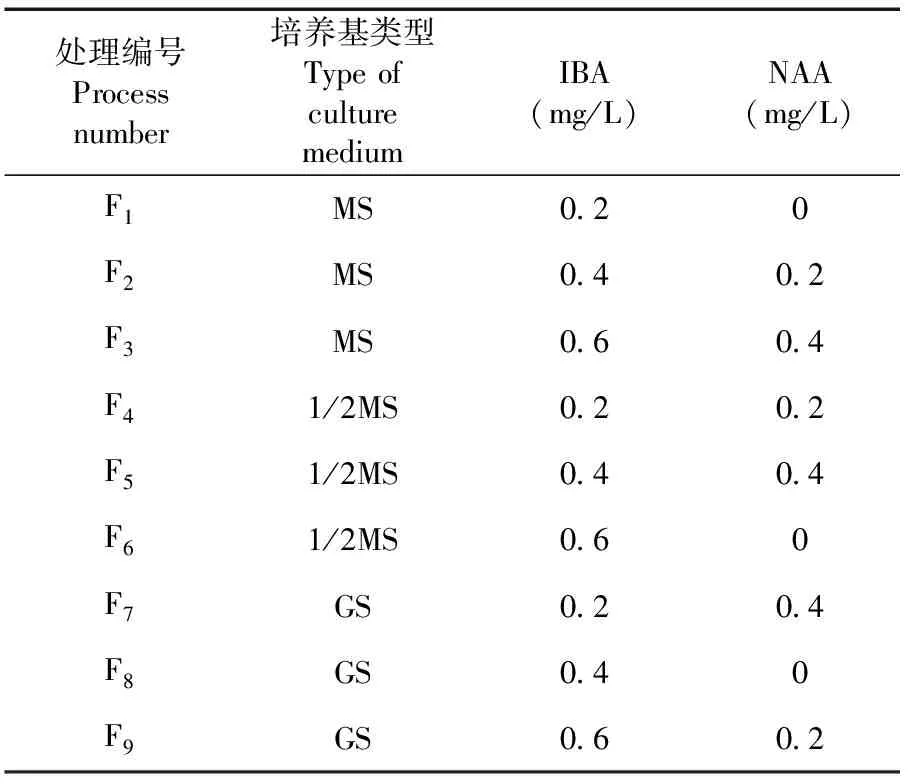
表4 不同釀酒葡萄品種生根培養基篩選
1.2.5 莖尖結合高溫處理脫毒
莖尖結合高溫處理脫毒是以7個釀酒葡萄品種黑比諾、桑嬌維塞、霞多麗、馬爾貝克、長相思、小味兒多、紫大夫為試材,將生長勢較好的組培苗轉接到生根培養基中,室溫條件下培養 15 d左右,待其根長至1~2 cm,株高長至2.5~3 cm,然后將組培苗轉移至恒溫培養箱中 32℃培養 7 d,再逐漸升溫至 38℃,熱處理 30 d 后,剝取1 mm莖尖轉接到新配制的生根培養基中[6]。生根培養基為:1/2 MS+0.4 mg/L IBA +0.2 mg/L NAA。
將成活后的脫毒葡萄試管苗送往中國農業科學院果樹研究所國家落葉果樹脫毒中心,進行葡萄卷葉病毒 1(GLRaV-1)、葡萄卷葉病毒 3(GLRaV-3)、葡萄卷葉病毒 5(GLRaV-5)、葡萄病毒 A(GVA)、葡萄斑點病毒7(GFkV)、葡萄扇葉病毒(GFLV)的檢測,單樣送檢植株數量為2瓶。
1.3 數據處理
分別采用 Excel 2007 和 SPSS 17.0 軟件進行數據整理與統計分析。
2 結果與分析
2.1 不同消毒處理對釀酒葡萄品種外植體污染及成活的影響
研究表明,小味兒多和長相思處理C5的污染率最低,分別為50.00%和37.93%;紫大夫污染率最低的是處理C6和處理C7的62.50%,其次是處理C5的67.75%。處理C5的污染率最低。
小味兒多處理C5的成活率最高,為57.00%;紫大夫成活率最高的是處理C6和處理C7的37.50%,長相思成活率最高的是處理C7的63.64%,其次是處理C5的62.07%。在9個不同消毒處理的組合中,處理C5(10%次氯酸鈉,消毒7.5 min;75%乙醇,消毒30 s;0.1%HgCl2,消毒10 min)能夠降低消毒后外植體的污染率,提高外植體的成活率。表5
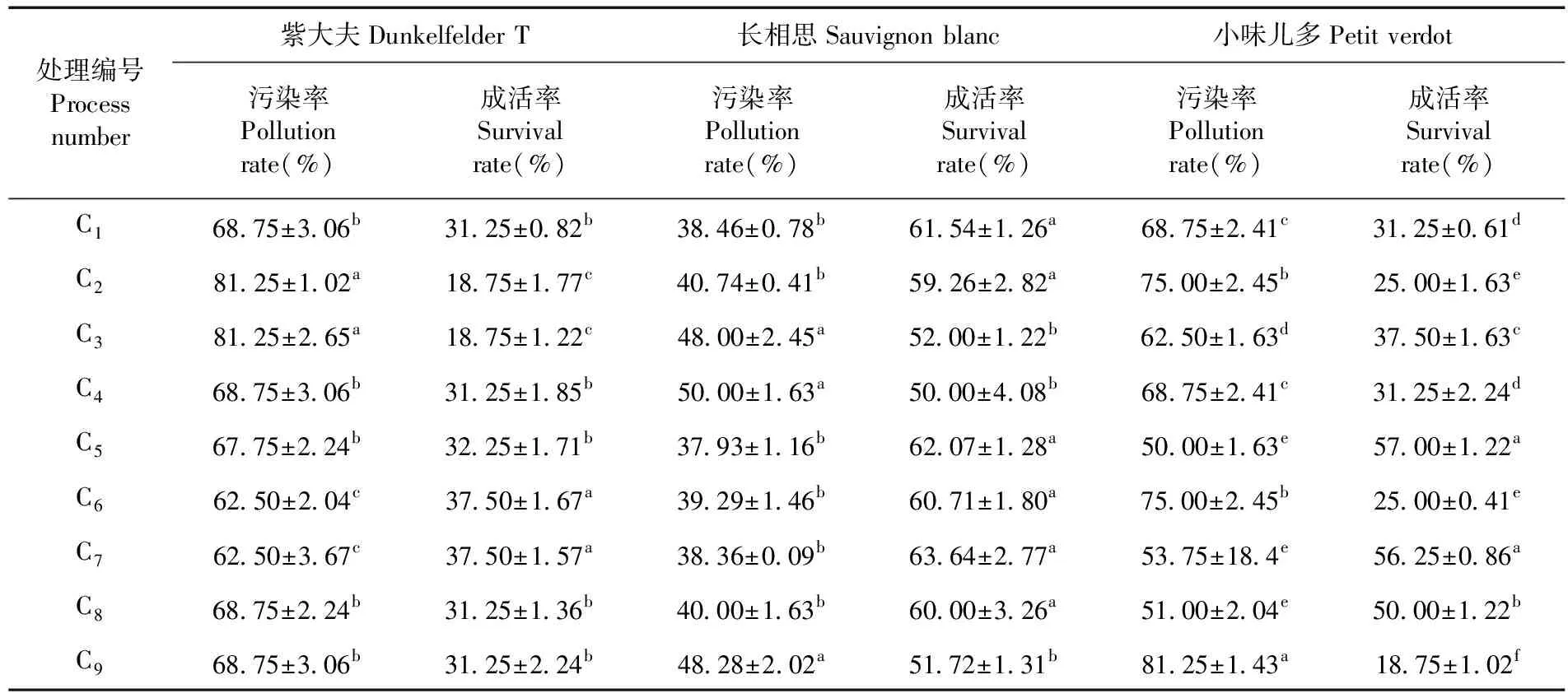
表5 不同處理下3個釀酒葡萄品種外植體成活率變化
2.2 不同處理對釀酒葡萄品種外植體萌芽率的影響
研究表明,以紫大夫品種為例,當培養基為MS培養基時,萌芽率從大到小依次為D2>D3>D1;當培養基為1/2 MS培養基時,萌芽率從大到小依次為D5>D4>D6;當培養基為GS培養基,萌芽率從大到小依次為D8>D7>D9,當培養基相同時,隨著激素6-BA的濃度增加萌芽率呈現先增加后降低的趨勢,最適激素6-BA的濃度是1.0 mg/L。當激素6-BA的濃度為1.0 mg/L時,萌芽率從大到小依次為D2>D8>D5;當激素6-BA的濃度為1.5 mg/L時,萌芽率從大到小依次為D9>D3>D6,當激素6-BA的濃度相同時,隨著激素NAA濃度的增加萌芽率也呈現先增加后降低的趨勢,最適激素NAA的濃度是0.1 mg/L。
處理D2(MS培養基,1.0 mg/L 6-BA,0.05 mg/L NAA)更利于外植體萌芽,可以提高大多數釀酒葡萄品種的萌芽率。圖1
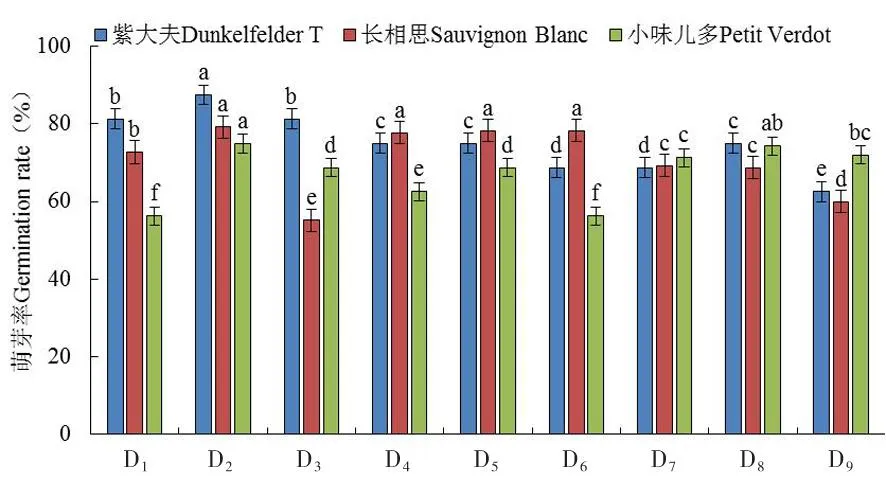
圖1 不同處理下釀酒葡萄品種 外植體萌芽率變化
2.3 不同處理對釀酒葡萄品種繼代培養增殖系數的影響
研究表明,不同處理下繼代培養基上各釀酒葡萄品種的增殖系數存在一定差異。以小味兒多品種為例,當基礎培養基為MS時,增殖系數從大到小依次為處理E3>E2>E1;當基礎培養基為1/2MS時,增殖系數從大到小依次為處理E5>E4>E6;當基礎培養基為GS時,增殖系數從大到小依次為處理E8>E7>E9,最適的激素6-BA的濃度為1.0 mg/L。當6-BA的濃度為0.5 mg/L時,增殖系數從大到小依次為處理E7>E4>E1;當6-BA的濃度為1.0 mg/L時,增殖系數從大到小依次為處理E5>E8>E2;當6-BA的濃度為1.5 mg/L時,增殖系數從大到小依次為處理E3>E9>E6,最適的激素NAA濃度為0.3 mg/L。其余3個釀酒葡萄品種也均表現為此規律。
處理E5(1/2MS培養基,1.0 mg/L 6-BA,0.3 mg/L IBA)的增殖系數最大,叢生芽增殖效果最佳,適于釀酒葡萄品種叢生芽的增殖培養。圖2
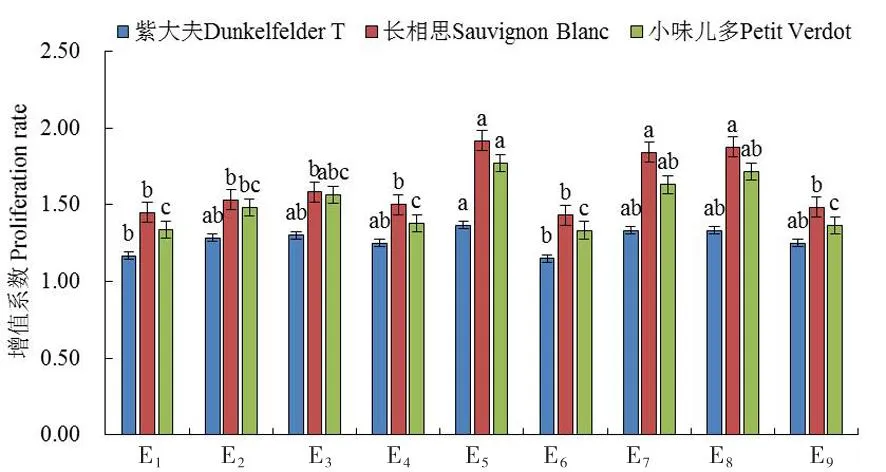
圖2 不同處理下釀酒葡萄品種 繼代培養增殖系數變化
2.4 不同處理對釀酒葡萄品種生根及質量影響
2.4.1 不同處理對釀酒葡萄品種生根的影響
研究表明,培養基種類、IBA濃度和NAA濃度對紫大夫、長相思和小味兒多組培苗的平均生根數有顯著影響(P<0.05),對紫大夫和小味兒多的生根率有顯著影響,而對長相思的生根率沒有顯著影響。9個處理的生根率在66.67%~93.33%,其中處理F5的生根率最高,為93.33%,其次是處理F7的90.00%,生根率最低的為處理F1的66.67%;長相思和小味兒多生根率最高的也均為處理F5,分別為93.33%和85.00%。小味兒多平均生根數:9個處理的平均生根數在9.11~21.67條,其中處理F5的平均生根數最多,為21.67條,其次是處理F7的21.44條,處理F8的平均生根數最少為9.11條;紫大夫和長相思的平均生根數也均為處理F5,分別為20.11條和15.83條。處理F5(1/2MS培養基,0.4 mg/L IBA,0.4 mg/L NAA)更利于提高釀酒葡萄組培苗的生根率及生根量。表6
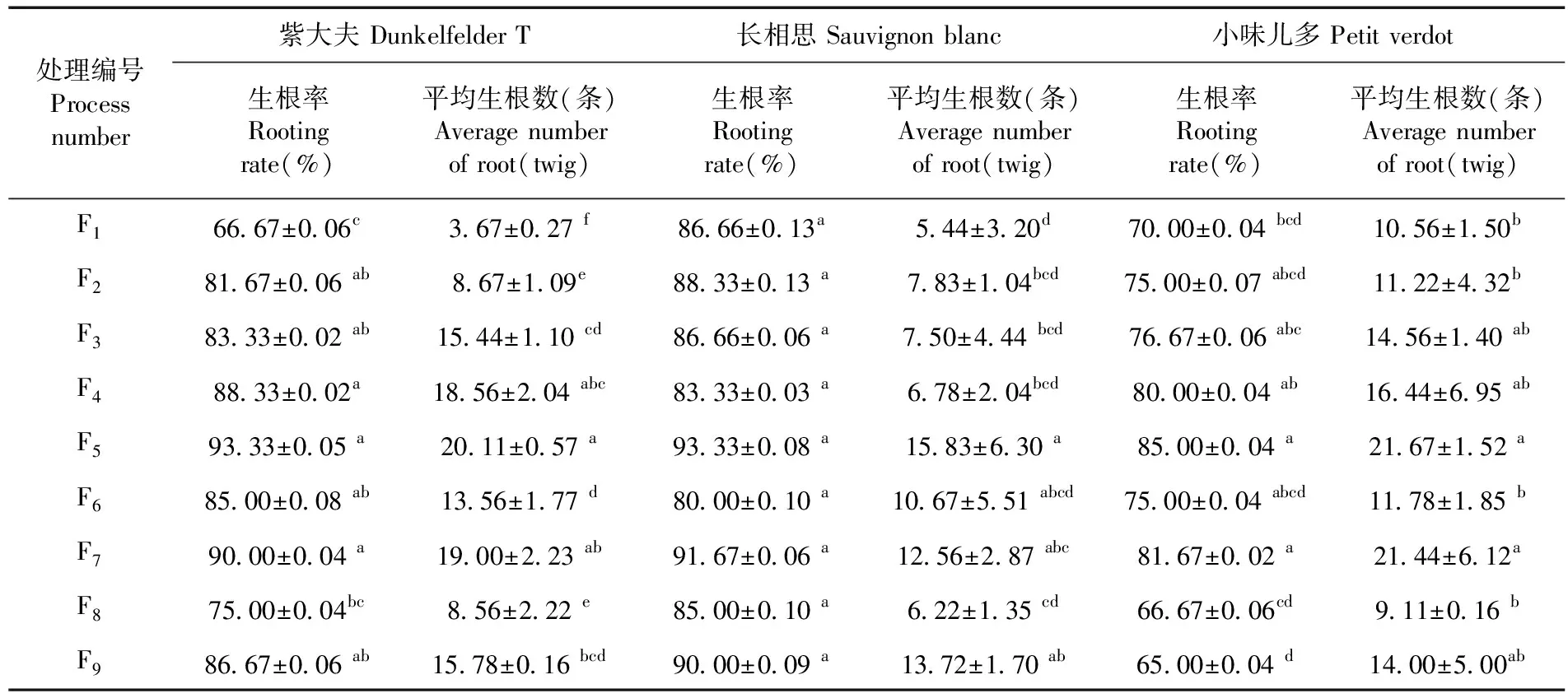
表6 不同處理下釀酒葡萄品種生根變化
2.4.2 不同處理對釀酒葡萄品種生根質量影響
研究表明,9個處理的平均根長在2.03~11.19 cm,其中處理F6的平均根長最長,與其它各處理間差異顯著,其次是處理F1,然后是處理F5;9個處理的平均根粗在0.73~1.58 mm,其中處理F2的平均根粗最大,與除處理F1之外的其它處理間差異顯著,處理F9的最小。
小味兒多生根綜合質量,9個處理的生根綜合質量在3.45~7.62,其中處理F5的生根綜合質量最大,為7.62,與其它處理間差異顯著,其次是處理F7的6.41,生根綜合質量最小的為處理F8的3.45;長相思生根綜合質量在2.62~6.34,處理F5的生根綜合質量最高,為6.34,最小的為處理F4的2.62。處理F5(1/2MS培養基,0.4 mg/L IBA,0.4 mg/L NAA)更利于提高釀酒葡萄組培苗的生根綜合質量。表7
2.5 釀酒葡萄品種熱處理及莖尖脫毒結果
研究表明,送檢的7個釀酒葡萄品種均不含葡萄卷葉病毒 1(GLRaV-1)、葡萄卷葉病毒 3(GLRaV-3)、葡萄卷葉病毒 5(GLRaV-5)、葡萄斑點病毒7(GFkV)和葡萄扇葉病毒(GFLV);但7個品種組培苗中黑比諾、桑嬌維塞、霞多麗、馬爾貝克和長相思均含有葡萄病毒 A(GVA),小味兒多和紫大夫不含葡萄病毒 A(GVA),7個釀酒葡萄品種對葡萄病毒 A的脫毒率僅為28.57%,莖尖處理結合熱處理對葡萄病毒 A的脫毒效果一般。表8
3 討 論
3.1釀酒葡萄品種紫大夫、小味兒多和長相思在寧夏賀蘭山東麓較高的適應性[17]。對葡萄組織培養的外植體消毒試劑最常見的有乙醇、氯化汞、次氯酸鈉和雙氧水[1]。胡文斌等[18]試驗結果認為70%乙醇處理30 s和0.1%氯化汞消毒8 min對紅地球葡萄的外植體消毒是最佳組合;陳玉霞等[19]認為以0.1%氯化汞消毒9 min對3個葡萄新品種的外植體消毒最佳,無菌苗獲得率為45.10%~60. 00%,試驗得出當用10%次氯酸鈉消毒7.5 min,75%乙醇消毒30 s,0.1%氯化汞消毒10 min是最佳的消毒組合,與其他研究結果略有不同,消毒試劑的不同組合及消毒時間是影響葡萄外植體成活率和減少外植體污染的關鍵。
3.2劉曉芹等[20]研究認為對葡萄砧木3309、101-14 mgt和rup的最適啟動培養基為1/2MS+0.05 mg/L 6-BA+0.2 mg/L IBA,試驗結果表明,添加1.0 mg/L 6-BA和0.05 mg/L NAA的MS培養基是培養長相思等品種的最佳啟動培養基,不同葡萄品種所需的啟動培養基具有一定特異性。其次,培養基內的營養物質直接影響葡萄組培苗的增殖及生根,植物激素作為活性物質能夠調控植物生長,在細胞分裂、組織分化及離體組織培養等方面均有重要作用[21],且一定濃度的細胞分裂素和生長素對誘導不定芽發生具有積極意義。蘇玲等[22]研究表明,MS和1/2MS培養基中加入1.0 mg/L 6-BA時外植體增值系數高,但當 6-BA的濃度增大為2.0 mg/L時外植體易出現畸形,因此在開展葡萄組培過程中要篩選適宜的培養基和激素濃度,才利于外植體的增殖,試驗結果表明添加1.0 mg/L 6-BA和0.3 mg/L IBA的1/2MS培養基是最利于長相思等品種外植體增殖的培養基。其次研究表明,一定濃度的生長素IBA能夠提高葡萄組培苗的生根效率和生根質量,林茜等[7]研究認為1/2 MS+0.4 mg/L IBA +0.2 mg/L NAA是培養陽光玫瑰葡萄的最佳培養基;馮文華等[11]認為在1/2MS培養基中添加0.2 mg/L的IBA既可以擴繁增殖又可生根壯苗;而試驗所篩選的最佳生根培養基為添加0.4 mg/L IBA和0.4 mg/L NAA的1/2MS培養基,說明不同品種所需要的內源激素濃度有一定的差異性。齊永順等[23]研究表明,在生根誘導過程中,內源激素IAA、ABA 等均可以調控根的伸長、加粗。葡萄病毒的脫毒方法包括微莖尖培養、熱處理結合莖尖培養、化學試劑結合莖尖培養和超低溫等,最常見的脫毒方法為熱處理結合莖尖培養,效果最佳的脫毒方法為超低溫結合莖尖培養,但成活率較低[1],研究以熱處理結合莖尖對7個釀酒葡萄進行了脫毒處理,結果顯示剝取莖尖1 mm,在38℃溫度下熱處理 30 d ,在選擇添加0.4 mg/LIBA 和0.2 mg/L NAA 的1/2 MS培養基中培養,能夠脫除絕大部分葡萄病毒,與張尊平等[24]的研究結果一致,認為在38℃溫度下組培苗培養30 d,對葡萄卷葉病毒1和葡萄斑點病毒等6種病毒的脫除效果較好。
4 結 論
建立了3個釀酒葡萄品種的組培快繁及脫毒技術體系。以幼嫩的腋芽為消毒試材,當用10%次氯酸鈉消毒7.5 min,75%乙醇消毒30 s,0.1%氯化汞消毒10 min能夠降低消毒后外植體的污染率,提高外植體的成活率;啟動培養基可選擇MS培養基,加入1.0 mg/L 6-BA和0.05 mg/L NAA更利于外植體萌芽,可以提高大多數釀酒葡萄品種的萌芽率;1/2MS培養基作為增殖培養基,加入1.0 mg/L 6-BA和0.3 mg/L IBA,其叢生芽增殖效果最佳,適于釀酒葡萄品種叢生芽的增殖培養;生根培養基為1/2MS培養基,加0.4 mg/L IBA和0.4 mg/L NAA,更利于提高釀酒葡萄組培苗的生根綜合質量;脫毒剝取莖尖選擇1 mm,熱處理溫度選擇38℃,熱處理 30 d,培養基為1/2 MS培養基,加0.4 mg/L IBA 和0.2 mg/L NAA,能夠脫除絕大部分葡萄病毒。整個組培繁殖脫毒體系基本適用于 3個釀酒葡萄品種的繁育及脫毒。

