補陽還五湯增強GPX4表達抑制鐵死亡減輕腦缺血再灌注損傷
蔡國英,劉均廣,葉佳蓓,單玉棟,周曉紅,高維娟*
(1.承德醫學院基礎醫學院,河北承德 067000;2.河北中醫學院)
補陽還五湯是治療缺血性腦卒中的經典名方效方[1]。腦缺血再灌注損傷(cerebral ischemia-reperfusion injury,CIRI)是缺血性腦卒中發生后通過藥物溶栓或手術取栓重新恢復血流灌注對腦組織造成的進一步損傷,其病理機制十分復雜,可能導致各種病理變化和細胞死亡[2,3]。鐵死亡是一種鐵依賴性的谷胱甘肽過氧化物酶4(glutathione peroxidase 4,GPX4)失活的細胞死亡形式[4]。GPX4是鐵死亡過程中的關鍵調節因子,研究表明,細胞GPX4的缺乏或抑制會導致脂質過氧化誘發鐵死亡,而增加GPX4水平或活性可以抑制鐵死亡[5]。GPX4成為了探索鐵死亡在各類疾病中的治療靶點[6]。本研究主要探討補陽還五湯減輕CIRI是否通過增強GPX4的表達抑制鐵死亡,以期進一步闡明補陽還五湯治療CIRI的作用機制,為臨床治療缺血性腦卒中提供依據。
1 材料與方法
1.1 實驗動物
SPF級健康雄性SD大鼠48只,7~8周齡,體質量250~280 g,購自北京維通利華實驗動物技術有限公司,合格證號為SCXK(京)2016-0011,適應性飼養一周后開始實驗。所有實驗動物均依據倫理審查委員會關于《實驗動物管理條例》的指導方針給予人道主義關懷。
1.2 實驗藥物
補陽還五湯藥物組成:黃芪120 g、當歸6 g、地龍3 g、桃仁3 g、赤芍5 g、紅花3 g、川芎3 g,購自北京同仁堂藥店。將藥物經水浸泡軟化30 min后,予以武火煮沸后文火煮,最后水煎液濃縮至100 mL,得到每1 mL補陽還五湯水煎液對應的生藥量為1.43 g。甲磺酸去鐵胺(deferoxamine,DFO)購自MedChemExpress公司,產品批號116349。
1.3 主要試劑
TTC染液、尼氏染液、兔抗β-actin抗體、FITC-羊抗鼠IgG熒光標記抗體(武漢塞維爾生物科技有限公司);鼠抗GPX4抗體、辣根過氧化物酶標記山羊抗小鼠IgG(武漢三鷹生物技術公司);辣根過氧化物酶標記山羊抗兔IgG(上海碧云天生物技術有限公司);還原型谷胱甘肽(glutathione,GSH)測定試劑盒、丙二醛(malonaldehyde,MDA)測定試劑盒、組織鐵測定試劑盒(南京建成生物技術公司)。
1.4 主要儀器
MCAO栓線(北京西濃科技有限公司);PVDF膜(Millipore);組織包埋機、輪轉切片機及顯微拍照系統(Leica);電泳系統及半干轉膜儀系統(Bio-Rad);近紅外雙色激光成像系統(LI-COR);高速低溫組織研磨儀(武漢塞維爾生物科技有限公司);冷凍高速離心機、多功能酶標儀(Thermo)。
1.5 實驗動物分組、造模及給藥
將48只健康雄性SD大鼠隨機分為4組:假手術組(Sham組)、模型組(MCAO/R組)、補陽還五湯組(BYHWD組)、陽性對照藥組(DFO組),每組12只大鼠。除Sham組外,其余各組大鼠均參照文獻[7]建立MCAO模型,缺血2 h后再灌注72 h。造模結束后BYHWD組給予補陽還五湯水煎液灌胃處理,劑量參照實驗室前期研究為14.3 g/kg/d。DFO組給予腹腔注射甲磺酸去鐵胺5 mg/kg,劑量參照相關文獻[8]。假手術組和模型組均予以等劑量生理鹽水灌胃處理。各組均為每24 h給藥1次。
1.6 Zea Longa評分評估神經功能缺損情況
大鼠清醒后根據Zea Longa評分[9],將評分為1~3分的大鼠入組,0分、4分予以剔除;評分標準:無神經功能缺損情況為0分;懸尾時對側前爪屈曲,不能完全伸展,為1分;行走時不能走直線且出現“追尾”現象,即向對側轉圈,為2分;行走時向對側傾倒為3分;無自主活動或意識喪失為4分。
1.7 TTC染色檢測腦梗死體積百分比
再灌注72 h后將大鼠麻醉并取出完整腦組織,經PBS清洗后置于模具中,-20 ℃冰凍30 min沿冠狀面其切成6個2 mm厚的腦片,避光置于TTC染液中,放入37 ℃恒溫箱中避光染色30 min,每15 min翻一次面使染色均勻。再用4%多聚甲醛固定液固定24 h,將其按順序放置,相機拍攝后用Image J軟件計算缺血側腦梗死體積占總體積百分比。
1.8 尼氏染色觀察神經元損傷情況
再灌注72 h后將大鼠麻醉并取出完整腦組織,用4%多聚甲醛固定液充分固定24 h以上,梯度乙醇脫水、透明、浸蠟、石蠟包埋,制備厚度約5 μm的石蠟切片。將石蠟切片常規脫蠟至水,進行尼氏染液染色,經梯度乙醇脫水、二甲苯透明后,中性樹膠封片,于顯微鏡下觀察并拍照。
1.9 大鼠GSH、MDA、組織鐵測定試劑盒含量檢測
將取得的血清以及組織樣本按標本處理的要求步驟進行離心、提取上清等操作,按說明書置于96孔板上樣后,分別在420 nm、532 nm及520 nm波長下用酶標儀測定檢測樣品的吸光度,根據公式計算GSH、MDA、鐵離子含量。
1.10 Western blot檢測GPX4的蛋白表達水平
將凍存腦組織稱量后冰上裂解,經勻漿、離心后BCA法測定,計算蛋白濃度。剩余上清液中加適量loading buffer變性,經SDS-PAGE電泳分離,半干轉法轉移到PVDF膜上;5%脫脂奶粉溶液室溫封閉2 h,TBST洗膜后在Ⅰ抗[GPX4抗體(1:2000)及內參照β-actin抗體(1:1000)]溶液中4 ℃孵育過夜,TBST洗膜,與相應種屬的Ⅱ抗(辣根過氧化物酶標記的IgG抗體)溶液室溫孵育2 h,TBST洗膜。ECL顯色劑避光孵育后曝光成像,使用凝膠成像系統采集圖像,用Image J軟件分析計算蛋白GPX4相對表達量。
1.11 統計學處理
采用SPSS 26.0、Image J和GraphPad Prism 8.0.1軟件對所得實驗數據進行分析。數據均采用均數±標準差()的形式表示。服從正態分布及方差齊時采用單因素方差分析,不服從分布或者方差不齊時采用非參數檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 補陽還五湯對腦缺血再灌注損傷大鼠神經功能的影響
Sham組大鼠神經功能正常,其余各組大鼠均出現不同程度神經功能缺損情況。與Sham組相比,MCAO/R組大鼠神經功能缺損明顯,神經功能學評分增高,差異有顯著性意義(P<0.01);與MCAO/R組相比,BYHWD組和DFO組大鼠神經功能缺損情況有所好轉,神經功能學評分降低,差異有顯著性意義(P<0.05),見圖1。
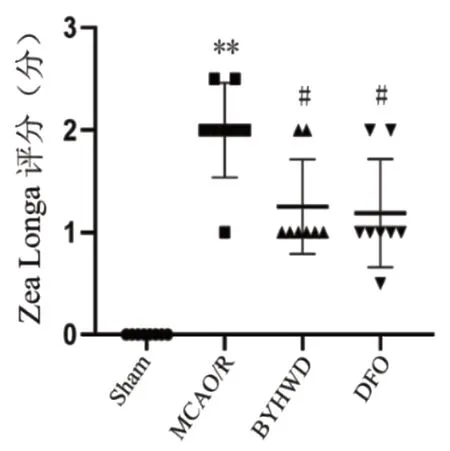
圖1 Zea Longa評分觀察各組大鼠神經功能缺損狀況(;n=8)
2.2 補陽還五湯對腦缺血再灌注損傷大鼠腦組織腦梗死體積的影響
如圖2所示,Sham組大鼠腦片均為紅色,未見白色梗死區域;與Sham組比較,MCAO/R組大鼠腦片出現大片明顯的白色梗死區域,腦梗死體積明顯增多(P<0.01);與MCAO/R組比較,BYHWD組和DFO組大鼠腦片白色梗死區域較少,腦梗死體積明顯減少(P<0.05)。

圖2 大鼠腦梗死體積(;n=3)
2.3 補陽還五湯對腦缺血再灌注損傷大鼠腦組織尼氏染色的影響
尼氏染色結果顯示,Sham組大鼠腦皮質神經細胞的形態結構均正常,可見數量較多的尼氏體,未見明顯病理改變。與Sham組相比,MCAO/R組大鼠腦皮質半暗帶區神經細胞尼氏體明顯減少,多見空泡樣改變與胞核固縮等病理改變;與MCAO/R組相比,BYHWD組和DFO組大鼠腦皮質半暗帶區神經細胞尼氏體增多,細胞損傷程度減輕。見圖3。
2.4 補陽還五湯對腦缺血再灌注損傷大鼠腦組織鐵含量和血清GSH、MDA含量的影響
與Sham組相比,MCAO/R組大鼠組織鐵含量以及血清MDA水平明顯升高,GSH水平明顯降低(P<0.01);與MCAO/R組相比,BYHWD組和DFO組大鼠組織鐵含量以及血清MDA水平明顯降低,GSH水平明顯升高(P<0.01)。見圖4。

圖4 大鼠血清中GSH含量、MDA含量以及腦組織鐵含量(;n=3)
2.5 補陽還五湯對腦缺血再灌注損傷大鼠蛋白GPX4表達的影響
Western blotting結果如圖5所示,與假手術組比較,模型組大鼠腦組織GPX4蛋白表達顯著下降(P<0.01);與模型組比較,各給藥組大鼠腦組織GPX4蛋白表達顯著上調(P<0.05)。

圖5 大鼠蛋白GPX4表達(;n=3)
3 討論
缺血性腦卒中是一類常見的神經系統疾病,致死率居于全球第二,且多數患者預后不良,是致殘的主要原因[10]。目前臨床上對缺血性腦卒中的治療方式是在一定的治療時間窗內通過藥物溶栓或手術取栓,但即便恢復再通后仍有半數左右患者因腦組織缺血再灌注損傷致死致殘,行之有效的良藥研發仍展現出巨大的未競需求[11]。中藥復方具有多靶點多途徑協同作用的效果[12]。補陽還五湯出自清代名醫王清任《醫林改錯》,是傳統的中藥復方,其通過抑制興奮性氨基酸毒性、減輕鈣超載、抑制氧自由基損傷等途徑大幅改善患者預后[13]。而補陽還五湯與CIRI在鐵死亡之間的聯系與作用機制仍需要更多的研究來進一步了解。
GPX4是一種抗氧化酶,參與細胞中脂質過氧化物轉化為無毒脂質的過程,是鐵死亡過程中的關鍵調節因子[5]。GPX4通過介導鐵死亡參與腦缺血再灌注損傷過程,而增強GPX4表達可改善腦缺血再灌注損傷造成的腦組織損傷[14]。GPX4通過清除細胞內的脂質過氧化物來保護細胞,減少氧化應激有害產物MDA的生成,降低鐵離子的氧化作用,而GSH是合成GPX4的必要底物,可以輔助GPX4發揮抗氧化功能清除有害的脂質過氧化物的作用[14,15]。GPX4與鐵死亡以及CIRI之間的聯系對于開發新的、有效的治療方法具有巨大的潛力[16]。
本實驗結果顯示,補陽還五湯能顯著降低腦缺血再灌注損傷后大鼠的神經功能缺損評分、腦梗死體積、腦組織病理損傷明顯減輕,且顯著增加CIRI后大鼠GSH、GPX4表達水平、降低MDA水平及組織鐵含量。綜上所述,補陽還五湯可能通過增強半暗帶區GPX4的表達抑制鐵死亡減輕腦缺血再灌注損傷。

