沙庫(kù)巴曲纈沙坦對(duì)慢性心力衰竭模型小鼠心功能的影響及其作用機(jī)制*
陳靜靜,吉秋霞
(南通大學(xué)附屬海安醫(yī)院,江蘇 南通 226600)
慢性心力衰竭(CHF)是心肌病、炎癥等多種原因造成的心肌損傷與心功能下降,臨床表現(xiàn)為呼吸困難、體液潴留等,屬終末期心臟疾病,嚴(yán)重影響患者的健康[1-3]。沙庫(kù)巴曲纈沙坦為復(fù)合藥物,其中纈沙坦為血管緊張素受體拮抗劑,沙庫(kù)巴曲為腦啡呔酶抑制劑,可擴(kuò)張血管,利尿,逆轉(zhuǎn)心室重構(gòu),降低心血管死亡風(fēng)險(xiǎn)[4-5]。沉默信息調(diào)節(jié)因子2 相關(guān)酶類1(Sirt1)屬酰基轉(zhuǎn)移酶家族,通過(guò)去乙酰化作用影響多種基因的表達(dá),從而調(diào)節(jié)細(xì)胞功能,與細(xì)胞的存活、抗氧化應(yīng)激、抗炎反應(yīng)等密切相關(guān)。Sirt1 通常被認(rèn)為是一種煙酰胺腺嘌呤二核苷酸前體(NAD+)依賴性去乙酰化酶,其活性受NAD+/煙酰胺腺嘌呤二核苷酸還原態(tài)(NADH)比例的調(diào)控,其調(diào)節(jié)作用涉及組蛋白、轉(zhuǎn)錄因子、代謝相關(guān)蛋白等多種底物。腺苷酸活化蛋白激酶(AMPK)是一種細(xì)胞能量感應(yīng)激酶,當(dāng)細(xì)胞感知到能量不足時(shí),AMPK 被磷酸化激活,進(jìn)而調(diào)節(jié)多種代謝途徑,以促進(jìn)細(xì)胞內(nèi)的腺嘌呤核苷三磷酸(ATP)生成,并減少ATP 消耗,以維持能量平衡。Sirt1 通過(guò)與AMPK 相互作用,可互相影響其活性[6-7]。過(guò)氧化物酶體增殖體激活受體γ 輔助激活因子-1α(PGC-1α)是AMPK 的關(guān)鍵下游因子,通過(guò)調(diào)控線粒體生物合成和氧化磷酸化等途徑,促進(jìn)心肌細(xì)胞的能量代謝,從而維持心臟的正常功能,同時(shí)可增強(qiáng)抗氧化防御系統(tǒng),在心肌細(xì)胞中提供更強(qiáng)的抗氧化保護(hù)作用,有助于應(yīng)對(duì)氧化應(yīng)激和減少氧化損傷[8]。既往研究顯示,激活Sirt1/AMPK/PGC-1α 信號(hào)通路可改善慢性心力衰竭模型大鼠的心功能[9]。目前,臨床研究主要集中于沙庫(kù)巴曲沙坦對(duì)體液調(diào)節(jié)的機(jī)制上,心肌炎癥、細(xì)胞凋亡也是CHF 的重要表現(xiàn)。故本研究中探討了沙庫(kù)巴曲纈沙坦對(duì)CHF 模型小鼠心功能的影響及其作用機(jī)制,為其防治心力衰竭提供新的理論依據(jù)和治療靶點(diǎn)。現(xiàn)報(bào)道如下。
1 材料與方法
1.1 儀器、試藥與動(dòng)物
儀器:vevo 3100 型超聲成像系統(tǒng)(云南萊博科技有限公司);V5800型熒光顯微鏡(天津微儀光學(xué)儀器有限公司);CFX Opus 96 型實(shí)時(shí)熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(PCR)儀(上海旦鼎國(guó)際貿(mào)易有限公司);iBright ?FL1500型蛋白凝膠成像系統(tǒng)(美國(guó)Thermo Fisher Scientific公司)。
試藥:沙庫(kù)巴曲纈沙坦鈉片(商品名諾欣妥,Nobartis公司,批號(hào)為J20171054,規(guī)格為每片100 mg);肌酸激酶MB 型同工酶(CK-MB)酶聯(lián)免疫吸附試驗(yàn)(ELISA)試劑盒(批號(hào)為ml037724),心肌肌鈣蛋白Ⅰ(cTnⅠ)ELISA試劑盒(批號(hào)為ml001932),白細(xì)胞介素6(IL-6)ELISA 試劑盒(批號(hào)為ml06159),腫瘤壞死因子-α(TNF-α)ELISA 試劑盒(批號(hào)為ml002095),均購(gòu)自上海酶聯(lián)生物科技有限公司;超氧化物歧化酶(SOD)試劑盒(批號(hào)為S0101S),丙二醛(MDA)試劑盒(批號(hào)為S0131S),谷胱甘肽過(guò)氧化物酶(GSH-Px)試劑盒(批號(hào)為S0056),均購(gòu)自上海碧云天生物技術(shù)有限公司;Sirt1抑制劑EX-527(批號(hào)為HY-15452),AMPK 抑制劑Compound C(批號(hào)為HY-13418A),均購(gòu)自美國(guó)Med-ChemExpress 公司;兔抗鼠胱天蛋白酶3(caspase-3,批號(hào)為ab13847),Sirt1(批號(hào)為ab110304),磷酸化AMPK(p-AMPK,批號(hào)為ab131357),AMPK(批號(hào)為ab32047),磷酸化PGC-1α(p-PGC-1α,批號(hào)為ab180235),PGC-1α(批號(hào)為ab191838),甘油醛-3-磷酸脫氫酶(GAPDH,批號(hào)為ab8245),山羊抗兔二抗(批號(hào)為ab6721),均購(gòu)自美國(guó)Abcam公司。
動(dòng)物:SPF級(jí)C57/BL6雌性小鼠62只,8周齡,購(gòu)自廣東萊迪生物醫(yī)藥研究院有限公司,動(dòng)物許可證號(hào)為SCXK(粵)2022-0064。小鼠飼養(yǎng)于指定的無(wú)病原體隔離設(shè)施中,環(huán)境溫度為22~24 ℃,相對(duì)濕度為40%~60%,12 h/12 h明暗交替,正常進(jìn)食、飲水。本研究方案經(jīng)我院動(dòng)物倫理委員會(huì)批準(zhǔn)(批件號(hào)為JSN2020-01201號(hào))。
1.2 方法
造模、分組與給藥:將62 只小鼠隨機(jī)分為對(duì)照組(13 只)和模型組(49 只)。通過(guò)主動(dòng)脈縮窄術(shù)構(gòu)建CHF模型,小鼠經(jīng)30 mg/kg戊巴比妥鈉麻醉,打開左前胸暴露心臟,游離腹主動(dòng)脈,結(jié)扎主動(dòng)脈,抽離手術(shù)針,確認(rèn)腹主動(dòng)脈暢通,復(fù)位心臟,縫合胸腔[10]。術(shù)后3 d,小鼠腹腔注射青霉素預(yù)防感染,以主動(dòng)脈弓縮窄處血液流速大于2 400 mm/s為造模成功。對(duì)照組小鼠僅開胸,不進(jìn)行縮窄操作。造模過(guò)程中,小鼠死亡12 只,其中對(duì)照組3 只,模型組9 只。將造模成功的40 只小鼠隨機(jī)分為模型組(B 組)、沙庫(kù)巴曲纈沙坦組(C 組)、沙庫(kù)巴曲纈沙坦+EX-527 組(D 組)、沙庫(kù)巴曲纈沙坦+Compound C組(E組),各10只;將10只對(duì)照組小鼠設(shè)為A組。C 組、D 組、E 組小鼠均灌胃68 mg/kg 沙庫(kù)巴曲纈沙坦[11],連續(xù)4 周;D 組、E 組小鼠除灌胃沙庫(kù)巴曲纈沙坦外,另外分別腹腔注射1 次5 mg/kg Sirt 抑制劑EX-527[12]、20 mg/kg AMPK 抑制劑Compound C[13],C組小鼠腹腔注射等量生理鹽水。A 組和B 組小鼠均分別灌胃、腹腔注射等量生理鹽水。
心臟超聲檢測(cè):末次給藥后,采用超聲成像系統(tǒng)對(duì)小鼠進(jìn)行超聲心動(dòng)圖檢測(cè),包括左室射血分?jǐn)?shù)(LVEF)、左室收縮末期內(nèi)徑(LVESd)、左室舒張末期內(nèi)徑(LVEDd),連續(xù)記錄3個(gè)心動(dòng)周期,取平均值。
血漿心肌酶、炎性因子、氧化應(yīng)激水平測(cè)定:超聲心動(dòng)圖測(cè)定結(jié)束后,麻醉小鼠,取心臟血,抗凝,離心,取血漿,凍存。按試劑盒說(shuō)明書測(cè)定CK-MB,cTnⅠ,IL-6,TNF-α,SOD,MDA,GSH-Px水平。
心肌組織病理形態(tài)觀察:各組隨機(jī)處死5 只小鼠,取心臟,用生理鹽水沖洗干凈心臟殘血,將心臟左室前壁組織固定于4%多聚甲醛中,用乙醇梯度脫水,二甲苯透明,石蠟包埋,2μm 切片,進(jìn)行蘇木精-伊紅(HE)染色,封片,觀察小鼠心肌組織病理形態(tài)。
心肌凋亡情況測(cè)定:將小鼠心肌組織包埋于石蠟,4μm切片,脫蠟至水,用蛋白酶K(不含DNA 酶)工作液處理15 min,用磷酸鹽緩沖液(PBS)漂洗,加TUNEL 反應(yīng)液,在PBS配制的3%過(guò)氧化氫溶液(溫度為37 ℃)中孵育20 min,用PBS 漂洗,加50 μL TUNEL 檢測(cè)液(紅色),37 ℃遮光孵育60 min,用PBS 漂洗,用抗熒光淬滅封片液封片,并于熒光顯微鏡下觀察,計(jì)數(shù)凋亡細(xì)胞。
心肌組織基因測(cè)定:分離各組另5只小鼠的心肌組織,一部分凍存,一部分采用TRIzol 法提取心肌組織總RNA,用無(wú)核糖核酸酶的水溶解,采用分光光度計(jì)檢測(cè)RNA 的濃度。用逆轉(zhuǎn)錄酶將mRNA 逆轉(zhuǎn)錄為cDNA,-20 ℃凍存,用SYBR Green Master Mix 進(jìn)行cDNA 擴(kuò)增,使用不同的引物特異性擴(kuò)增相應(yīng)的DNA 片段,以2-ΔΔCt表示mRNA的相對(duì)表達(dá)量。引物序列見表1。

表1 引物序列Tab.1 Primer sequence
小鼠心肌組織蛋白測(cè)定:取凍存的小鼠心肌組織,勻漿,離心,提取總蛋白并檢測(cè)蛋白濃度,進(jìn)行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE);電泳結(jié)束后,轉(zhuǎn)膜,封閉,分別加入兔抗鼠caspase-3,Sirt1,p-AMPK,AMPK,p-PGC-1α,PGC-1α,GAPDH 一抗(稀釋比GAPDH 為1∶5 000,其余均為1∶1 000),4 ℃孵育過(guò)夜,TBST洗膜,加入辣根過(guò)氧化物酶標(biāo)記的山羊抗兔二抗稀釋液(稀釋比為1∶5 000),室溫孵育1 h,TBST 洗膜。采用實(shí)時(shí)熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(qRTPCR)法和免疫印跡(Western blot)法測(cè)定小鼠caspase-3,Sirt1,AMPK,PGC-1α mRNA 和蛋白表達(dá)水平,蛋白凝膠成像系統(tǒng)成像,采用Image Pro Plus 6.0圖像軟件分析蛋白條帶灰度值。
1.3 統(tǒng)計(jì)學(xué)處理
2 結(jié)果
2.1 超聲心動(dòng)圖指標(biāo)
與A組比較,B組小鼠的LVEF水平顯著降低(P<0.05),LVEDd 和LVESd 水平均顯著升高(P<0.05);與B 組比較,C 組小鼠的LVEF 水平顯著升高(P<0.05),LVEDd和LVESd水平均顯著降低(P<0.05);與C組比較,D組、E 組小鼠的LVEF 水平均顯著降低(P<0.05),LVEDd和LVESd水平均顯著升高(P<0.05)。詳見表2。
表2 各組小鼠超聲心動(dòng)圖指標(biāo)比較(,n=10)Tab.2 Comparison of echocardiographic indicators of mice in each group(,n=10)
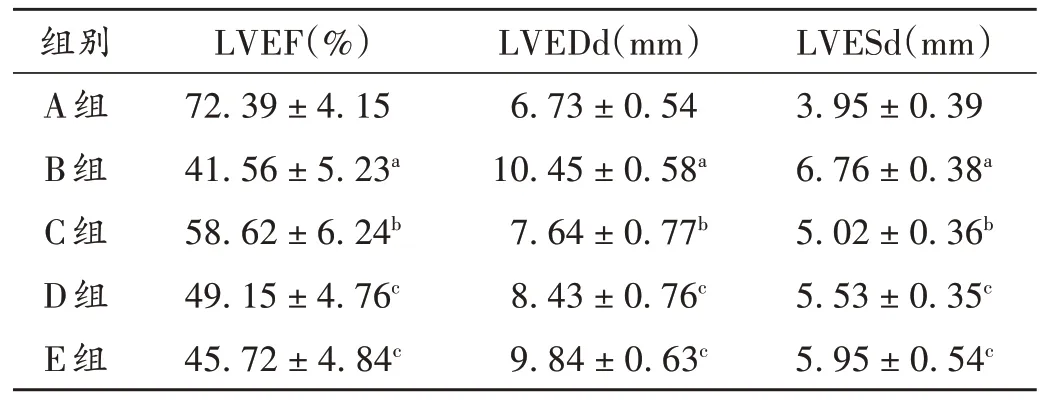
表2 各組小鼠超聲心動(dòng)圖指標(biāo)比較(,n=10)Tab.2 Comparison of echocardiographic indicators of mice in each group(,n=10)
注:與A 組比較,aP <0.05;與B 組比較,bP <0.05;與C 組比較,cP <0.05。表3至表6、圖3同。Note:Compared with those in group A,aP <0.05;Compared with those in group B,bP <0.05;Compared with those in group C,cP <0.05(for Tab.2-6,and Fig.3).
2.2 心肌酶水平
與A 組比較,B 組小鼠血漿CK-MB 和cTnⅠ水平均顯著升高(P<0.05);與B組比較,C組小鼠血漿CK-MB和cTnⅠ水平均顯著降低(P<0.05);與C組比較,D組、E組小鼠血漿CK-MB和cTnⅠ水平均顯著升高(P<0.05)。詳見表3。
表3 各組小鼠血漿心肌酶水平比較(,n=10)Tab.3 Comparison of plasma myocardial enzyme levels of mice in each group(,n=10)

表3 各組小鼠血漿心肌酶水平比較(,n=10)Tab.3 Comparison of plasma myocardial enzyme levels of mice in each group(,n=10)
2.3 炎性因子水平
與A 組比較,B 組小鼠血漿IL-6 和TNF-α 水平均顯著升高(P<0.05);與B組比較,C組小鼠血漿IL-6和TNF-α 水平均顯著降低(P<0.05);與C 組比較,D 組、E 組小鼠血漿IL-6 和TNF-α 水平均顯著升高(P<0.05)。詳見表4。
表4 各組小鼠炎性因子水平比較(,pg/mL,n=10)Tab.4 Comparison of inflammatory factor levels of mice in each group(,pg/mL,n=10)

表4 各組小鼠炎性因子水平比較(,pg/mL,n=10)Tab.4 Comparison of inflammatory factor levels of mice in each group(,pg/mL,n=10)
2.4 氧化應(yīng)激水平
與A組比較,B組小鼠MDA水平顯著升高(P<0.05),SOD 和GSH-Px 水平均顯著降低(P<0.05);與B 組比較,C 組小鼠MDA 水平顯著降低(P<0.05),SOD 和GSH-Px水平均顯著升高(P<0.05);與C組比較,D組、E組小鼠MDA水平均顯著升高(P<0.05),SOD和GSH-Px水平均顯著降低(P<0.05)。詳見表5。
表5 各組小鼠氧化應(yīng)激水平比較(,n=10)Tab.5 Comparison of oxidative stress levels of mice in each group(,n=10)
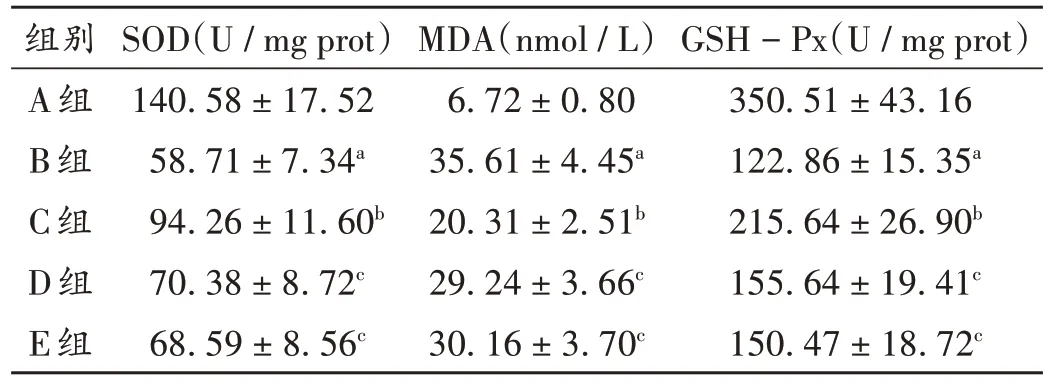
表5 各組小鼠氧化應(yīng)激水平比較(,n=10)Tab.5 Comparison of oxidative stress levels of mice in each group(,n=10)
2.5 心肌組織病理
A 組小鼠心肌結(jié)構(gòu)完整,排列整齊,未見炎性細(xì)胞浸潤(rùn);B組小鼠心肌存在局灶性壞死,肌纖維間隔變大,炎性細(xì)胞浸潤(rùn)明顯;C 組小鼠心肌細(xì)胞變性、炎性細(xì)胞浸潤(rùn)程度較B 組減輕;D 組、E 組小鼠心肌損傷程度較C組加重。詳見圖1。
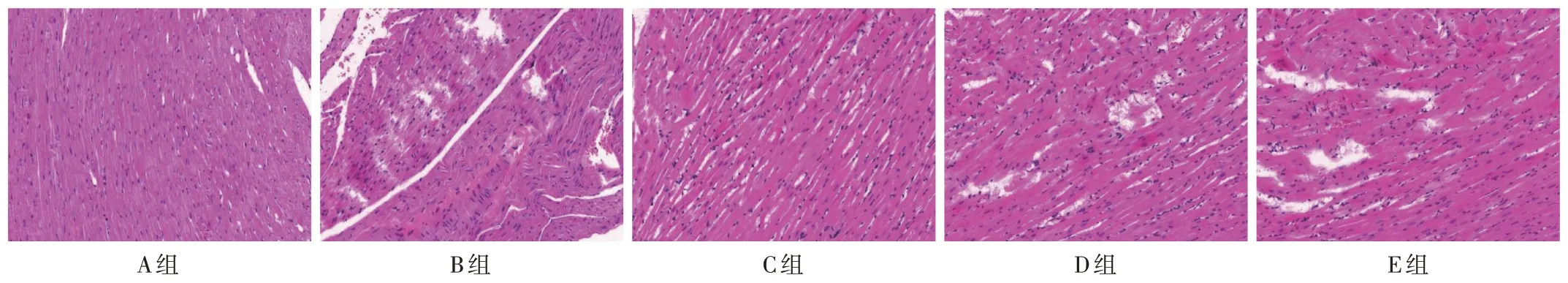
圖1 各組小鼠心肌組織病理蘇木精-伊紅染色圖(×200,n=5)Fig.1 HE images of myocardial pathology of mice in each group(×200,n=5)
2.6 心肌細(xì)胞凋亡情況
與A組比較,B組小鼠細(xì)胞凋亡率顯著升高(P<0.05);與B組比較,C組小鼠細(xì)胞凋亡率顯著降低(P<0.05);與C組比較,D組、E組小鼠心肌細(xì)胞凋亡率均顯著升高(P<0.05)。詳見表6和圖2。

圖2 各組小鼠心肌細(xì)胞凋亡情況(×200,n=5)Fig.2 Apoptosis of cardiomyocyte of mice in each group(×200,n=5)
表6 各組小鼠細(xì)胞凋亡率比較(,%,n=5)Tab.6 Comparison of apoptosis rate of mice in each group(,%,n=5)

表6 各組小鼠細(xì)胞凋亡率比較(,%,n=5)Tab.6 Comparison of apoptosis rate of mice in each group(,%,n=5)
2.7 心肌組織caspase-3,Sirt1,AMPK,PGC-1α mRNA 和蛋白表達(dá)水平
與A 組比較,B 組小鼠心肌組織caspase-3 mRNA和蛋白表達(dá)水平均顯著升高(P<0.05),Sirt1,AMPK,PGC-1α mRNA和蛋白表達(dá)水平均顯著降低(P<0.05);與B 組比較,C 組小鼠心肌組織caspase-3 mRNA 和蛋白表達(dá)水平均顯著降低(P<0.05),Sirt1,AMPK,PGC-1α mRNA和蛋白水平均顯著升高(P<0.05);與C組比較,D 組、E 組小鼠心肌組織caspase-3 mRNA 和蛋白表達(dá)水平均顯著升高(P<0.05),Sirt1,AMPK,PGC-1α mRNA 和蛋白表達(dá)水平均顯著降低(P<0.05)。詳見圖3。
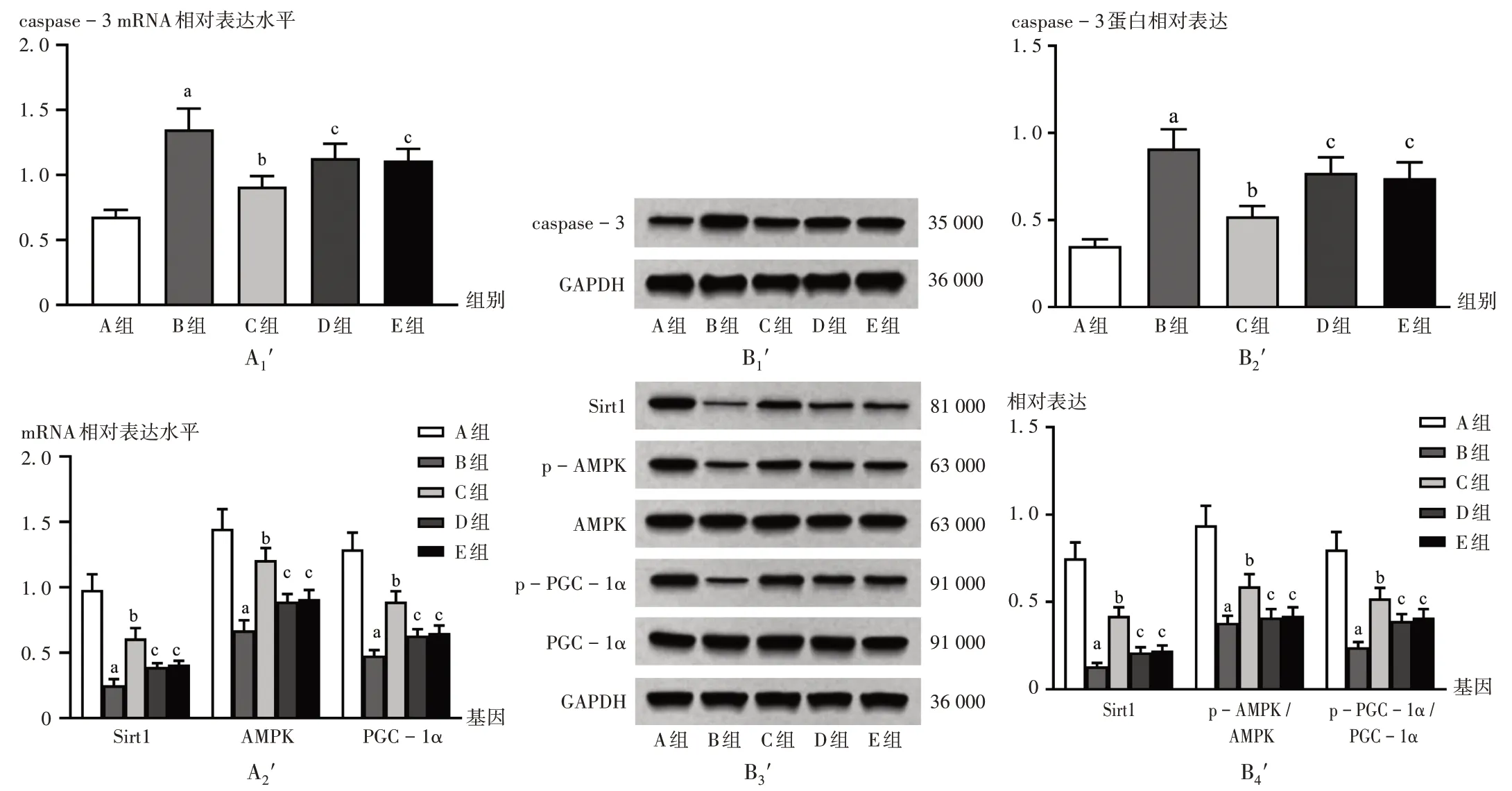
A1'-A2'.mRNA表達(dá) B1'-B4'.蛋白表達(dá)圖3 各組小鼠心肌組織caspase-3,Sirt1,AMPK,PGC-1α mRNA和蛋白表達(dá)水平比較(n=5)A1'-A2'.mRNA expression B1'-B4'.Protein expressionFig.3 Comparison of expression levels of caspase-3,Sirt1,AMPK,and PGC-1α mRNA and protein in myocardial tissue of mice in each group(n=5)
3 討論
CHF 患者心肌結(jié)構(gòu)與功能均發(fā)生改變,心臟泵血不足,無(wú)法為全身提供能量。沙庫(kù)巴曲纈沙坦可作用于腦啡肽酶、腎素-血管緊張素系統(tǒng),發(fā)揮利尿、擴(kuò)張血管、逆轉(zhuǎn)心室重構(gòu)作用。心室重構(gòu)是CHF 發(fā)生、發(fā)展的重要機(jī)制,故沙庫(kù)巴曲纈沙坦可用于治療CHF,降低患者心血管死亡的風(fēng)險(xiǎn)。目前,沙庫(kù)巴曲纈沙坦對(duì)CHF 的治療機(jī)制仍不完善,故本研究中對(duì)此展開探討。本研究中成功構(gòu)建CHF 小鼠模型,表現(xiàn)為主動(dòng)脈弓縮窄處血液流速大于2 400 mm/s。小鼠心肌組織病理HE 染色圖顯示,小鼠心肌組織存在大量壞死與炎性細(xì)胞浸潤(rùn),心肌纖維排列紊亂,細(xì)胞凋亡率升高,與既往研究[14]結(jié)果一致。經(jīng)沙庫(kù)巴曲纈沙坦治療后,小鼠心肌損傷程度減輕,心肌細(xì)胞凋亡率降低,提示沙庫(kù)巴曲纈沙坦可抑制CHF 模型小鼠心肌細(xì)胞的凋亡,保護(hù)小鼠的心肌組織,但具體機(jī)制仍有待進(jìn)一步探究。
炎性反應(yīng)在CHF 的發(fā)展中發(fā)揮重要作用。HANNA等[15]的研究結(jié)果顯示,促炎因子TNF-α 和IL-6 廣泛參與心力衰竭的發(fā)病機(jī)制,可調(diào)節(jié)心肌細(xì)胞表型與功能,抑制心肌細(xì)胞收縮,誘導(dǎo)巨噬細(xì)胞的炎癥激活。PENA等[16]的研究結(jié)果顯示,通過(guò)減輕氧化應(yīng)激與炎性反應(yīng),可消除缺氧誘導(dǎo)的右心衰竭。TNF-α和IL-6水平升高與機(jī)體免疫所誘導(dǎo)的全身炎性反應(yīng)相關(guān),本研究中經(jīng)沙庫(kù)巴曲纈沙坦治療后,C 組小鼠血漿TNF-α和IL-6水平降低,提示沙庫(kù)巴曲纈沙坦可通過(guò)調(diào)節(jié)炎性因子的分泌而減輕小鼠的炎性反應(yīng)。心力衰竭時(shí)室壁張力升高,刺激氧自由基產(chǎn)生,內(nèi)源性抗氧化物活性降低又進(jìn)一步影響氧自由基的清除,氧自由基可誘發(fā)心律失常,誘導(dǎo)心肌細(xì)胞凋亡,促進(jìn)心室重構(gòu)[17]。本研究結(jié)果顯示,沙庫(kù)巴曲纈沙坦可降低C 組小鼠血漿MDA 水平,并升高SOD 和GSH-Px 水平,提示沙庫(kù)巴曲纈沙坦可增加心肌清除氧自由基的能力,降低細(xì)胞凋亡能力,從而保護(hù)心肌組織免受損傷,但保護(hù)心肌組織的機(jī)制仍有待進(jìn)一步研究。
AMPK可被Sirt1去乙酰化激活,又可激活Sirt1,二者屬正反饋循環(huán),從而抑制炎性反應(yīng)[18]。PGC-1α屬AMPK的重要下游因子,可被AMPK直接磷酸化,在心肌損傷疾病的發(fā)生中發(fā)揮作用[19]。p-AMPK 可作用于多種下游底物,抑制ATP 的消耗,啟動(dòng)生成ATP 的途徑,維持機(jī)體能量代謝平衡,增加細(xì)胞內(nèi)NAD+含量,進(jìn)而使NAD+依賴性Sirt1耗竭[20]。干擾Sirt1/PGC-1α去乙酰化通路可增強(qiáng)氧化應(yīng)激反應(yīng),促進(jìn)線粒體功能障礙[21]。張城林等[22]的研究結(jié)果顯示,激活A(yù)MPK/PGC-1α 通路可通過(guò)促進(jìn)線粒體合成途徑,減輕心肌細(xì)胞缺氧損傷。李闖等[23]的研究結(jié)果顯示,AMPK/PGC-1α通路可反映機(jī)體氧化應(yīng)激狀態(tài),在心肌細(xì)胞線粒體生物合成與氧化應(yīng)激反應(yīng)中發(fā)揮作用。本研究結(jié)果顯示,B組小鼠的心肌組織Sirt1,AMPK,PGC-1α mRNA 和蛋白表達(dá)水平均降低,提示CHF 發(fā)病過(guò)程中Sirt1/AMPK/PGC-1α通路處于阻滯狀態(tài);經(jīng)沙庫(kù)巴曲纈沙坦灌胃后,C 組小鼠Sirt1,AMPK,PGC-1α mRNA 和蛋白表達(dá)水平均顯著升高,提示沙庫(kù)巴曲纈沙坦可能通過(guò)激活Sirt1/AMPK/PGC-1α 通路而抑制CHF 小鼠的炎性反應(yīng)、氧化應(yīng)激損傷與心肌凋亡,保護(hù)心肌組織。在沙庫(kù)巴曲纈沙坦灌胃基礎(chǔ)上添加Sirt1 或AMPK 抑制劑時(shí),保護(hù)作用減弱,進(jìn)一步驗(yàn)證了上述結(jié)論。
綜上所述,沙庫(kù)巴曲纈沙坦可能通過(guò)激活Sirt1/AMPK/PGC-1α 信號(hào)通路而影響CHF 模型小鼠的心功能,但沙庫(kù)巴曲纈沙坦影響CHF 的信號(hào)通路還有待進(jìn)一步研究。

