轉位分子蛋白和創傷后血清游離線粒體預測創傷性休克患者病情及預后的價值
徐志旺, 朱萍萍, 詹興洪, 章國榮
(寧德師范學院附屬寧德市醫院 創傷骨科, 福建 寧德, 352100)
暴力創傷引發的休克已成為臨床急救事項[1]。與普通創傷性出血相比,創傷性休克更復雜,疾病進展更快[2]。在早期階段準確評估患者創傷的嚴重程度,對于改善患者預后非常重要。線粒體跨膜電位的耗散導致線粒體內膜通過線粒體通透性轉變孔(mPTP)的開口滲透,這種現象被稱為線粒體通透性轉變,可對線粒體膜造成不可逆的結構損傷[3]。轉位分子蛋白(TSPO)是mPTP的主要組成部分之一,位于線粒體外膜,TSPO及腺嘌呤核苷酸轉位器(ANT)被認為是mPTP核心成分,因電壓依賴性陰離子通道的共免疫沉淀而受到越來越多的關注[4]。研究[5]表明TSPO在線粒體通透性轉變過程中可能起調節作用,在多種惡性腫瘤(包括乳腺癌、結腸癌、肝癌和腦癌)中表達增強。在創傷性腦損傷(TBI)中, TSPO的表達升高[6]。創傷后線粒體DNA(mtDNA)的釋放已在人類和動物模型中得到研究,在對骨折股骨髓內釘術的研究中發現了高滴度的mtDNA, 釋放的mtDNA刺激先天免疫系統,并與損傷后全身炎癥反應綜合征(SIRS)有關[7]。相關研究[8]顯示,創傷后血清游離線粒體(cf-mtDNA)含量升高。本研究探討創傷性休克患者TSPO、cf-mtDNA含量與病情及預后的關系,現報告如下。
1 資料與方法
1.1 一般資料
選取2019年1月—2022年12月在本院行急診手術的創傷性休克患者80例為創傷性休克組,其中男42例,女38例,年齡51~72歲,平均(52.78±4.67)歲。另選取同期未發生休克的一般創傷患者80例為無創傷性休克組,其中男45例,女35例,年齡48~73歲,平均(53.68±4.95)歲。根據患者的預后結局,將創傷性休克組患者再分為預后良好組56例和預后不良組24例。納入標準: ① 所有受試者均已年滿18歲,最近沒有受到創傷,也沒有接受過手術; ② 創傷性休克組患者符合創傷性休克的診斷標準[2]; ③ 無創傷性休克組患者無意識障礙,血流動力學參數正常,無休克體征; ④ 預后良好的患者入院后病情明顯改善, 30 d內可出院,未發生死亡、多器官功能障礙綜合征等不良事件; ⑤ 預后不良組患者發生死亡或多器官功能障礙綜合征等不良事件,重癥監護病房的總治療時間超過30 d。排除標準: ① 有高血壓、糖尿病等慢性病或凝血病史的受試者; ② 患有心臟和血管疾病,肝腎功能不全和輸血過程中有不良反應的患者; ③ 醫療數據不完整的患者。本研究經醫院倫理委員會批準,參與本研究的患者具有完整的臨床數據,患者或監護人簽署知情同意書。
1.2 采集血液樣本
在禁食期間,入院后即刻(T1)采用一次性采血針采集患者肘部靜脈血2 mL, 并于入院后第1(T2)、3(T3)、7(T4)天再次采集血樣。將血液在室溫下自然凝固10~20 min, 在4 ℃下以3 000×g離心20 min。待血清自然沉淀后,將上清液小心地移液到干凈的管中,并將管置于-80 ℃的冰箱中保存待測。
1.3 酶聯免疫吸附法(ELISA)測定血清中TSPO的表達水平
將標準、空白和樣品孔設置在酶板上,采用稀釋劑將標準品稀釋至1.0~2.0 μg/mL, 并用50 μL稀釋液加入每個孔,而后將40 μL樣品稀釋液加入酶板的樣品孔中,并加入10 μL樣品進行進一步測試,避免觸摸周圍的墻壁,加載完成后輕輕搖晃。將酶板用密封膜密封,并在37 ℃下保溫30 min; 揭開密封膜,將液體丟棄在孔中,并用稀釋的洗滌液洗滌每個孔5次; 除空白孔外,向每個孔中加入50 μL酶標準試劑,用密封膜密封板并保溫30 min, 然后將液體丟棄在每個孔中洗滌5次; 將50 μL顯色試劑A和50 μL顯色試劑B加入到每個孔中; 搖動后,在37 ℃的溫度下避免光污染15 min; 最后,向每個孔中加入50 μL停止溶液,空白孔值為0, 15 min內在450 nm波長下測量每個孔中的光密度(OD)值。
1.4 定量實時聚合酶鏈式反應(qPCR)測定血清中cf-mtDNA的表達水平
采用miRNA提取分離試劑盒(天根生物技術)提取血清中總RNA進行逆轉錄,而后使用Real Master Mix Probe試劑盒(天根生物技術)進行qPCR檢測。反應系統和循環條件: 8 μL 2.5×Real Master Mix, 正向引物和反向引物各1 μL(5 pmol/L, 由Thermo Fisher Scientific設計), 1 μL 20×Probe Enhancer溶液, 1 μL模板和7 μL ddH2O; 94 ℃下2 min, 94 ℃下20 s, 60 ℃下30 s, 68 ℃下1 min, 共43個循環。cf-mtDNA的表達水平采用2-△△Ct分析,U6作為內參。
1.5 統計學分析
2 結 果
2.1 創傷性休克組與無創傷性休克組患者的人口統計學資料和臨床特征比較
創傷性休克組因交通事故造成創傷48例,跌倒受傷19例,銳傷10例,其他因素造成創傷3例; 創傷時間30 s~1.2 h, 平均(1.17±0.16) h。無創傷性休克組發生交通意外46例,跌倒受傷18例,銳傷9例,其他7例; 創傷時間50 s~1.3 h, 平均(1.12±0.21) h。2組患者一般資料比較,差異無統計學意義(P>0.05), 見表1。
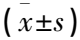
表1 2組患者人口統計學資料和臨床特征比較
2.2 創傷性休克組與無創傷性休克組患者血清TSPO和cf-mtDNA比較
與無創傷性休克組患者比較,創傷性休克組患者T1~T4的血清TSPO較高, T2~T3的血清cf-mtDNA較高,差異均有統計學意義(P<0.05), 見表2。
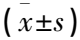
表2 創傷性休克組與無創傷性休克組患者血清TSPO和cf-mtDNA比較
2.3 預后不良組與預后良好組血清TSPO和cf-mtDNA比較
與預后良好組患者比較,預后不良組T1~T4的血清TSPO、cf-mtDNA較高,差異有統計學意義(P<0.05), 見表3。
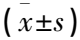
表3 預后不良組與預后良好組血清TSPO和cf-mtDNA比較
2.4 TSPO、cf-mtDNA表達預測創傷性休克患者預后的價值
以創傷性休克患者預后作為狀態變量進行ROC曲線分析,結果顯示,預后不良組T1~T4的TSPO預測預后的AUC依次為0.825、0.829、0.695和0.869, 預后不良組T1~T4的cf-mtDNA預測預后的AUC為0.766、0.766、0.837和0.783, 差異均有統計學意義(P<0.001), 見表4、圖1。

圖1 TSPO、cf-mtDNA表達預測創傷性休克患者預后的ROC曲線

表4 TSPO、cf-mtDNA表達預測創傷性休克患者預后的價值
3 討 論
創傷引起的急性應激狀態和SIRS可導致重要器官的不可逆損傷,這已成為創傷性休克患者死亡的主要原因[9-10]。嚴重創傷造成的失血導致炎癥因子釋放和毛細血管通透性升高,這可能導致腎臟等重要器官缺血和缺氧,從而造成嚴重損害,這也是導致骨折創傷性休克患者死亡的基本機制[11-12]。
創傷性休克是一種常見的急癥,進展迅速,機體遭受暴力后血液的有效循環會急劇下降,這可導致微循環灌注不足綜合征。若不及時治療,可導致SIRS或多器官功能障礙綜合征,進一步導致多個器官或系統衰竭,患者可在10 min內死亡[13]。在mPTP調制器的頻譜范圍內,TSPO引起了越來越多的關注, TSPO被認為是創傷性腦損傷的敏感標志物,已成為線粒體通透性轉變的高度可能的調節劑,能夠在暴露于各種惡性細胞培養物中促進細胞死亡,而采用Ro5-4864(一種獨特的TSPO配體)治療可提高不同腦損傷模型的細胞存活率[14]。此外,相關研究[15]顯示TSPO在健康人腦中以低水平表達,并響應腦損傷和炎癥而顯著上調。本研究結果表明,創傷性休克組T1~T4的血清TSPO較高,預后不良組TSPO高于預后良好組,這可能反映了體內炎癥的活動,表明TSPO是由損傷釋放的。
相關研究[16]表明創傷后循環釋放的mtDNA是無菌炎癥的致病事件, mtDNA在細胞外和細胞質中的釋放是由各種刺激引起的,包括應激、創傷、病原體和活性氧簇(ROS)。研究[17]表明cf-mtDNA在NLRP3炎性小體活化過程中起著關鍵和特異性的作用。本研究結果顯示,創傷性休克組T2~T3的血清cf-mtDNA較高,創傷患者在初始創傷性組織損傷后1、3 d的cf-mtDNA水平升高,第7天逐漸恢復; 此外,創傷性休克患者中,預后不良者血漿cf-mtDNA濃度增加,這表明cf-mtDNA是由損傷釋放的。
對于創傷性休克患者而言,可以通過觀察TSPO及cf-mtDNA的變化來客觀地評估患者的病情。本研究結果顯示,創傷性休克患者中,預后不良者TSPO及cf-mtDNA水平升高。本研究應用ROC曲線分析T1~T4的TSPO及cf-mtDNA的表達,發現第7天TSPO水平評估預后的價值最高,AUC為0.869, 而第3天的cf-mtDNA水平評估預后價值最高,AUC為0.837。這表明TSPO及cf-mtDNA對創傷性休克患者預后具有一定的預測價值,可以作為評估創傷性休克患者嚴重程度的相關指標。
綜上所述,創傷性休克患者TSPO及cf-mtDNA水平升高,其中預后不良者TSPO及cf-mtDNA水平升高更為顯著,而第7天的TSPO水平以及第3天的cf-mtDNA水平評估預后價值最高。

