鐵超載調控氧化性低密度脂蛋白誘導泡沫細胞促動脈粥樣硬化活化的作用
王曉燕 鄒小義 祝翔 王婷 強葉濤 周思源 張鵬 張平
1南京醫科大學附屬常州第二人民醫院檢驗科(江蘇常州 213000);2德安醫院康復科(江蘇常州 213000);3江蘇省人民醫院檢驗科(南京 210029);4揚中市人民醫院檢驗科(江蘇鎮江 212200)
動脈粥樣硬化(AS)是心血管病最常見的動脈壁異常綜合征。巨噬細胞和平滑肌細胞的泡沫化是AS 病理過程中的標志。研究表明鐵代謝異常亦是AS 的危險因素之一,鐵代謝紊亂所致的胞內鐵超載可通過Fenton 反應[1]產生ROS,加重體內低密度脂蛋白的氧化[2],而脂質過氧化又是AS 形成的關鍵。已有研究證實鐵離子對大多數細胞均可造成氧化應激損傷,如腦組織中鐵含量的升高會加速腦內皮細胞的衰老,引起阿爾茨海默病等神經系統疾病[3],軟骨細胞的鐵超載會增加膝關節炎的發病率[4]等。鐵超載引起的內皮功能障礙[5-6]及促炎巨噬細胞生成[7]增加了AS 的發病率,但鐵超載對泡沫細胞的作用還尚不清楚,其是否促進泡沫細胞向促AS 表型轉化,還鮮有報道。因此,本研究建立泡沫細胞模型,旨在觀察鐵超載對促進泡沫細胞向促AS 表型轉化的影響,探討其在AS 活化中的作用。
1 材料與方法
1.1 材料MOVAS 細胞株購于中科院上海細胞研究所;氧化性低密度脂蛋白(oxLDL),去鐵胺,普魯士藍染色試劑盒,油紅O 染色試劑盒購于北京索萊寶科技有限公司;檸檬酸鐵銨,購自北京伊塔生物科技有限公司。檸檬酸鐵銨購于美國Sigma 公司,ROS 檢測試劑盒購于Beyotime 公司,MDA 和GSH 檢測試劑盒購自南京建成生物工程研究所,GPX4 檢測試劑盒購自酶免上海瑞番生物科技有限公司,CCK-8 購自美國MCE 公司;Trizol試劑購于Invitrogen 公司。
1.2 方法
1.2.1 細胞培養MOVAS 細胞分為media 組、ox-LDL組、oxLDL + FC組、oxLDL + FC + DFO組。配制50 mmol DFO 和200 mmol FC 母液用于后續研究。細胞擴增培養,調至濃度為5 × 104個細胞/mL,接種于96孔板中,每孔加100 μL培養液,37℃ 5% CO2培養箱培養。待細胞60%粘連后,去掉完全培養液,加入基礎培養液100 mL,饑餓培養12 h。按組分別加入含鐵元素200 μmol的FC和100 μmol DFO,孵育1 h。加入50 μg/mL 的oxLDL 刺激細胞24 h 后檢測。
1.2.2 CCK-8 檢測每孔加入15 μL 的CCK-8,37 ℃,5% CO2培養箱內避光孵育3 h。酶標儀450 nm 波長測OD值,分析細胞增殖情況。
1.2.3 ROS 檢測每孔按1∶1 000 比例加入DHE探針,37℃,5% CO2培養箱內避光孵育30 min。熒光顯微鏡下觀察拍照。
1.2.4 ELISA 檢測每孔加入樣本,酶標抗體后孵育,洗滌后加底物顯色,酶標儀讀取吸光度,計算蛋白含量。
1.2.5 RT-qPCR 檢測收集標本,加入Trizol。利用氯仿、異丙醇、乙醇提取總RNA,逆轉錄成cDNA,用于擴增。結果采用2-△△CT法分析目的基因在各組之間的表達。各靶基因引物序列見表1。

表1 引物序列表Tab.1 Primer sequence
1.2.6 普魯士藍染色細胞種植鋪板,PBS 洗滌后4%多聚甲醛固定,蒸餾水洗滌,加入普魯士藍染液,蒸餾水洗滌后顯微鏡下拍照。圖中藍綠色代表鐵沉積。
1.2.7 油紅O 染色細胞種植鋪板,PBS 洗滌后油紅O 固定25 min 棄去,蒸餾水洗滌,60%異丙醇30 s 后棄去,油紅O 染料浸染20 min 棄去,60%異丙醇分化至無背景色,水洗,蘇木精復染2 min,油紅O 緩沖液孵育1 min 棄去。加蒸餾水覆蓋細胞并在倒置顯微鏡下拍攝照片以觀察細胞泡沫化的程度。圖中紅色代表泡沫細胞。
1.2.8 統計學方法數據采用SPSS 19.0 統計分析,以均數±標準差表示。組間比較采用t檢驗,以P< 0.05 為差異有統計學意義。
2 結果
2.1 鐵超載模型的建立oxLDL + FC 組中的兩種細胞均觀察到明顯的藍綠色鐵沉積。DFO 處理后,oxLDL + FC + DFO 組的藍綠色鐵沉積顯著減輕(圖1)。

圖1 RAW264.7 和MOVAS 細胞普魯士藍染色(標尺=100 μm)Fig.1 RAW264.7 and MOVAS cell iron deposition by Prussian Blue staining (scale=100 μm)
2.2 鐵超載參與oxLDL 誘導的泡沫細胞的生成與oxLDL 組比較,oxLDL+FC 組呈現更明顯的紅色(圖2),且負責膽固醇流出的主要分子ATP結合盒轉運體A1(ABCA1)和ATP 結合盒轉運體G1(ABCG1)mRNA 表達降低(P< 0.05),見表2-3。DFO 預處理后,與oxLDL+FC 組比較,oxLDL+FC+DFO組紅色顯著減少(圖2)。并且,ABCA1和ABCG1 mRNA 表達顯著增加(P< 0.05),見表2-3。
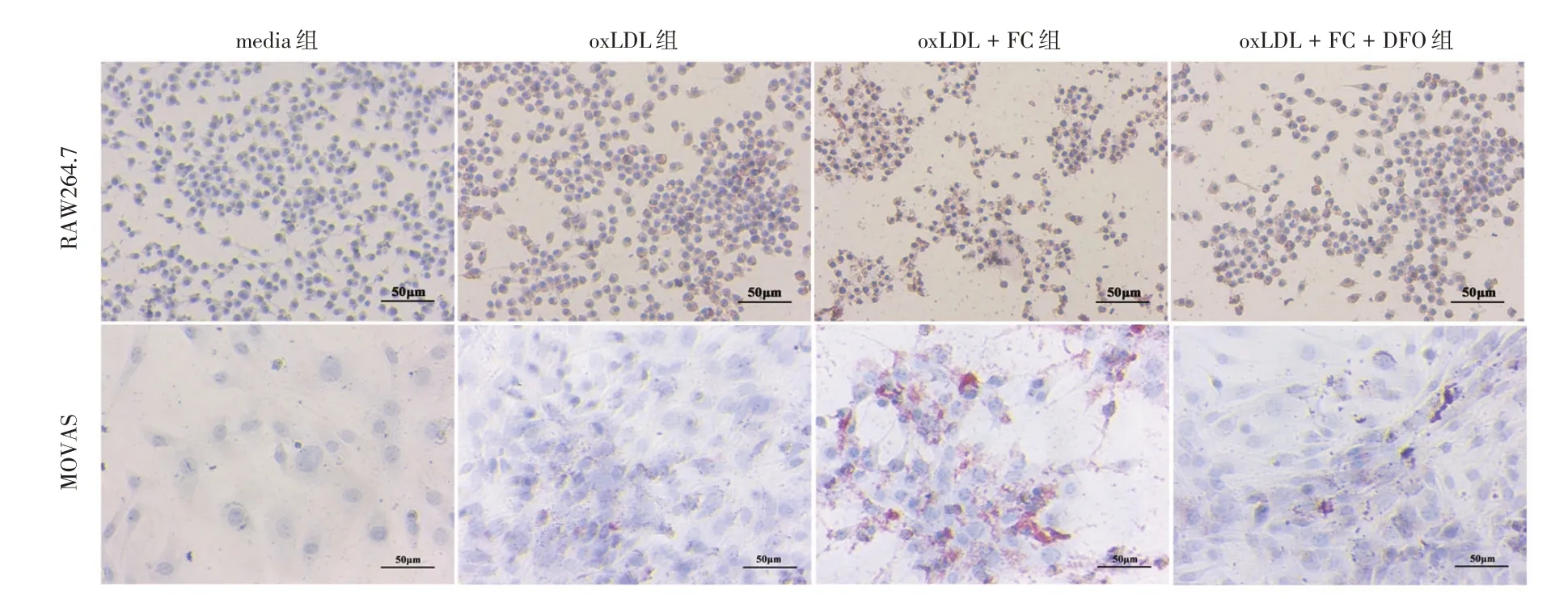
圖2 RAW264.7 和MOVAS 細胞油紅O 染色(標尺=50 μm)Fig.2 RAW264.7 and MOVAS cell were stained with Oil Red O (scale=50 μm)
表2 RAW264.7 和MOVAS 細胞的ABCA1 mRNA 水平Tab.2 The mRNA expression of ABCA1 in RAW264.7 and MOVAS cells ±s

表2 RAW264.7 和MOVAS 細胞的ABCA1 mRNA 水平Tab.2 The mRNA expression of ABCA1 in RAW264.7 and MOVAS cells ±s
注:與oxLDL + FC組比較,*P < 0.05
組別media組oxLDL組oxLDL+FC組oxLDL+FC+DFO組RAW264.7 1.000 ± 0.014 0.809 ± 0.036*0.721 ± 0.033 1.835 ± 0.120*MOVAS 1.002 ± 0.084 0.082 ± 0.078*0.602 ± 0.061 1.673 ± 0.123*
表3 RAW264.7 和MOVAS 細胞的ABCG1 mRNA 水平Tab.3 The mRNA expression of ABCG1 in RAW264.7 and MOVAS cells ±s

表3 RAW264.7 和MOVAS 細胞的ABCG1 mRNA 水平Tab.3 The mRNA expression of ABCG1 in RAW264.7 and MOVAS cells ±s
注:與oxLDL+FC組比較,*P < 0.05
組別media組oxLDL組oxLDL+FC組oxLDL+FC+DFO組RAW264.7 1.003 ± 0.085 0.893 ± 0.016*0.768 ± 0.061 1.537 ± 0.124*MOVAS 1.004 ± 0.112 0.679 ± 0.073 0.591 ± 0.058 1.367 ± 0.053*
2.3 鐵超載調控oxLDL 誘導的泡沫細胞脂質過氧化反應與oxLDL 組比較,oxLDL + FC 組兩種細胞來源的泡沫細胞存活率(圖3)和活性(表4)均顯著降低(P< 0.05),泡沫細胞ROS 和MDA 的含量明顯增加,GPX4 的表達明顯降低(P< 0.05),但對于GSH 含量,僅在平滑肌細胞中顯著減少,而巨噬細胞中差異無統計學意義(P> 0.05)(圖4,表5-7)。DFO 處理后,oxLDL + FC 組比較,oxLDL + FC +DFO 組的細胞存活率和活性明顯提高(P< 0.05)(圖3,表4)。同時以上所有鐵超載環境中加重的過氧化反應均有所減輕(圖4,表5-7)。

圖3 光鏡觀察RAW264.7 和MOVAS 細胞的存活情況(標尺=200 μm)Fig.3 The survival of RAW264.7 and MOVAS cell via light microscopy (scale=200 μm)
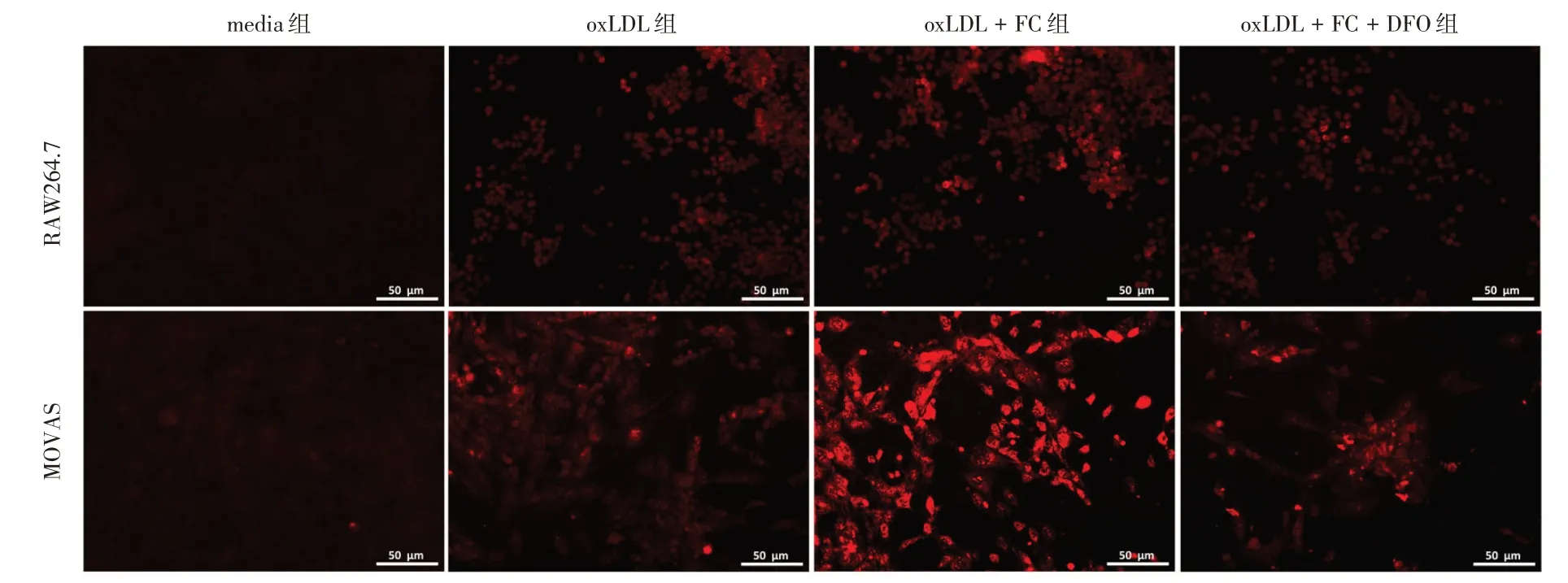
圖4 DHE 探針觀察RAW264.7 和MOVAS 細胞ROS 的生成(標尺=50 μm)Fig.4 The ROS generation of RAW264.7 and MOVAS cell by DHE probe (scale=50 μm)
表4 CCK-8 實驗檢測RAW264.7 和MOVAS 細胞活性Tab.4 The relative cells activity of RAW264.7 and MOVAS via CCK-8 assay ±s,%
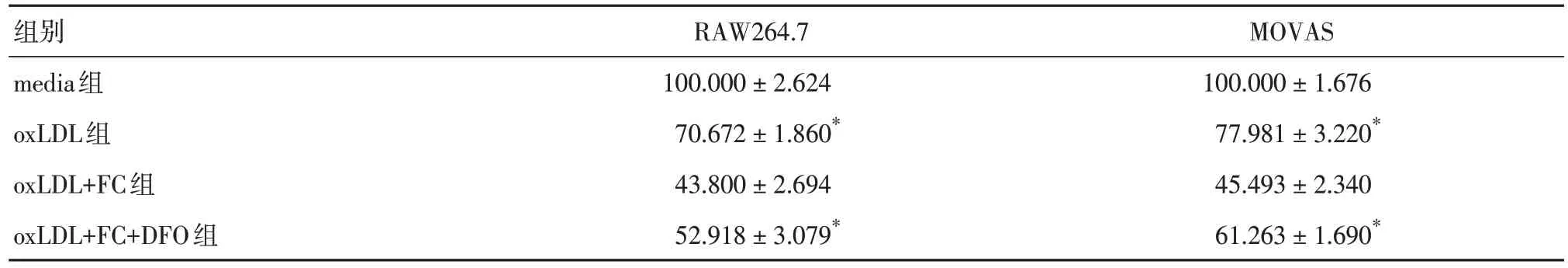
表4 CCK-8 實驗檢測RAW264.7 和MOVAS 細胞活性Tab.4 The relative cells activity of RAW264.7 and MOVAS via CCK-8 assay ±s,%
注:與oxLDL+FC組比較,*P < 0.05
組別media組oxLDL組oxLDL+FC組oxLDL+FC+DFO組RAW264.7 100.000 ± 2.624 70.672 ± 1.860*43.800 ± 2.694 52.918 ± 3.079*MOVAS 100.000 ± 1.676 77.981 ± 3.220*45.493 ± 2.340 61.263 ± 1.690*
表5 RAW264.7 和MOVAS 細胞的MDA 水平Tab.5 The content of MDA in RAW264.7 and MOVAS cells ±s,nmol/mL

表5 RAW264.7 和MOVAS 細胞的MDA 水平Tab.5 The content of MDA in RAW264.7 and MOVAS cells ±s,nmol/mL
注:與oxLDL+FC組比較,*P < 0.05
組別media oxLDL組oxLDL+FC組oxLDL+FC+DFO組MOVAS 1.267 ± 0.123 1.892 ± 0.219*2.464 ± 0.244 1.873 ± 0.224*RAW264.7 0.766 ± 0.078 1.316 ± 0.088*2.386 ± 0.140 1.665 ± 0.096*
表6 RAW264.7 和MOVAS 細胞的GPX4 含量Tab.6 The content of GPX4 in RAW264.7 and MOVAS cells ±s,pg/mL

表6 RAW264.7 和MOVAS 細胞的GPX4 含量Tab.6 The content of GPX4 in RAW264.7 and MOVAS cells ±s,pg/mL
注:與oxLDL+FC組比較,*P < 0.05
組別media oxLDL組oxLDL+FC組oxLDL+FC+DFO組MOVAS 337.801 ± 28.104 347.435 ± 38.656*240.760 ± 17.360 284.464 ± 18.562*RAW264.7 316.075 ± 11.402 281.403 ± 31.398*205.787 ± 28.654 285.066 ± 32.690*
表7 RAW264.7 和MOVAS 細胞的GSH 含量Tab.7 The content of GSH in RAW264.7 and MOVAS cells ±s,μmol/gprot

表7 RAW264.7 和MOVAS 細胞的GSH 含量Tab.7 The content of GSH in RAW264.7 and MOVAS cells ±s,μmol/gprot
注:與oxLDL+FC組比較,*P < 0.05
組別media組oxLDL組oxLDL+FC組oxLDL+FC+DFO組MOVAS 31.267 3 ± 4.244 8 21.390 4 ± 0.339 2 22.878 9 ± 2.046 6 28.734 3 ± 0.968 3*RAW264.7 40.897 5 ± 3.602 1 21.497 3 ± 4.610 4 23.643 7 ± 2.657 7 32.180 1 ± 1.544 8*
2.4 鐵超載參與oxLDL誘導的泡沫細胞促動脈粥樣硬化表型的轉化與oxLDL 組比較,oxLDL+FC組巨噬細胞促炎M1 型標志物iNOS 和平滑肌細胞合成型標記物OPN顯著增加,平滑肌細胞收縮型標志物α-SMA、平滑肌肌球蛋白重鏈11(MYH11)明顯下降(P< 0.05),而平滑肌收縮型標志物SM22a和抗炎M2 型標志物Arg-1 mRNA 無明顯變化(P>0.05)。DFO 處理后,與oxLDL + FC 組相比,Arg-1、α-SMA、MYH11 和SM22a 均顯著增加,iNOS 和OPN顯著降低(P< 0.05)。見表8-9。
表8 RAW264.7 細胞的iNOS 和Arg-1 mRNA 水平Tab.8 The mRNA expression of iNOS and Arg-1 in RAW264.7 cells ±s
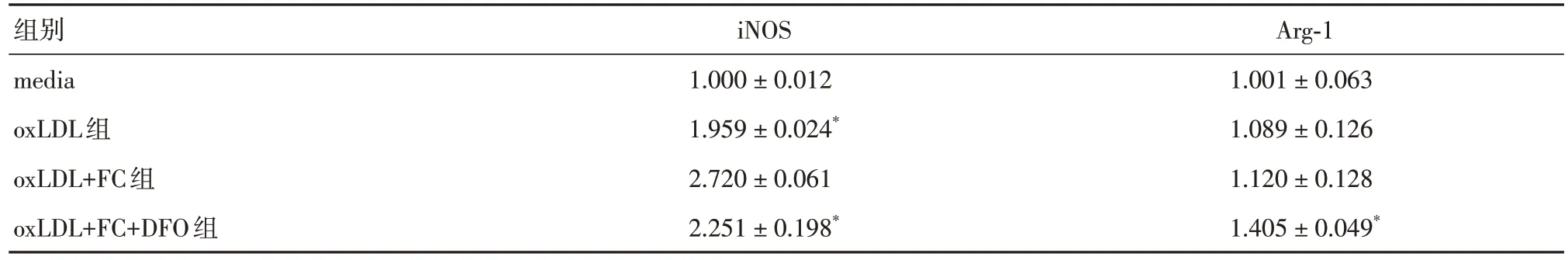
表8 RAW264.7 細胞的iNOS 和Arg-1 mRNA 水平Tab.8 The mRNA expression of iNOS and Arg-1 in RAW264.7 cells ±s
注:與oxLDL+FC組比較,*P < 0.05
組別media oxLDL組oxLDL+FC組oxLDL+FC+DFO組iNOS 1.000 ± 0.012 1.959 ± 0.024*2.720 ± 0.061 2.251 ± 0.198*Arg-1 1.001 ± 0.063 1.089 ± 0.126 1.120 ± 0.128 1.405 ± 0.049*
表9 MOVAS 細胞的α-SMA、SM22a、MYH11、OPN mRNA 水平Tab.9 The mRNA expression of α-SMA、SM22a、MYH11 and OPN in MOVAS cells ±s

表9 MOVAS 細胞的α-SMA、SM22a、MYH11、OPN mRNA 水平Tab.9 The mRNA expression of α-SMA、SM22a、MYH11 and OPN in MOVAS cells ±s
注:與oxLDL+FC組相比,*P < 0.05
組別media組oxLDL組oxLDL+FC組oxLDL+FC+DFO組OPN 1.001 ± 0.067 1.148 ± 0.091*2.271 ± 0.033 1.428 ± 0.123*α-SMA 1.001 ± 0.053 0.594 ± 0.037*0.392 ± 0.024 0.770 ± 0.014*SM22a 1.002 ± 0.083 0.786 ± 0.117 0.602 ± 0.073 0.971 ± 0.127*MYH11 1.001 ± 0.063 0.682 ± 0.029*0.411 ± 0.021 0.653 ± 0.032*
2.5 鐵超載加重oxLDL 誘導的泡沫細胞炎癥反應與oxLDL 組比較,鐵超載環境加強了TNF-α、IL-1β mRNA 的表達(P< 0.05),而DFO 處理后,TNF-α、IL-1β 的mRNA 表達較oxLDL+FC 組顯著降低(P< 0.05)。見表10-11。
表10 RT-qPCR 檢測RAW264.7 和MOVAS 細胞的TNF-α mRNA 水平Tab.10 The mRNA expression of TNF-α in RAW264.7 and MOVAS cells ±s

表10 RT-qPCR 檢測RAW264.7 和MOVAS 細胞的TNF-α mRNA 水平Tab.10 The mRNA expression of TNF-α in RAW264.7 and MOVAS cells ±s
組別media組oxLDL組oxLDL+FC組oxLDL+FC+DFO組RAW264.7 1.005 ± 0.120 1.610 ± 0.203*3.315 ± 0.223 1.601 ± 0.252*MOVAS 1.008 ± 0.157 2.517 ± 0.329*5.417 ± 0.183 3.803 ± 0.326*
表11 RAW264.7 和MOVAS 細胞的IL-1β mRNA 水平Tab.11 The mRNA expression of IL-1β in RAW264.7 and MOVAS cells ±s
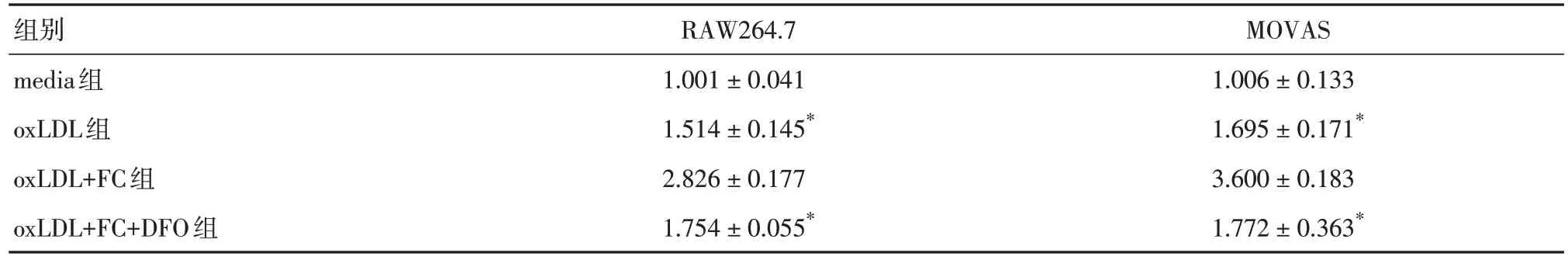
表11 RAW264.7 和MOVAS 細胞的IL-1β mRNA 水平Tab.11 The mRNA expression of IL-1β in RAW264.7 and MOVAS cells ±s
注:與oxLDL+FC組比較,*P < 0.05
組別media組oxLDL組oxLDL+FC組oxLDL+FC+DFO組RAW264.7 1.001 ± 0.041 1.514 ± 0.145*2.826 ± 0.177 1.754 ± 0.055*MOVAS 1.006 ± 0.133 1.695 ± 0.171*3.600 ± 0.183 1.772 ± 0.363*
3 討論
本研究選用RAW264.7 和MOVAS 細胞株建立AS 泡沫細胞模型,觀察鐵超載與泡沫細胞促AS活化的關系。結果發現鐵超載促進巨噬細胞和平滑肌細胞吸收oxLDL 向泡沫細胞轉化,且膽固醇逆向轉運分子ABCA1 和ABCG1 mRNA 水平顯著下降。這意味著鐵超載促進胞內膽固醇沉積可能由ABCA1 和ABCG1 表達降低所致。進一步研究發現,鐵超載實驗組細胞死亡率顯著升高,ROS 和MDA 含量增加,表明過量鐵對細胞產生明顯毒性,加重細胞過氧化損傷。眾所周知,GPX4 作為保護生物膜不受氫過氧化損傷的GPX 分子,通過消耗細胞內GSH 抑制磷脂和膽固醇的氫過氧化反應[8]。本實驗中,鐵超載引起GPX4 顯著降低,導致ROS 的積累,促進細胞脂質過氧化,但巨噬細胞GSH 含量與oxLDL 組相比卻沒有明顯變化,推測對于巨噬細胞,鐵超載可能通過其他方式影響GPX4,而不是耗竭GSH。但在DFO 治療后,GPX4和GSH 含量均顯著上升,表明去除過量鐵即可恢復細胞抗氧化能力。
巨噬細胞和平滑肌細胞是AS 發病過程中的重要參與細胞,其功能會隨著病情的進展發生改變并相互作用,如巨噬細胞極化與平滑肌細胞表型轉化[9-11]。在AS 病程中,由于機體微環境改變,促使巨噬細胞極化為促炎M1 型和抗炎M2 型并參與鐵代謝,M1 型分泌促炎因子促使晚期斑塊破裂并表達高水平的鐵儲存蛋白和低水平的運鐵素(FPN)來維持胞內鐵超載狀態,反之,M2 型分泌抑炎因子在AS 初期穩定斑塊并表達低水平的鐵儲存蛋白和高水平的FPN 以利于鐵外流[12-13]。在斑塊初期血管中平滑肌細胞以增殖為主,促進纖維帽生成以穩定斑塊[11]。隨著斑塊進展,平滑肌細胞出現異常轉化,由收縮型向合成型轉換,下調原有的收縮型標志物α-SMA、MYH11 和SM22a 等,上調骨橋蛋白(OPN)等合成型標志物,甚至向巨噬細胞樣轉變[14-15],致使正常表型的平滑肌細胞數量減少,最終導致纖維帽變薄,斑塊破裂[11]。本實驗證實了鐵超載能夠促使促炎M1 型巨噬細胞和收縮型平滑肌細胞的生成,并釋放炎癥因子(TNF-α、IL-1β)。所有這些變化在DFO 處理后均出現逆轉。
此外,研究[16-18]表明GPX4 活性降低,則對鐵死亡現象更敏感,其失活是導致脂質過氧化物積累的原因。鐵死亡是一種以脂質過氧化積累為特征的鐵依賴性細胞凋亡,是以GSH 消耗,抗氧化體系GPX4 失活,ROS 大量生成為特征的炎癥反應[18-19]。雖然本實驗中,鐵超載組部分數據支持了鐵死亡現象,但遺憾的是,DFO 卻不是鐵死亡的特異性阻斷劑,我們未能從反面驗證鐵死亡的存在。即便如此,我們依然看到了DFO 具有一定的抗AS 作用,這與BAI 等[20]利用DFO 部分抑制oxLDL 誘導的小鼠主動脈內皮細胞鐵死亡的現象相符。
綜上所述,本研究證實外源性鐵超載促進oxLDL 誘導的巨噬細胞和平滑肌細胞源性泡沫細胞的生成,加重脂質過氧化和炎癥反應,促使細胞向促動脈粥樣硬化表型轉化。但鐵超載在AS中的機制研究目前還處在初步階段,與鐵死亡究竟是何關系,是否激活鐵死亡途徑且如何發揮作用,還需深入研究。我們相信通過對泡沫細胞中鐵代謝的深入研究,將為AS 的預防和治療找到新的方案。

