表沒食子兒茶素沒食子酸酯靶向調控Nrf2-Keap1信號通路與腦梗死神經保護作用的關系
肖湘芝 陳管雄 胡智文
長沙市第四醫院(湖南師范大學附屬長沙醫院)急診科(長沙 410000)
出血性轉化(hemorrhagic transformation,HT)是急性缺血性卒中(ischemic stroke, IS)最具破壞性的并發癥之一,其特征是腦血管破裂和實質內出血[1]。IS 后24 h 內HT 的發生率為15.20%,在整個IS 期間達到30.15%,導致預后不良[2]。然而,臨床上尚無治療HT 的有效藥物。研究[3]發現,高血糖是IS 患者的常見危險因素,大約40%的IS 患者患有糖尿病和高血糖。腦卒中發病后24 h 內血糖高于7 mmol 與腦損傷加重和病死率增加相關,嚴重影響腦卒中的臨床治療[4]。因此,研究高血糖引起HT 的機制,尋找新的靶點和治療藥物,對于改善腦卒中的治療和預后具有重要意義。表沒食子兒茶素沒食子酸酯(epigallocatechin-3-gallate,EGCG)是綠茶的主要生物活性成分,目前已證實其對大部分中樞神經系統疾病發揮潛在的治療作用,如阿爾茨海默病、朊病毒病、外傷性腦損傷和腦缺血[5-6]。研究[7-8]證實,EGCG 是一種多靶點藥物,因為它與細胞內區室(如線粒體、溶酶體和細胞核)相互作用以介導多種生物作用。然而,EGCG 對高血糖誘導HT 的保護作用尚不清楚。因此,本研究采用急性高血糖聯合電凝腦缺血模型評價EGCG 對HT 的保護作用。同時采用網絡藥理學預測與HT 發生相關的潛在靶點和通路,并進一步通過實驗驗證EGCG 在高血糖誘導HT 中的作用機制。
1 材料與方法
1.1 動物體質量240 ~ 260 g 的雄性SD 大鼠購自北京維通利華實驗動物技術有限公司[許可證號 SCXK(京)2018-0006]。研究方案經本院倫理委員會批準同意(編號:E2020081.1)。
1.2 試劑和儀器EGCG(純度≥ 95%)購自美國Sigma 公司;QuantiChrom Hemoglobin Assay Kit 購自美國BioAssay Systems 公司;Nrf2、Keap1、TLR4一抗購自美國Proteintech 公司;NF-κB p65、phosphorylated-NF-κB p65、β-actin 一抗購自美國Cell Signaling Technology 公司;Alexa 594 偶聯的二抗購自美國Abcam 公司;PVDF 膜購自美國Millipore 公司;HRP 偶聯的兔或小鼠IgG 二抗購自北京CWBIO 公司。YLS-14B 血栓形成測試儀購自濟南一研科技發展有限公司;FreeStyle Optium Neo 血糖儀購自美國Abbott Diabetes Care 公司;分光光度計購自美國Molecular Devices 公司;Nikon Eclipse Ti-SR 購自日本Nikon 公司;Tanon 5200 增強型化學發光加檢測系統購自上海Tanon 公司。
1.3 方法
1.3.1 制備高血糖誘導的HT 模型大鼠在手術前30 min 腹腔注射50%葡萄糖(6 mL/kg),并用10%水合氯醛(4 mL/kg)麻醉。參照文獻[9]方法建立電凝誘導的血栓性局灶性缺血大鼠模型。將大鼠右側頸總動脈(CCA)、頸外動脈(ECA)和頸內動脈(ICA)鈍性分離。將YLS-14B 血栓形成測試儀的電鉗放入頸總動脈中并刺激(1.00 mA)4 min。血栓被壓碎并沖入ICA。再將CCA 夾住15 min,然后將動物放回籠子。
1.3.2 動物分組將動物隨機分為假手術組(Sham,n= 20)、模型組(n= 27)、高血糖模型組(HG,n= 43)、EGCG 組(n= 43)。在Sham 組中,僅分離出CCA。在模型組中,大鼠接受手術但未接受50%葡萄糖注射。在HG組和EGCG組中,大鼠接受手術并接受50%的葡萄糖。此外,EGCG 組在IS 前灌胃給藥5 d。在腦缺血模型中研究了各種劑量的EGCG,我們根據之前的研究[10]選擇50 mg/(kg·d)的劑量。本研究共使用143 只大鼠,排除10 只非卒中大鼠。
1.3.3 血糖檢查在注射50%葡萄糖前和術后0、1、2、3 h 通過尾靜脈穿刺采血。使用FreeStyle Optium Neo 血糖儀進行測量血糖。
1.3.4 神經功能評估缺血24 h 后,對大鼠進行神經功能測試。根據Longa 的五點量表,選擇評分為1 ~ 3 的大鼠進行后續實驗。改良神經嚴重程度評分(mNSS)方法包括運動功能評分(6 分)、感覺功能評分(2 分)、平衡木評分(6 分)和反射功能(4 分)。得分越高表明損傷的嚴重程度越高。得分≥ 8 分的大鼠用于進一步實驗。
1.3.5 梗死體積檢查缺血24 h后,將大鼠麻醉并處死。大腦被迅速取出并在-80 ℃下冷凍15 min。將大腦切成2 mm 冠狀切片,并在1% TTC 溶液中保存15 min。然后,用4%多聚甲醛固定腦切片并拍照。通過Image J 軟件檢查梗死體積、對側對應結構的體積和同側對應結構的體積。以下公式用于校正水腫和萎縮的梗死體積:梗死體積百分比 =[總梗死體積-(同側半球體積-對側半球體積)]/對側半球體積× 100%[11]。
1.3.6 HT 發病率和死亡率統計每組所用大鼠數、死亡數、有無出血大鼠數。HT發生率(%)=出血大鼠數/(出血大鼠數+無出血大鼠數)×100%。死亡率(%) = (死亡的大鼠數/使用的大鼠數) × 100%。
1.3.7 出血評分和血紅蛋白含量測量灌注后迅速取出大腦,冠狀切開6 片進行評分。出血的嚴重程度分為4 個等級:1 - 4 分:小點狀出血性梗塞(HI1,1 分)、融合性點狀出血性梗塞(HI2,2 分)、小實質出血(PH1,< 梗塞區的30%,輕度占位效應,3 分)和大量實質出血(PH2,≥ 30%梗死區,顯著的占位效應,4 分)[12]。評分后,快速稱重同側半球,用0.1 mol/L PBS(1∶1)進行分離和勻漿。以13 000 ×g離心30 min 后,收集上清液。將50 μL上清液吸收到96 孔板中,加入200 μL 試劑(QuantiChrom Hemoglobin Assay Kit)并避光。在室溫下反應15 min 后,用分光光度計在400 nm 處測量OD值。
1.3.8 蘇木精-伊紅(HE)染色用多聚甲醛固定大腦,然后脫水,石蠟包埋,切成5 μm 厚的切片。將大鼠切片脫蠟、再水化并用HE 染色以進行整體形態學評估。
1.3.9 免疫熒光測定將4%多聚甲醛固定的大腦切成25 μm 切片用于雙重免疫染色分析。將切片與大鼠抗 Nrf2(1∶100)或Keap1(1∶100)一起孵育,然后與Alexa 594 偶聯的二抗(1∶500)一起孵育。將蓋玻片固定在載玻片上并用4',6-didiayl-2-phenylindole 染色。在熒光顯微鏡下測量切片。使用Nikon Eclipse Ti-SR 獲得熒光圖像,并通過Image J 軟件進行分析。測量積分光密度和免疫反應點的面積。
1.3.10 網絡藥理學分析EGCG 的潛在靶點收集于瑞士靶點預測(http://www.swisstargetprediction.ch/)網站。與“缺血性卒中”、“高血糖”、“腦出血”、“出血性轉化”和“高血糖缺血性卒中”相關的靶點通過搜索OMIM 數據庫、DrugBank 數據庫、GeneCards 數據庫、TTD 數據庫獲取。將化合物與疾病的相互作用靶基因導入Cytoscape 3.7.1 軟件進行蛋白質-蛋白質相互作用(PPI)分析,選擇度數、介數中心性和接近中心性大于各自中位數的基因作為核心靶基因。STRING(https://string-db.org/)網站用于執行京都基因和基因組百科全書(KEGG)通路富集分析。
1.3.11 蛋白質印跡腦組織在含有蛋白酶抑制劑和磷酸酶抑制劑的RIPA 緩沖液中裂解和勻漿。然后將勻漿在冰上裂解20 min 并在4 ℃下以13 000 ×g離心15 min。蛋白質濃度采用BCA 法測定。通過10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS/PAGE)分離蛋白質并轉移至PVDF 膜。在TBST 中用5% BSA 封閉1 h 后,將膜與Nrf2(1∶1 000)、Keap1(1∶1 000)、TLR4(1∶800)、NF-κB p65(p65,1∶1 000)、phosphorylated-NF-κB p65(pp65,1∶1 000)和β-actin(1∶1 000)一抗在4 ℃下孵育過夜。在室溫下加入針對HRP 偶聯的兔或小鼠IgG 二抗(稀釋度1∶5 000)2 h。使用Tanon 5200增強型化學發光加檢測系統進行檢測,并使用Image J 軟件分析條帶的光密度。
1.4 統計學方法采用SPSS 22.0 進行統計分析。正態分布的計量資料結果表示為平均值±標準差。使用未配對的學生t檢驗進行兩組之間的統計分析。使用單因素方差分析和Bonferroni 多重比較事后檢驗進行兩個以上組的統計分析。使用帶有Tukey 事后檢驗的重復測量雙向ANOVA 分析血糖數據。計數資料以率(%)表示,采用χ2檢驗分析出血發生率和死亡率。使用非參數Kruskal-Wallis檢驗和事后Dunnett 多重比較檢驗分析神經系統評分。P< 0.05 認為差異有統計學意義。
2 結果
2.1 注射50%葡萄糖后不同時間點的血糖水平如表1 所示,模型組卒中后3 h 內血糖水平逐漸升高。注射50%葡萄糖的大鼠在注射后30 min 血糖水平最高,并維持3 h。然而,EGCG 不影響血糖升高。
表1 注射50%葡萄糖后不同時間點的血糖水平Tab. 1 Blood sugar levels at different time points after 50% glucose injection ±s,mmol/dL
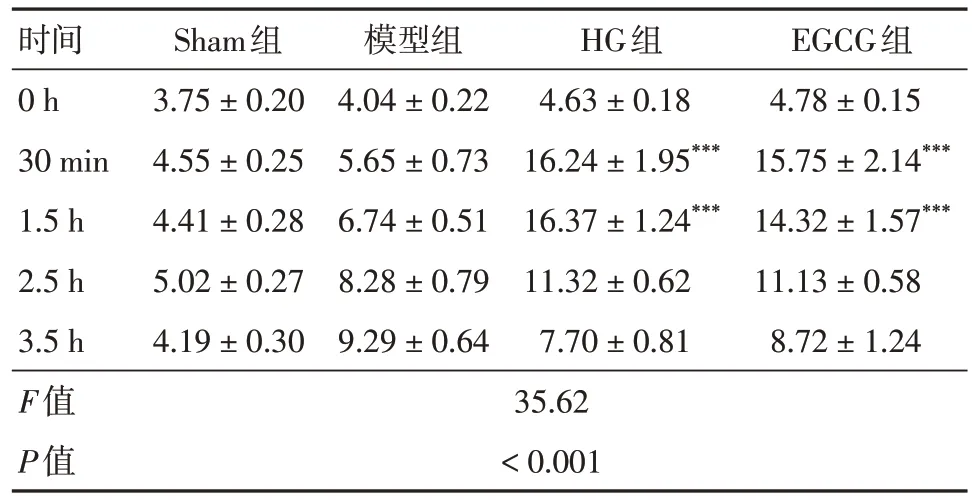
表1 注射50%葡萄糖后不同時間點的血糖水平Tab. 1 Blood sugar levels at different time points after 50% glucose injection ±s,mmol/dL
注:與模型組相比,***P < 0.001
時間0 h 30 min 1.5 h 2.5 h 3.5 h F值P值Sham組3.75 ± 0.20 4.55 ± 0.25 4.41 ± 0.28 5.02 ± 0.27 4.19 ± 0.30模型組4.04 ± 0.22 5.65 ± 0.73 6.74 ± 0.51 8.28 ± 0.79 9.29 ± 0.64 HG組4.63 ± 0.18 16.24 ± 1.95***16.37 ± 1.24***11.32 ± 0.62 7.70 ± 0.81 EGCG組4.78 ± 0.15 15.75 ± 2.14***14.32 ± 1.57***11.13 ± 0.58 8.72 ± 1.24 35.62< 0.001
2.2 EGCG 改善神經功能并減少急性高血糖引起的梗死體積與模型組相比,HG 組大鼠死亡率顯著升高(P< 0.05)。EGCG 組大鼠死亡率較HG組顯著降低(P< 0.05)。其次,HG 組的Longa 評分明顯高于模型組(P< 0.05),EGCG 預處理顯著改善了神經功能。通過TTC 染色測量梗死體積。如圖1 和表2 所示,NG 組有明顯的腦梗死,高血糖進一步增加了梗死體積。與HG 組相比,EGCG 預處理顯著降低了梗死體積(P< 0.05)。

圖1 通過TTC 染色測量梗死體積(n = 6)Fig.1 Infarct volume was measured by TTC staining(n = 6)
表2 EGCG 對急性高血糖卒中大鼠神經功能和梗死體積的影響Tab.2 Effects of EGCG on neurological function and infarct volume in rats with acute hyperglycemia ±s

表2 EGCG 對急性高血糖卒中大鼠神經功能和梗死體積的影響Tab.2 Effects of EGCG on neurological function and infarct volume in rats with acute hyperglycemia ±s
注:與Sham組相比,***P < 0.001;與模型組相比,&P < 0.05;與HG組相比,#P < 0.05、##P < 0.01
組別Sham組模型組HG組EGCG組F/χ2值P值梗死體積(%)0 38.06 ± 3.17***42.14± 4.37***28.50 ±3.73#34.26< 0.001 n 20 27 43 43死亡[n(%)]0(0)6(21.2)***22(51.2)***&13(30.20)#7.11 0.029 mNSS評分(分)0 10.02 ± 0.38***11.27 ± 0.45***9.63 ± 0.29##28.62< 0.001 Longa評分(分)0 2.33 ± 0.42***3.57± 0.20***&1.93 ± 0.33#31.53< 0.001
2.3 EGCG 減輕急性高血糖引起的HTHG 組的HT發生率高于模型組(59.3%vs. 90.7%)。EGCG顯著降低高血糖誘導的HT 發病率至69.8%(表3)。出血評分結果顯示,模型組有輕微出血,HG 組出血評分明顯升高。與HG 組相比,EGCG 組顯著降低了出血評分(圖2A 和表3)。HG 組的血紅蛋白含量明顯高于模型組。與HG 組相比,EGCG 使血紅蛋白含量分別從(53.42 ± 5.11) mg/dL 降低到(37.04 ± 2.39) mg/dL(表3)。HE 染色顯示了急性高血糖導致腦出血增加,EGCG 可緩解(圖2B)。

圖2 EGCG 對高血糖引起的腦出血的影響Fig.2 Effect of EGCG on cerebral hemorrhage caused by hyperglycemia
表3 EGCG 對急性高血糖卒中大鼠HT 的影響Tab. 3 Effect of EGCG on HT in Rats with Acute Hyperglycemia Stroke ±s
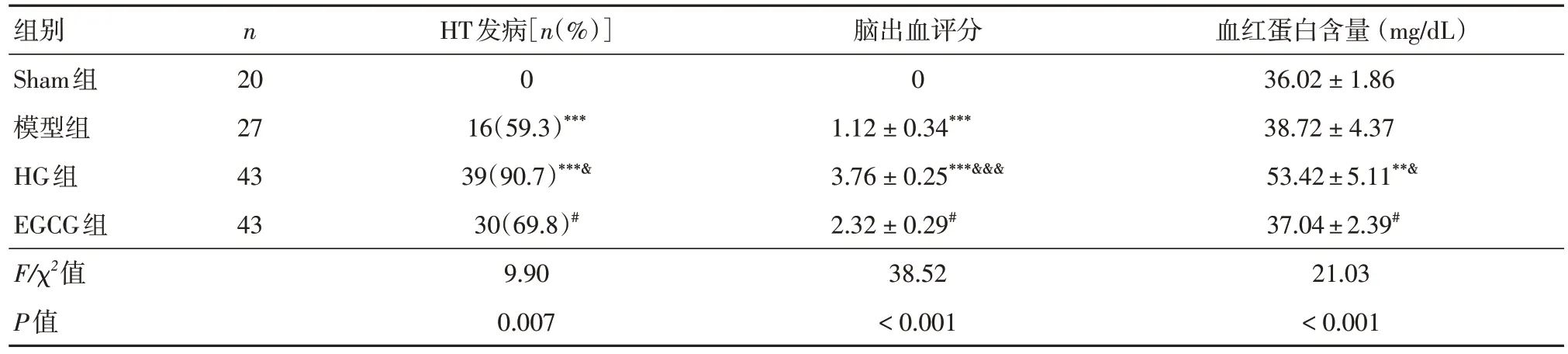
表3 EGCG 對急性高血糖卒中大鼠HT 的影響Tab. 3 Effect of EGCG on HT in Rats with Acute Hyperglycemia Stroke ±s
注:與Sham組相比,***P < 0.001;與模型組相比,&P < 0.05;與HG組相比,#P < 0.05
組別Sham組模型組HG組EGCG組F/χ2值P值血紅蛋白含量 (mg/dL)36.02 ± 1.86 38.72 ± 4.37 53.42 ± 5.11**&37.04 ± 2.39#21.03< 0.001 n 20 27 43 43 HT發病[n(%)]0 16(59.3)***39(90.7)***&30(69.8)#9.90 0.007腦出血評分0 1.12 ± 0.34***3.76 ± 0.25***&&&2.32 ± 0.29#38.52< 0.001
2.4 EGCG 可通過Nrf2-Keap1 通路預防急性高血糖誘導的HT采用網絡藥理學分析EGCG 在HT 中的潛在靶點。結果表明,EGCG 與高血糖卒中之間有366 個交叉目標,PPI 網絡分析產生了139 個EGCG 的核心靶基因,這些基因作用于高血糖誘導的HT(圖3A)。KEGG 通路富集分析結果顯示,Nrf2-Keap1 通路富集35 個核心靶基因,HIF-1通路富集26 個基因,PI3K-Akt 通路富集35 個核心靶基因,EGFR 酪氨酸激酶抑制劑抗性途徑中富集23 個基因(圖3B)。

圖3 EGCG 治療高血糖誘導的HT 的網絡藥理學預測Fig.3 Network pharmacological prediction of EGCG in the treatment of hyperglycemia-induced HT
2.5 EGCG 促進急性高血糖后Nrf2-Keap1 通路的激活缺血后Nrf2 和Keap1 的表達水平明顯降低,HG 進一步降低。與HG 組相比,EGCG 組Nrf2和Keap1 的表達水平顯著增加(P< 0.05)(圖4A)。同樣,HG 組Nrf2 和Keap1 的表達顯著降低和TLR4的表達、NF-κB 的磷酸化顯著增加,但EGCG 逆轉了這一過程(圖4B)。

圖4 EGCG 對急性高血糖后Nrf2-Keap1 信號通路激活的影響Fig.4 Effect of EGCG on activation of Nrf2-Keap1 signal pathway after acute hyperglycemia
3 討論
作為腦卒中的嚴重并發癥,高血糖誘發的HT越來越受到關注。由于病理機制復雜,臨床上仍缺乏治療藥物。有必要尋找新的治療藥物改善腦卒中的預后。本研究結果表明,EGCG 預處理顯著改善了IS 后急性高血糖引起的神經功能缺損和腦出血。它的影響可能與激活Nrf2-Keap1 介導的神經保護作用有關。
在這項研究中,我們使用了電凝誘導的血栓性卒中大鼠模型。CCA 中形成的血栓引起的MCA閉塞與人類血栓栓塞性卒中相似,適用于評估溶栓藥物[13]。與傳統的栓塞卒中模型相比,該模型還開發了可重復和可預測的梗死體積。基于該模型,通過誘導缺血性卒中后急性高血糖來評估EGCG 對HT 的影響。先前的一項研究[14]報道,MCAO 后急性高血糖大鼠的HT 發生率高于95%。本研究中HT 發生率為90.7%,符合實驗要求。
EGCG 作為綠茶的主要活性成分。近期研究[15-16]發現,EGCG 通過調節線粒體呼吸功能和脂質代謝以及減少線粒體自噬和細胞凋亡來改善腦缺血,但EGCG 對HT 的影響尚不清楚。本研究結果表明,EGCG 改善了神經功能缺損和梗死體積,這與之前的研究[16]一致。值得注意的是,我們觀察到EGCG 可以減輕高血糖誘導的HT 并降低HT的發病率和死亡率。先前的研究表明,高血糖通過IS 后的多種病理機制促進HT,例如促進能量代謝紊亂、氧化應激和神經炎癥[17]。此外,高血糖會刺激HIF-1α 和VEGF 過表達以及PAI-1 的產生,導致血管功能異常,并通過刺激AIF-Caspase-3 通路誘導細胞凋亡[18]。這些病理機制導致神經血管穩態的破壞。本研究采用網絡藥理學預測EGCG 預防HT 的靶點和途徑。網絡藥理學研究側重于成分、靶點和疾病之間的相互關系,有助于闡明天然產物的作用機制和靶點[19]。結果表明,EGCG 的作用靶點復雜,與高血糖誘導的HT 信號通路相關,如Nrf2-Keap1 通路、HIF-1 通路、PI3K-Akt 通路和EGFR 通路。因此,這些通路可能是EGCG 減輕高血糖誘導的HT 的潛在途徑。
在網絡藥理學預測的這些信號通路中,一些研究[20]表明Nrf2-Keap1 抑制了高血糖誘導的炎癥損傷,被認為是減輕糖尿病血管疾病和血管功能障礙的保護因素。Nrf2 是生物防御系統抵高血糖刺激的關鍵介質,增加Nrf2 活性可能會抵消華法林的促出血作用[21]。在靜止條件下,Nrf2 與Keap1結合,通過泛素化促進Nrf2 的快速蛋白酶體降解。然而,在急性高血糖應激期間,Nrf2 從Keap1 解離并促進Toll 樣受體2 和4(TLR2,TLR4)的表達以及NF-κB 的核轉位,導致神經炎癥[22]。此外,高血糖會抑制Nrf2-Keap1 的產生和促進TLR4 的表達,從而激活NF-κB 信號通路,導致神經炎癥[23]。因此,結合網絡藥理學的結果,我們進一步研究了Nrf2-Keap1 通路介導的神經炎癥在高血糖誘導的HT 中的作用,結果證實了TLR4 和p-p65 的表達因高血糖而顯著上調,而在EGCG 給藥后受到抑制,表明EGCG 逆轉了高血糖對Nrf2-Keap1 信號通路的抑制作用。
總之,急性高血糖通過抑制Nrf2-Keap1 信號通路,促進炎癥因子的釋放,進而誘導缺血性卒中后HT 的發生。EGCG 預處理防止了HT 的發生,這可能與激活Nrf2-Keap1 信號通路介導的神經保護作用有關。但結合網絡藥理學結果,EGCG 對高血糖增強HT 的保護作用可能還與血管功能和氧化應激有關,本研究并未對此進行分析。因此,EGCG 在HT 中的作用機制有待進一步探索。

