一株擬南芥寬葉形突變體atscamp的分離鑒定
郝雪峰 賈曉宇 曹海艷 亢春霞 裴雁曦
(1.太原師范學(xué)院,生物科學(xué)與技術(shù)學(xué)院,晉中 030619; 2.山西大學(xué),生命科學(xué)學(xué)院,特色植物資源研究與利用山西省重點(diǎn)實(shí)驗(yàn)室,太原 030006)
隨著世界人口的增加,耕地面積的減少,提高農(nóng)作物產(chǎn)量成為亟待解決的問題之一[1]。植物器官大小直接影響作物的產(chǎn)量和生物量[2]。對(duì)植物來說,光合性能是影響農(nóng)作物產(chǎn)量的一個(gè)重要指標(biāo)。葉片作為光合作用的主要器官,其理想的形態(tài)有利于塑造株型并提高光合效率[3]。此外,葉片形態(tài)對(duì)于植物光合儲(chǔ)能、抵御逆境等都有非常重要的意義。葉片是植物最重要的根外營養(yǎng)器官,葉片在吸收水分的同時(shí)也能像根一樣將養(yǎng)分轉(zhuǎn)運(yùn)到植物體內(nèi)[4]。水稻(Oryza sativa)籽粒灌漿所需營養(yǎng)物質(zhì)的60%~80%來自葉片光合作用[5]。小麥(Triticum sativum)灌漿期籽粒碳水化合物的30%~50%主要來源于旗葉的光合作用[6]。因此,利于提高光合作用的株型、葉形成為重要的產(chǎn)量育種指標(biāo)。
葉片形態(tài)對(duì)于實(shí)現(xiàn)作物高效光合影響很大,目前,已開展了很多對(duì)于葉片形態(tài)的相關(guān)研究。已有報(bào)道表明,植物葉片窄葉性狀的發(fā)育與生長素的合成和極性運(yùn)輸密切相關(guān),生長素在葉片和維管組織的發(fā)育和形態(tài)建成上起著重要的作用[7]。在單子葉植物中,一些水稻葉形相關(guān)調(diào)控基因被報(bào)道,水稻葉形調(diào)控基因的共同特點(diǎn)是參與激素的合成或運(yùn)輸,其突變性狀為葉片窄化且伴隨植株矮化[8]。目前,已經(jīng)報(bào)道了定位于水稻不同染色體的nal1~nal7七個(gè)窄葉突變體,對(duì)部分基因進(jìn)行了功能驗(yàn)證[9]。NAL1基因編碼1 個(gè)植物特有的蛋白,它可以調(diào)節(jié)生長素的極性運(yùn)輸,使得水稻葉片橫向生長[10-11];NAL7基因編碼1 個(gè)YUCCA 家族酶蛋白,參與生長素的合成,并影響葉形發(fā)育[12]。雙子葉植物中,張海瑞[13]發(fā)現(xiàn)yuan1突變體可導(dǎo)致擬南芥(Arabidopsis thaliana)葉片表現(xiàn)出短而圓的表型;AN3/AtGIF1和At-GRF5的功能缺失突變體表現(xiàn)出窄葉表型,該表型由葉片細(xì)胞數(shù)目變少引起[14-15]。黃淦等[16]發(fā)現(xiàn)GRXC9基因過表達(dá)株系中葉片細(xì)胞體積變小,葉片出現(xiàn)短小的表型。但是葉片寬大性狀相關(guān)基因的研究還很少。
分泌載體膜蛋白(secretory carrier membrane protein,SCAMP)廣泛存在于包括線蟲、昆蟲、魚類、兩棲動(dòng)物、哺乳動(dòng)物等的真核生物中,也存在于單子葉植物和雙子葉植物中[17]。SCAMP參與植物細(xì)胞內(nèi)吞作用和信號(hào)傳導(dǎo),以及胞吐的調(diào)節(jié)和多泡內(nèi)體生物發(fā)生[18-19]。植物中SCAMPs是一個(gè)基因家族,其家族成員參與調(diào)控花粉管發(fā)育[20],AtSCAMP在種子萌發(fā)階段及生長發(fā)育階段對(duì)鹽脅迫較為敏感[21]。在小麥中,TaSCAMP1可以與液泡膜Na+/H+逆向轉(zhuǎn)運(yùn)蛋白發(fā)生互作,推測(cè)與植物耐鹽性相關(guān)[22]。目前,尚未發(fā)現(xiàn)該基因與葉形調(diào)控相關(guān)研究的報(bào)道,因此,探索SCAMP 與葉形發(fā)育這兩者之間的聯(lián)系是一個(gè)十分有意思的研究。
本研究前期發(fā)現(xiàn)了1 個(gè)寬葉表型的擬南芥突變體,從表型看這一突變體的表現(xiàn)與前述已經(jīng)報(bào)道[8]的突變體有顯著不同,一是基因突變表現(xiàn)為葉片加寬,另外該突變體并沒有伴隨矮化表型。推測(cè)該突變位點(diǎn)與已經(jīng)報(bào)道的單子葉植物葉形調(diào)節(jié)基因不屬于同一類型。目前寬葉相關(guān)性狀研究及基因定位克隆很少。本研究將對(duì)這一突變體進(jìn)行鑒定,以期為研究葉形發(fā)育分子調(diào)控機(jī)理提供新的突破點(diǎn),也為培育高光合效能作物品種提出全新的研究思路。
1 材料與方法
1.1 植物材料
所用材料為哥倫比亞生態(tài)型(Col-0)擬南芥和化學(xué)誘導(dǎo)型擬南芥XVE 誘導(dǎo)型激活突變體(中國科學(xué)院遺傳與發(fā)育生物學(xué)研究所的左建儒教授提供)。
1.2 培養(yǎng)條件
選擇均勻飽滿的擬南芥種子,4 ℃春化2~4 d,經(jīng)70%乙醇和6.5%次氯酸鈉消毒后先種植于1/2MS 培養(yǎng)基上生長1 周,然后挑選生長健壯的幼苗定植于V(營養(yǎng)土)∶V(珍珠巖)∶V(蛭石)=1∶1∶1的混合基質(zhì)中;培養(yǎng)條件均為23 ℃、相對(duì)濕度60%、光照強(qiáng)度160 μE·m-2·s-1、光周期為16 h 光照/8 h 黑暗[23]。收集1~5 周齡植株葉片(用于發(fā)育時(shí)期特異性測(cè)定)和第5 周齡植株的根、莖、葉、花(進(jìn)行組織特異性測(cè)定)后,立即置于液氮中,冰箱中-80 ℃存儲(chǔ)備用。
1.3 試驗(yàn)方法
1.3.1 突變體的Genotyping 鑒定以及RT-PCR表達(dá)分析
取4 周齡的擬南芥野生型(WT)和atscamp突變體植株,用CTAB 法提取葉片總DNA。以DNA為模板,采用三引物法,進(jìn)行PCR 擴(kuò)增。引物為AtSCAMP基因特異的引物P1、P2 與T-DNA 上的引物P3,詳細(xì)引物序列信息見表1。

表1 基因分型及表達(dá)量鑒定引物列表Table 1 Primer list for genotyping and expression level analysis
DNA提取、PCR擴(kuò)增、膠回收,T載體克隆等參考Liu等[24]的方法進(jìn)行;委托北京華大基因公司測(cè)序;序列在NCBI 進(jìn)行比對(duì)分析,用Tail-PCR 技術(shù)[24]確定T-DNA 插入位點(diǎn);RNA 提取、單鏈cDNA的 合 成 以 及 半 定 量RT-PCR 參 見Dixit 等[25]的方法。
1.3.2 突變體的觀察
利用直尺和拍照式葉面積儀(JC-LAM-D,中國),分別對(duì)5 周齡植株冠幅及其最大的4~5 片葉進(jìn)行葉長、葉寬和葉面積的測(cè)量。
1.3.3 葉綠素?zé)晒鈪?shù)、葉綠素含量和葉片氣體交換參數(shù)的測(cè)定
利用植物效率分析儀(Handy PEA,英國)測(cè)定葉綠素?zé)晒鈪?shù),將葉片表面擦凈,植株遮光暗適應(yīng)30 min 之后測(cè)定葉片初始熒光(Fo),用飽和脈沖光照射測(cè)量可變熒光(Fv),根據(jù)Fo和Fv計(jì)算PSⅡ的潛在光化學(xué)效率(Fv/Fo),每組處理重復(fù)3次,取平均值作為測(cè)定數(shù)值。
參考李合生[26]的方法,取0.05 g 新鮮葉片,加入1 mL 95%乙醇于研缽中進(jìn)行勻漿,后將勻漿液轉(zhuǎn)入5 mL 的EP 管,再用2 mL 95%清洗研缽后再次歸入EP 管,共3 mL,操作時(shí)注意避光,于室溫3 000 r·min-1離心3 min 取上清液備用。取200 μL上清液于多功能酶標(biāo)儀(BioTek,美國)測(cè)定665 nm 和649 nm 處的吸光值(即D665,D649)。以95%乙醇為空白,樣品和空白均設(shè)置3 個(gè)重復(fù),記錄數(shù)值,并按如下公式計(jì)算:ρ(Chl a)=13.95×D665-6.88×D649;ρ(Chl b)=24.96×D649-7.32×D665;各葉綠體色素質(zhì)量分?jǐn)?shù)=(色素質(zhì)量濃度×提取液體積)/葉片鮮質(zhì)量。
利用光合作用測(cè)定儀(SY-1020,中國)于09:00—11:00 檢測(cè)植株葉片氣體交換參數(shù):凈光合速率(Pn)、蒸騰速率(Tr)、胞間二氧化碳摩爾分?jǐn)?shù)(Ci)、氣孔導(dǎo)度(Gs)和水分利用率(WUE)。測(cè)定時(shí)光源充足,CO2流速穩(wěn)定。
1.3.4 氣孔孔徑測(cè)定
取4 周齡的WT、atscamp植株的葉片,每個(gè)樣本撕取表皮條3~4個(gè)(取材于不同幼苗),置于75%乙醇中固定,在光學(xué)顯微鏡下觀察氣孔,每個(gè)表皮條至少觀察5個(gè)視野,統(tǒng)計(jì)至少90個(gè)氣孔孔徑。
1.4 數(shù)據(jù)處理
使用Excel 2016 和IBM SPSS Statistics 26 軟件對(duì)數(shù)據(jù)進(jìn)行單因素方差分析,并用平均值±標(biāo)準(zhǔn)差表示,用Duncan’s分析不同處理間的差異顯著性,使用SigmaPlot 10.0及Photoshop 2020作圖。
2 結(jié)果與分析
2.1 突變體的T-DNA插入位點(diǎn)
從化學(xué)誘導(dǎo)型擬南芥突變體庫(約6 000 株系)中篩選獲得1 株葉片性狀寬大的突變體(見圖1A)。單株收種性狀穩(wěn)定后,Tail-PCR 結(jié)果表明T-DNA 插入位點(diǎn)位于AT1G11180(NC_003070.9,Tair Accession 6530298368,2 784 bp)基因第5個(gè)外顯子(1 190~1 312 bp)中第1 215~1 216 bp(見圖1B)。查 詢GenBank 數(shù) 據(jù) 庫,AT1G11180編 碼SCAMP2家族蛋白,因此將該突變體命名為atscamp。Genotyping 結(jié)果表明,atscamp突變體是純合植株(見圖1C)。 RT-PCR 檢 測(cè) 發(fā) 現(xiàn),AtSCAMP2基 因 在atscamp突變體中轉(zhuǎn)錄表達(dá)水平極低(見圖1D)。SCAMP 家族蛋白一般具有4 個(gè)跨膜結(jié)構(gòu)域(TMDs),廣泛存在于許多真核生物中,在植物中是植物細(xì)胞內(nèi)吞和分泌途徑的有用標(biāo)記,但是目前功能尚不清楚。
2.2 突變體表型與分析
擬南芥野生型和突變體atscamp播種后28 d,植株抽薹前,對(duì)植株冠幅、葉長、葉寬和葉面積進(jìn)行測(cè)量。數(shù)據(jù)顯示,突變體atscamp葉片冠幅、葉片長度與野生型植株相似;但是突變體的葉片寬度和比葉面積均極顯著大于野生型植株(見表2)。
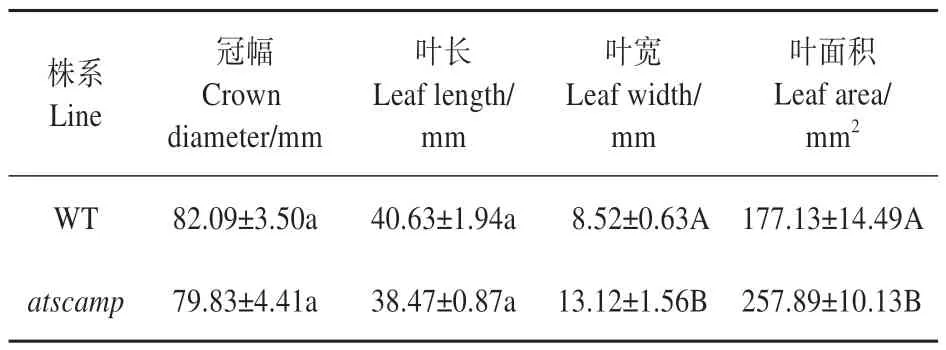
表2 WT和atscamp的形態(tài)結(jié)構(gòu)性狀Table 2 Morphological structure characteristics of WT and atscamp
另外,與野生型植株相比,該突變體的葉色明顯較深。因此對(duì)atscamp突變體的葉綠素含量進(jìn)行測(cè)定,結(jié)果顯示(見表3):與野生型植株相比,atscamp突變體葉綠素b含量雖然未發(fā)生顯著變化,但是葉片葉綠素a含量顯著增加,相應(yīng)地葉綠素a/b比值也顯著增加。
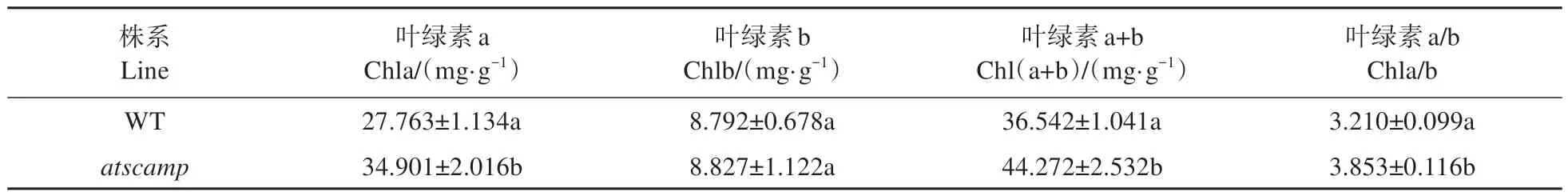
表3 WT和atscamp葉綠素含量的差異Table 3 Differences of chlorophyll content between WT and atscamp
2.3 突變體atscamp葉綠素?zé)晒夂凸夂舷嚓P(guān)指標(biāo)
鑒于atscamp突變體中葉綠素含量的變化,暗示該突變體光合性能可能發(fā)生變化。因此,進(jìn)一步對(duì)該突變體植株葉綠素?zé)晒夂凸夂舷嚓P(guān)指標(biāo)進(jìn)行分析,結(jié)果如表4 所示:atscamp突變體葉片葉綠素初始熒光與野生型植株相比,無顯著差異;但是突變體中葉綠素最大熒光(Fm)、PSⅡ最大光化學(xué)效率和PSⅡ潛在光化學(xué)效率都顯著高于野生型植株。
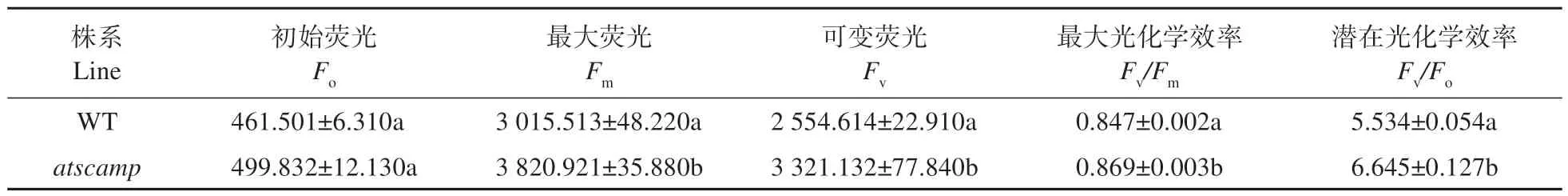
表4 WT和atscamp葉綠素?zé)晒鈪?shù)的差異Table 4 Differences of chlorophyll fluorescence parameters between WT and atscamp
結(jié)果發(fā)現(xiàn),atscamp突變體的凈光合速率(Pn)較野生型植物極顯著增加;同時(shí)該突變體葉片水分利用效率(WUE)和葉片蒸騰系數(shù)(Tr)都顯著增加;但是該突變體的氣孔導(dǎo)度(Gs)和氣孔開度(Sa)與野生型植物相比均無顯著差異(見表5)。

表5 WT和atscamp葉片光合指標(biāo)的差異Table 5 Differences of leaf photosynthetic indexes between WT and atscamp
2.4 AtSCAMP基因在植物中的時(shí)空性表達(dá)特性
關(guān)于擬南芥AtSCAMP基因功能的報(bào)道非常少,筆者沒有獲得該基因影響植物葉形的可能調(diào)控機(jī)制信息。為了進(jìn)一步了解該基因在植物中的表達(dá)特性,利用RT-PCR 方法對(duì)擬南芥中AtSCAMP的表達(dá)特性進(jìn)行分析,結(jié)果表明:該基因在葉片中高表達(dá),但是在根、莖、花中表達(dá)量非常低,表現(xiàn)出明顯的組織特異性(見圖2A~B)。對(duì)1~5周齡不同發(fā)育時(shí)期葉片中AtSCAMP基因表達(dá)量進(jìn)行分析表明,該基因在1周齡幼苗葉片中幾乎檢測(cè)不到表達(dá),隨著植株發(fā)育,該基因在葉片中的表達(dá)量逐漸增加,到4~5周齡時(shí),表達(dá)量達(dá)到最高值(見圖2C~D)。
3 討論
植物葉形受基因型控制,也受到激素互作的影響。在單子葉植物尤其是水稻中,越來越多與葉片形態(tài)相關(guān)的基因被克隆,對(duì)葉形形成的分子機(jī)制的了解逐步加深[10-12],但是關(guān)于雙子葉植物這方面的報(bào)道非常有限。本研究從擬南芥突變體庫中篩選獲得1株新型葉片寬大突變體,進(jìn)一步分析發(fā)現(xiàn)突變體植株突變位點(diǎn)發(fā)生在AT1G11180,該位點(diǎn)編碼蛋白AtSCAMP。Genotyping 技術(shù)鑒定獲得純合突變體植株。研究表明atscamp突變體冠幅沒有發(fā)生改變,但是葉片的寬度和葉面積極顯著大于野生型植株,同時(shí)葉綠素?zé)晒夂凸夂舷嚓P(guān)指標(biāo)顯著高于野生型植株,這是極為少見的1個(gè)葉形突變體。
葉形性狀的概念有兩個(gè)方面,一類是直接影響作物生產(chǎn)性狀的寬窄薄厚等方面的性狀差異。它與植物同化能力、環(huán)境的適應(yīng)性和光合作用能力等密切相關(guān)[27-28],本研究的突變體應(yīng)該屬于這一類型;第二類葉形性狀是異形葉性狀,植物葉形會(huì)隨著環(huán)境條件的變化而變化,同一植株在不同環(huán)境下產(chǎn)生截然不同的葉形,而不同的葉形具有不同的響應(yīng)環(huán)境變化的能力。異形葉是植物適應(yīng)環(huán)境條件的現(xiàn)象。近年來,一些基因影響葉形態(tài)發(fā)育的分子機(jī)制研究也有重要進(jìn)展。王利等[29]發(fā)現(xiàn)ASL25/LBD28基因的過量表達(dá)可導(dǎo)致轉(zhuǎn)基因擬南芥的葉片變得狹長;Adal 等[30]發(fā)現(xiàn)在擬南芥植株中過表達(dá)AGAMOUS-like和SEPALLATA3-like,擬南芥葉片會(huì)出現(xiàn)卷曲現(xiàn)象。邊界基因NAM/CUC調(diào)節(jié)葉緣發(fā)育[31],Vlad 等[32]在碎米薺(Cardamine hirsuta)中鑒定到1個(gè)影響葉邊緣發(fā)育的基因RCO;Li等[33]在異葉水蓑衣(Hygrophila difformis)中探明了HdSTM在異形葉發(fā)育中的調(diào)控作用。AN3/AtGIF1和At-GRF5的功能缺失突變體出現(xiàn)窄葉表型[14-15],本研究中葉片寬大突變體的發(fā)現(xiàn),為研究植物尤其是雙子葉植物的葉形發(fā)育分子調(diào)控機(jī)理,提供了重要線索和研究思路,也展現(xiàn)出作物高光效品種創(chuàng)制方面的潛在應(yīng)用價(jià)值。
SCAMP2是一種相對(duì)保守的膜蛋白,主要分布在一些膜上,例如某些細(xì)胞器的膜、分泌囊泡膜及細(xì)胞膜等,它通常在分揀蛋白、囊泡的形成及胞吞胞吐過程中發(fā)揮物質(zhì)運(yùn)輸功能,比如在高爾基體轉(zhuǎn)運(yùn)途徑中協(xié)助將物質(zhì)進(jìn)行跨細(xì)胞膜運(yùn)輸[34-35]。前人研究[21]表明,SCAMP2在葉中表達(dá)量高于根,本研究與其結(jié)果一致。熒光定量PCR 分析表明,隨著植株發(fā)育,該基因在葉片中的表達(dá)量逐漸增加,到4~5 周齡時(shí),表達(dá)量達(dá)到最高值;且葉綠素?zé)晒夂凸夂舷嚓P(guān)指標(biāo)顯著高于野生型植株。
本研究中,獲得了1 個(gè)完全敲除的擬南芥atscamp突變體,表現(xiàn)出非常顯著的葉片寬大表型,以及增強(qiáng)的光合能力。這是該蛋白家族功能研究的一個(gè)重要的新線索。在目前突變體線索的基礎(chǔ)上,未來需要對(duì)該基因的功能進(jìn)行進(jìn)一步的驗(yàn)證,并嘗試在雙子葉植物尤其是在十字花科(Brassicaceae)作物中尋找該基因的同源基因并證實(shí)其功能,為高光效作物品種創(chuàng)制方面提供理論支撐。

