基于網絡藥理學和分子對接研究太子參治療骨關節炎的作用機制
艾山江·阿帕爾 麥爾哈巴·蘇力坦 李守剛 海如拉·卡斯木阿吉
1.新疆維吾爾自治區喀什地區第一人民醫院藥學部,新疆喀什 844000;2.新疆維吾爾自治區喀什地區第一人民醫院新生兒科,新疆喀什 844000;3.新疆維吾爾自治區喀什地區第一人民醫院小兒骨科,新疆喀什 844000
骨關節炎(osteoarthritis,OA)是常見的關節疾病,其標志性特征是關節疼痛和重要功能障礙。影響全球5億多人(約占全球人口的7%),在高齡(>65歲)人群中發病率較高[1]。OA最終會導致身體殘疾,從而影響生活質量[2]。權威指南中最常推薦的藥物包括非甾體抗炎藥、阿片類藥物等,但這些藥物有潛在的不良反應風險,尤其是在老年人群[3]。
中醫學在治療各種類型的OA方面具有明顯的優勢。OA主要是肝腎虧虛,氣血不足,導致脈搏喪失,致筋脈不通等引起[4]。研究表明,太子參含有多糖、皂苷、環肽和揮發油等化學成分,具有改善疾病免疫功能、抗氧化等藥理作用[5]。
網絡藥理學作為一門新興的基礎學科,它采用多種方法分析藥物基因疾病的多類型和網絡中醫反饋機制系統,大大降低了科研難度和經費消耗,促進中醫藥的推廣[6]。
本研究基于網絡藥理學,預測太子參治療OA的關鍵活性成分、核心靶點和主要途徑,分析太子參潛在的作用機制,以期為未來實驗研究及與其他臨床治療手段聯合使用提供參考。
1 方法
1.1 篩選藥物活性成分
使用中藥系統藥理學數據庫和分析平臺(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)檢索出太子參的活性成分,篩選活性成分設定為口服生物采用度(oral bioavailability,OB)≥30%,類藥性(drug likeness,DL)≥0.18。
1.2 OA對應靶點的篩選
通過Gene Cards、Drug Ban、Pharm Gkb、OMIM數據庫使用“osteoarthritis”為關鍵詞來獲取疾病相關基因。通過R軟件中采用VennDiagram包繪制疾病靶基因和藥物靶點韋恩圖,得到的太子參和OA疾病共有靶點。
1.3 建立“藥物-活性成分-靶點”網絡
使用STRING數據庫獲得疾病的共同靶點,進行蛋白質-蛋白質相互作用(protein-protein interaction,PPI)分析,并將結果輸入Cytoscape 3.8.2軟件進行分析,然后采用Cytoscape 3.8.2軟件構建“藥物-活性成分-靶點”網絡圖,獲得藥物-疾病交叉靶點中的核心關鍵蛋白。
1.4 基因本體(gene ontology,GO)富集分析和京都基因和基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)通路分析
利用R語言(BiocManager包)對OA疾病與太子參藥物的交集進行GO功能分析和KEGG通路分析,得到GO及KEGG富集分析結果。
1.5 分子對接分析
通過PubChem數據庫下載PPI網絡核心靶標對應的小分子配體結構的SDF文件,利用“1-CLICK DOCKING”在線工具進行分子對接,下載pdb結果文件,然后使用Discovery Studio軟件繪制殘基-配體交互情況。
2 結果
2.1 太子參活性成分的篩選
通過TCMSP數據庫,共查找得到太子參25個活性成分,以ADME參數(OB≥30%和DL≥0.18)為標準篩選得到了8種活性成分,見表1。進一步消除無相應蛋白質靶點的其他活性成分,共有5種重要活性成分。
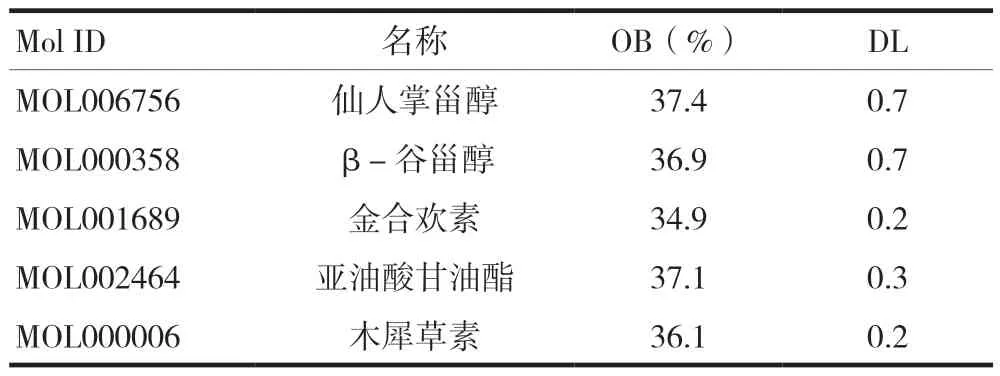
表1 太子參活性成分
2.2 太子參和OA的潛在靶點
通過檢索數據庫,共發現3380個OA相關的靶點。映射后,獲得57個共同基因靶點,韋恩圖見圖1。

圖1 太子參活性成分與OA靶點韋恩圖
2.3 太子參治療OA“藥物-活性成分-靶點”網絡構建
構建“太子參-活性成分-作用靶點”網絡,見圖2。該網絡包括62個節點(5個活性成分節點和57個靶點節點)和108個邊緣,每個邊緣表示單個藥物的活性成分和靶點之間的關系。線越密集活性成分對OA相關靶點的作用越明顯。按節度排序,最重要的活性成分包括木犀草素、金合歡素、β-谷甾醇、仙人掌甾醇、亞油酸甘油單酯等。經過兩次篩選得到核心靶點8個,分別為MAPK1、CCND1、JUN、TP53、CASP3、BCL2L1、AKT1、EGFR,見圖3。
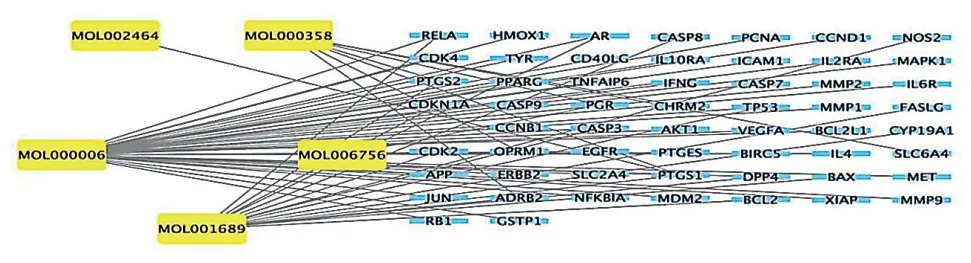
圖2 太子參-活性成分-作用靶點網絡

圖3 PPI網絡核心靶點篩選
2.4 核心靶基因GO分析和KEGG通路富集分析
GO分析可以獲得生物學過程、分子生物學功能、細胞組分,見圖4。結果顯示,生物學過程與對氧化應激的反應等有關;細胞成分包括絲氨酸/蘇氨酸蛋白激酶復合物等;分子功能的相關條目主要包括磷酸酶結合、蛋白磷酸酶結合等。
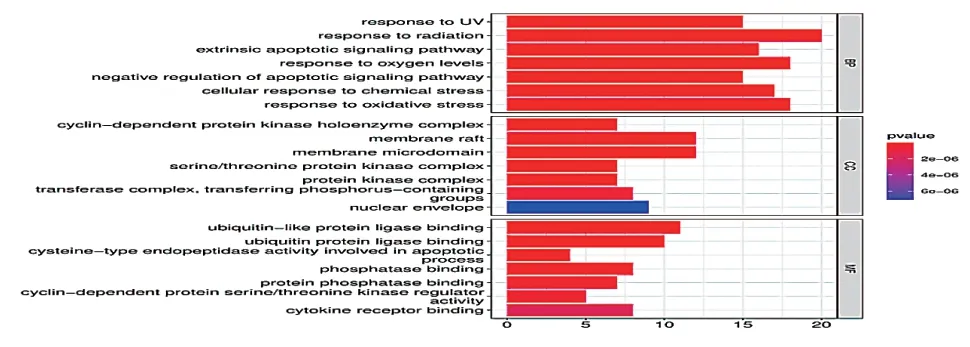
圖4 交集靶點GO富集分析柱狀圖
KEGG富集分析顯示,共篩選出太子參治療OA的潛在通路,見圖5。主要作用于PI3K-AKT、p53、AGE-RAGE、白細胞介素-17(interleukin-17,IL-17)信號通路等。

圖5 交集靶點KEGG富集分析柱狀圖
2.5 分子對接分析
分子對接結果顯示,太子參活性成分(木犀草素)與篩選出的靶點都能較好地對接,與網絡藥理學得到結果相吻合,間接驗證了太子參能夠調節OA的核心靶點。選擇結合能最高的木犀草素和EGFR、CASP3、AKT1、TP53進行分子對接作為示例,見圖6。
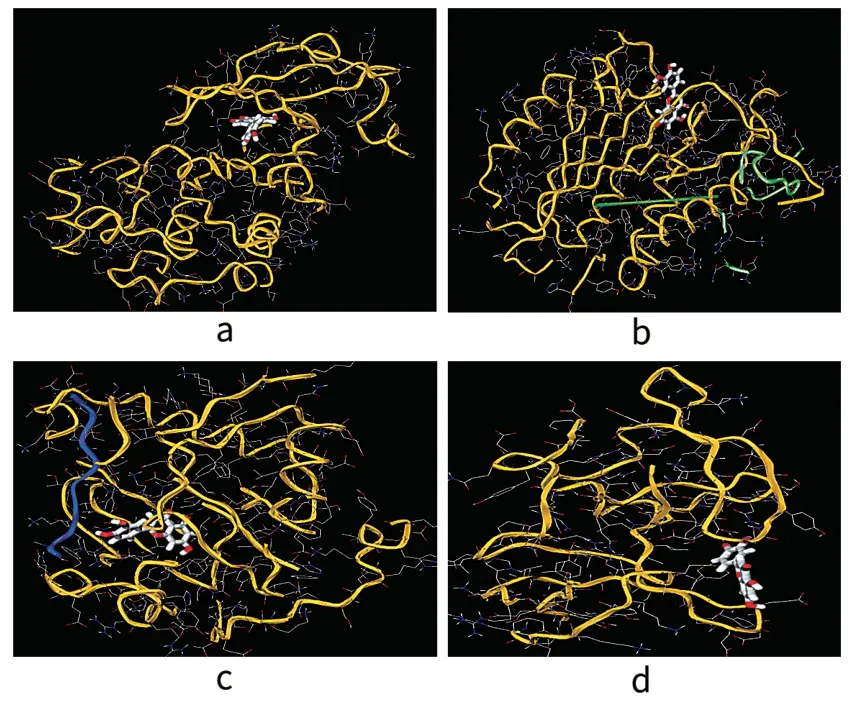
圖6 木犀草素和EGFR(a),CASP3(b),AKT1(c),TP53(d)的分子對接圖
3 討論
OA是最常見的關節疾病之一,其典型特征是慢性關節疼痛和殘疾[7]。基于網絡藥理學研究發現太子參中藥內含有多種有效成分,可作用于多靶點、多通路,共同調節生物功能影響OA。本研究經過篩選統計發現與OA最相關的活性成分是木犀草素。通過PPI網絡篩選并得到8個有潛力治療OA的核心靶點,通過分子對接選擇結合能最高的木犀草素和EGFR、CASP3、AKT1、TP53基因。
OA的發病機制與炎癥、軟骨代謝、氧化應激和細胞凋亡密切相關[8]。TP53可以阻斷細胞周期,導致細胞凋亡,加速軟骨降解[9]。一項動物研究表明,MMP活性與CASP3表達增加,伴有關節軟骨變性和蛋白多糖丟失,應用CASP3對埃及驢進行OA分級,有望用于預后[10]。相關研究分析表明,AKT1的表達增加促進軟骨細胞的修復[11]。一項研究表明,EGFR對于維持表面軟組織細胞的數量和特征,促進軟骨產生蛋白的表達以及刺激軟骨表面潤滑的其他功能至關重要。確定了EGFR作為表層關節軟骨發育和起始關節炎的重要調節因子[12]。
KEGG分析結果顯示,PI3K-Akt、IL-17信號通路是治療OA的潛在關鍵機制。在關節炎的小鼠模型研究中,IL-17通過調節幾種炎癥介質加速軟骨的破壞,表明IL-17在OA的發生和發展中起著關鍵作用[13]。PI3K-AKT信號通路的刺激可以抑制軟骨細胞的增殖并促進軟骨細胞的增生,從而延緩OA軟骨退化的過程[14-15]。
本研究利用網絡藥理學研究技術,初步預測了太子參在OA治療中的潛在活性成分,即重要的靶點和作用途徑,為進一步探索其作用機制奠定基礎。提示太子參的木犀草素等活性成分可能通過影響TP53、CASP3、AKT1、EGFR等相關蛋白靶點的表達,調控PI3K-Akt、IL-17信號通路對軟骨細胞的修復、凋亡及細胞炎癥反應的影響,減緩軟骨細胞的凋亡,促進軟骨細胞的增殖和修復,減少炎癥反應。但本研究只是理論基礎上的預測,為太子參治療OA的臨床應用提供參考依據,后續還需通過進一步實驗驗證藥物的作用機制。

