基于NOD2介導(dǎo)的AMPK/mTOR信號通路探討宮頸癌細胞惡性行為的機制
杜瑞亭,伍東月,郭清民,靳冬梅
宮頸癌(cervical cancer,CC)是女性癌癥相關(guān)死亡的主要原因,每年估計有530 000例新病例和270 000例死亡[1]。由于轉(zhuǎn)移和復(fù)發(fā),CC患者預(yù)后不良,生存率低[2]。因此,尋找CC的分子標志物進行早期診斷和靶向治療對于提高生存率至關(guān)重要。模式識別受體(pattern recognition receptors,PRRs)是檢測病原體特異性分子的宿主傳感器,是抵御感染的第一道防線[3]。核苷酸結(jié)合寡聚化結(jié)構(gòu)域受體2(nucleotide-binding oligomerization domain receptor 2,NOD2)是細胞上/細胞中表達的主要PRRs,能識別入侵的病原體并介導(dǎo)致癌作用[4-5]。研究[6]證實NOD2上調(diào)通過正調(diào)節(jié)人類鱗狀宮頸癌的致瘤性和轉(zhuǎn)移促進癌癥進展。然而,NOD2在CC中的功能在很大程度上是未知的。自噬是一種溶酶體依賴的分解代謝途徑,通過該途徑清除受損或衰老的細胞器[7]。證據(jù)[7]表明,自噬可以增強化療期間癌細胞的獲得性耐藥性。NOD2作為自噬的誘導(dǎo)因子[8],是否介導(dǎo)CC的病理機制仍不清楚。該研究探討了NOD2對CC細胞生物行為和相關(guān)信號通路及自噬的影響。
1 材料與方法
1.1 基因表達譜交互式分析(GEPIA)在線數(shù)據(jù)庫分析對GEPIA在線數(shù)據(jù)庫(http://gepia.cancer-pku.cn/)的CC組織中NOD2的相對mRNA水平進行分析,包括306例CC患者和13例非癌患者。對NOD2的mRNA表達水平進行Log2轉(zhuǎn)換,將CESC患者分為NOD2高表達和低表達兩組,建立總體生存期的Kaplan-Meier生存曲線分析。
1.2 細胞系與培養(yǎng)人CC細胞(HeLa、SiHa、CaSki和ME-180)和人宮頸上皮細胞系Ect1/E6E7來自中國科學(xué)院細胞庫。Ect1/E6E7細胞在補充有10%胎牛血清的McCoy’s 5A培養(yǎng)基(美國Gibco公司)中培養(yǎng),HeLa、SiHa、CaSki和ME-180細胞在RPMI 1640培養(yǎng)基(美國Gibco公司)中培養(yǎng)。
1.3 細胞轉(zhuǎn)染由上海吉瑪制藥技術(shù)有限公司設(shè)計并合成了靶向NOD2(shNOD2)和shRNAs陰性對照(shNC)。細胞培養(yǎng)至30%~50%匯合,用siLentFect脂質(zhì)試劑(美國Bio-Rad公司)轉(zhuǎn)染shRNAs。將NOD2的全長序列克隆到pcDNA3.1載體(美國Invitrogen公司)中,構(gòu)建NOD2過表達(簡稱為:NOD2)質(zhì)粒,同時將空載體用作陰性對照(Vec)。當細胞達到大約90%匯合時,用Lipofectamine 2000(美國Invitrogen公司)轉(zhuǎn)染質(zhì)粒。48 h后收獲轉(zhuǎn)染的細胞用于隨后的實驗。
1.4 CCK-8增殖試驗用CCK-8法(美國APExBIO公司)測定CC細胞的增殖能力。將對數(shù)生長期的細胞以1 000個/孔接種到96孔板中,并將10 μl細胞CCK-8溶液添加到每個孔中,然后在37 ℃下孵育2 h。用分光光度計計算450 nm波長處的吸光度,共3次。
1.5 集落形成試驗收集CC細胞,將1×103個細胞接種到6孔板中,并在37 ℃下孵育10 d。去除培養(yǎng)基后,用甲醇固定細胞,并用0.1%結(jié)晶紫染色。然后計數(shù)并記錄集落數(shù)。
1.6 細胞遷移和侵襲分析使用Transwell測定評估細胞遷移和侵襲。將轉(zhuǎn)染后的HeLa、SiHa細胞重懸于不含F(xiàn)BS的培養(yǎng)基中并調(diào)整細胞密度至2×105個/200 μl。然后,將100 μl細胞懸浮液加入Matrigel基質(zhì)膠包被或未包被的Transwell上室(美國BD Biosciences公司)中,并將含有10%血清的500 μl培養(yǎng)基加入到下室中。在37 ℃孵育48 h后,Transwell小室用PBS洗滌3次,細胞用4%多聚甲醛室溫固定30 min,然后用結(jié)晶紫染色30 min,用棉簽輕輕去除室上表面的基質(zhì)膠和細胞。在顯微鏡下計數(shù)滲入Transwell室膜的腫瘤細胞數(shù)。
1.7 5-乙炔基-2′-脫氧尿苷(5-ethynyl-2′-deoxyuridine,EdU)分析將HeLa細胞或SiHa細胞接種到6孔板中,培養(yǎng)24 h。加入EdU溶液(瑞士Roche公司),將細胞培養(yǎng)2 h。用多聚甲醛固定細胞30 min,加入甘氨酸溶液5 min。加入DAPI對細胞核進行染色。將細胞固定并在熒光顯微鏡下拍照。
1.8 Western blot試驗用冷PBS洗滌細胞,然后在冰上用裂解緩沖液孵育30 min,將細胞刮下并收獲。離心后,收集含有裂解物的上清液并于-80 ℃下儲存。通過BCA檢測試劑盒(美國Bio-Rad公司)測定蛋白質(zhì)濃度。將蛋白質(zhì)樣品變性,隨后通過SDS-PAGE分離,并轉(zhuǎn)移到PVDF膜(瑞士Roche Life Sciences公司)上。在脫脂牛奶中孵育1 h后,使用以下一抗(美國Cell Signaling Technology公司)在4 ℃下處理膜過夜:NOD2、AMPK、p-AMPK(Thr172)、mTOR、p-mTOR(Ser2448)、LC3、p62和GAPDH(均1 ∶1 000)。洗滌3次后,將膜與山羊抗小鼠或抗兔HRP偶聯(lián)二抗(1 ∶2 000,美國Cell Signaling Technology公司)一起孵育。通過ECL檢測試劑盒(美國Pierce Biotechnology公司)檢測信號。
1.9 RNA測序(RNA sequence,RNA-Seq)由上海其明信息技術(shù)有限公司進行RNA-Seq分析。提取來自用shNC和shNOD2轉(zhuǎn)染的HeLa細胞的總RNA(n=3)。將高質(zhì)量的RNA樣品轉(zhuǎn)化成cDNA文庫。純化后的產(chǎn)物經(jīng)過12~15輪的PCR擴增,形成最終的cDNA文庫。然后按照制造商的方案在Illumina Hiseq X Ten上對文庫進行測序。倍數(shù)變化>1.5和P<0.05代表差異表達基因(differentially expressed genes,DEGs)。
1.10 GFP-mRFP-LC3檢測自噬體使用GFP-mRFP-LC3慢病毒[和元生物技術(shù)(上海)股份有限公司]評估自噬體。然后在LSM710共聚焦顯微鏡(德國Zeiss公司)下觀察自噬體的定位和定量。自噬體被標記為紅色和綠色(黃色熒光),而自噬溶酶體被標記為紅色。
1.11 動物實驗24只雌性BALB/c裸鼠(6~8周齡,18~20 g)由北京維通利華實驗動物技術(shù)有限公司提供,并在無特定病原體條件下飼養(yǎng)。將小鼠隨機分為4組,每組6只:載體組(Vec組)、NOD2過表達組(NOD2組)、shNC組和shNOD2組。Vec組和NOD2組小鼠尾靜脈注射轉(zhuǎn)染Vec或NOD2的SiHa細胞(1×106個細胞),shNC組和shNOD2組小鼠尾靜脈注射轉(zhuǎn)染shNC和shNOD2的HeLa細胞(1×106個細胞),以構(gòu)建遠處轉(zhuǎn)移模型。通過Xenogen IVIS光譜體內(nèi)成像系統(tǒng)(美國PerkinElmer公司)監(jiān)測肺轉(zhuǎn)移的熒光強度。8周后,解剖裸鼠的肺,計數(shù)肉眼可見的轉(zhuǎn)移結(jié)節(jié)的數(shù)量。

2 結(jié)果
2.1 NOD2與宮頸癌的不良結(jié)局相關(guān)采用基因表達譜交互式分析(GEPIA,http://gepia.cancer-pku.cn/)結(jié)合了基因型-組織表達(GTEx)數(shù)據(jù)集,包括306例宮頸癌患者和13例非癌患者,用于檢測NOD2的mRNA表達,并證明NOD2在CC組織中表達明顯高于正常組織,并且不同分期的CC中NOD2的mRNA表達差異有統(tǒng)計學(xué)意義(P<0.05)(圖1A、B)。使用TCGA數(shù)據(jù)集對生存數(shù)據(jù)的分析揭示,在宮頸鱗狀細胞癌和宮頸腺癌(cervical squamous cell carcinoma,CESC)中,NOD2的高表達與較差的總生存期和無病生存期相關(guān)(圖1C、D)。為了確定NOD2的功能作用,課題組檢測了NOD2在CC細胞(HeLa、SiHa、CaSki和ME-180)和人宮頸上皮細胞系Ect1/E6E7中的表達,結(jié)果顯示NOD2在CC細胞中表達顯著上調(diào),其中與Ect1/E6E7細胞相比,NOD2在HeLa細胞中表達相對較高,在SiHa細胞中表達相對較低(圖1E)。
2.2 NOD2正向調(diào)節(jié)CC細胞增殖根據(jù)NOD2在CC細胞系中的表達譜,將NOD2高表達的HeLa細胞用于沉默NOD2,和低NOD2表達的SiHa細胞中穩(wěn)定過表達NOD2(圖2A)。增殖分析結(jié)果表明,與shNC組相比,shNOD2組HeLa細胞活力(F=9.14,P<0.01)、集落數(shù)、EdU陽性細胞率均顯著降低(t=8.77、10.32,均P<0.01)(圖2B~D);與Vec組相比,NOD2組SiHa細胞活力(F=11.29,P<0.01)、集落數(shù)、EdU陽性細胞率均增加(t=4.81、4.61,均P<0.01)(圖2E~G)。

圖2 NOD2正向調(diào)節(jié)CC細胞增殖 ×50
2.3 NOD2對CC細胞體內(nèi)外轉(zhuǎn)移的抑制作用Transwell侵襲試驗顯示,與shNC組相比,shNOD2組HeLa細胞遷移和侵襲數(shù)均降低(t=4.70、5.54,P=0.003、<0.01)(圖3A);與Vec組相比,NOD2組SiHa細胞遷移和侵襲數(shù)均增加(t=4.66、4.73,P=0.003、0.003)(圖3B)。為了評估NOD2在CC細胞體內(nèi)轉(zhuǎn)移中的功能作用,通過尾靜脈將穩(wěn)定轉(zhuǎn)染的CC細胞注射到裸鼠中以產(chǎn)生肺轉(zhuǎn)移模型。8周后,與shNC組相比,shNOD2組中HeLa細胞的肺定殖、肺轉(zhuǎn)移灶減少(t=4.36、4.52,P=0.009、0.007)(圖3C、D);與Vec組相比,NOD2組中SiHa細胞的肺定殖、肺轉(zhuǎn)移灶增加(t=4.38、3.81,P=0.009、0.015)(圖3E、F)。

圖3 NOD2對CC細胞體內(nèi)外轉(zhuǎn)移的抑制作用
2.4 NOD2調(diào)控AMPK/mTOR信號通路為進一步探索NOD2抑制CC進展的機制,用shNC和shNOD2轉(zhuǎn)染的HeLa細胞中,通過高通量RNA測序(RNA-Seq)進行轉(zhuǎn)錄組分析。在NOD2下調(diào)的HeLa細胞中,451個差異表達的基因(DEGs)上調(diào),892個DEGs下調(diào)。隨后,基因集合富集分析(GSEA )結(jié)果顯示NOD2的表達與AMPK信號激活和mTOR信號抑制顯著相關(guān),表明NOD2在AMPK/mTOR信號中的潛在調(diào)節(jié)作用(圖4A、B)。Western blot試驗分析顯示,與shNC組相比,shNOD2組磷酸化AMPK蛋白的表達水平降低(t=9.05,P<0.01),磷酸化mTOR蛋白的表達水平增加(t=11.59,P<0.01);與Vec組相比,NOD2組磷酸化AMPK蛋白的表達水平增加(t=4.70,P<0.01),和磷酸化mTOR蛋白的表達水平降低(t=9.36,P<0.01)(圖4C)。

圖4 NOD2對CC細胞AMPK/mTOR信號通路的影響
2.5 NOD2通過AMPK/mTOR信號介導(dǎo)CC細胞的自噬激活此外,GSEA結(jié)果顯示,NOD2的表達與自噬調(diào)節(jié)途徑激活、自噬體形成顯著相關(guān),表明NOD2在自噬調(diào)節(jié)中的潛在調(diào)節(jié)作用(圖5A、B)。因此,進一步評估NOD2在自噬調(diào)節(jié)中的功能作用。首先,用GFP-mRFP-LC3轉(zhuǎn)染CC細胞以評估自噬流的形成。與shNC組相比,shNOD2組GFP-mRFP-LC3的點積累減少(t=4.78,P<0.01);與Vec組相比,NOD2的GFP-mRFP-LC3的點積累增加(t=4.52,P<0.01)(圖5C、D)。此外,Western blot試驗分析顯示,與shNC組相比,shNOD2組LC3表達水平減少(t=7.13,P<0.01),p62表達水平增加(t=6.61,P<0.01);與Vec組相比,NOD2組LC3表達水平顯著增加(t=8.43,P<0.01),p62表達水平減少(t=8.75,P<0.01)(圖5E)。
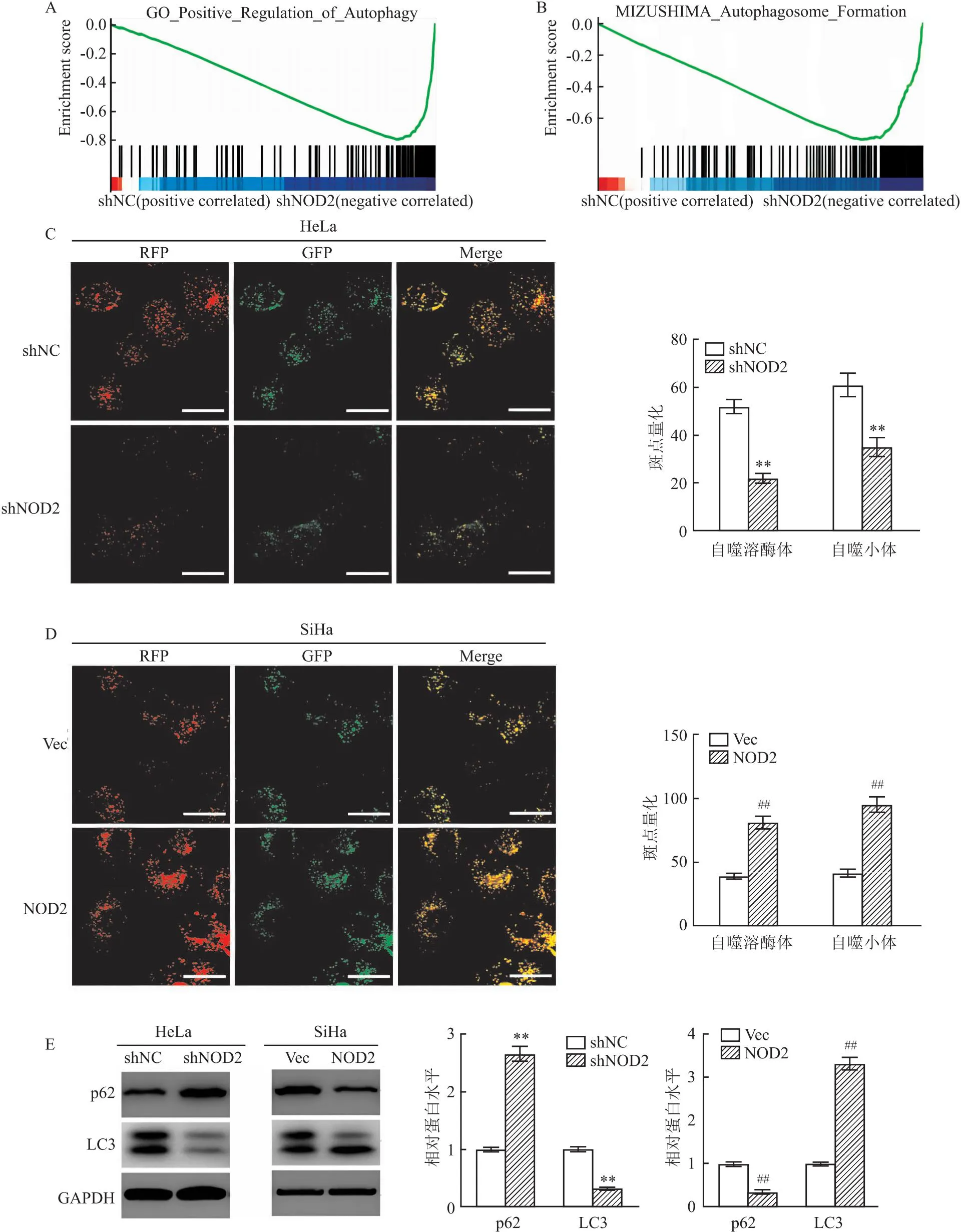
圖5 NOD2通過AMPK/mTOR信號介導(dǎo)CC細胞的自噬激活
3 討論
近年來,盡管CC的臨床治療取得了進展,但預(yù)后仍不令人滿意[9]。因此,迫切需要確定更可靠的治療靶點并闡明其對CC進展的影響。本研究使用一系列體外和體內(nèi)功能喪失和獲得實驗證明了NOD2在抑制CC進展中的作用。首先,對在線數(shù)據(jù)庫的分析顯示NOD2在CC組織中上調(diào),并且NOD2的表達水平與較差的預(yù)后相關(guān)。使用各種功能實驗來評估NOD2在CC細胞的增殖、遷移和侵襲中的作用。NOD2顯示出惡性表型。一系列功能獲得實驗證實NOD2在促進CC進展中的作用,顯示NOD2可以通過激活A(yù)MPK/mTOR/自噬信號傳導(dǎo)促進CC細胞進展。
轉(zhuǎn)移性和復(fù)發(fā)性CC是高度難治的腫瘤,治療具有挑戰(zhàn)性。先前的研究[10]表明,幾種PRRs與CC的發(fā)展有關(guān)。PRRs的NLR家族已在宿主免疫防御中得到鑒定,其成員NOD2廣泛表達于女性生殖器官,包括子宮內(nèi)膜、輸卵管、子宮頸和外子宮頸[8]。NOD2在CC的發(fā)展中起重要作用,其失調(diào)推動宮頸上皮內(nèi)瘤變發(fā)展為CC[11]。研究[8]中,與正常子宮頸相比,CSCC組織中檢測到較高水平的NOD2,尤其在LVSI、淋巴結(jié)轉(zhuǎn)移和低分化腫瘤中特別高表達,并與較差的生存率相關(guān)。本研究中,與Ect1/E6E7細胞相比,NOD2在CC細胞中表達顯著上調(diào)。這與在結(jié)腸癌轉(zhuǎn)移和乳腺癌細胞系中觀察到的NOD2表達增加一致[12-13]。隨后,體外功能獲得和喪失實驗強調(diào)了NOD2在促進CC細胞增殖、遷移和侵襲中的重要作用。尾靜脈注射模型顯示,NOD2過表達導(dǎo)致CC細胞體內(nèi)遠端器官的轉(zhuǎn)移率增加。這些體內(nèi)和體外結(jié)果表明,特異性靶向NOD2的shRNAs可以有效抑制CC生長和轉(zhuǎn)移。然而,NOD2促進CC進展的潛在機制尚未完全研究。
為進一步探索NOD2促進CC進展的機制,在用shNC和shNOD2轉(zhuǎn)染的HeLa細胞中,通過RNA-Seq進行轉(zhuǎn)錄組分析顯示NOD2的表達與AMPK信號激活和mTOR信號抑制顯著相關(guān),表明NOD2在AMPK/mTOR信號中的潛在調(diào)節(jié)作用。研究[14]顯示,AMPK/mTOR信號通路激活可誘導(dǎo)癌細胞自噬和自噬性死亡,從而促進腫瘤的發(fā)生和發(fā)展。例如,Liu et al[15]報道BDH2通過抑制PI3K/AKT/mTOR信號傳導(dǎo)抑制腫瘤進展。Tang et al[16]表明沉默AMPK/mTOR信號通路抑制GBM的進展。另一項研究[17]表明,鹽霉素可以通過增加活性氧的產(chǎn)生,從而激活PI3K/AKT/mTOR和ERK/p38 MAPK信號通路,促進細胞自噬。本研究中,NOD2的表達與AMPK信號激活和mTOR信號抑制相關(guān),表明NOD2在AMPK/mTOR信號中的潛在調(diào)節(jié)作用。因此,癌細胞利用NOD2的細胞保護能力來創(chuàng)造促進癌細胞存活的微環(huán)境。
自噬是一種溶酶體依賴的分解代謝途徑,通過該途徑清除受損或衰老的細胞器。自噬在調(diào)節(jié)癌癥進展和確定腫瘤細胞對化療誘導(dǎo)的應(yīng)激的反應(yīng)中起重要作用[10]。然而,自噬在癌癥治療中的作用是多方面的,取決于細胞類型、微環(huán)境和腫瘤發(fā)展的階段[18]。迄今為止,已經(jīng)描述了細胞保護性和細胞毒性功能形式的自噬,其中細胞保護性自噬在對化療的反應(yīng)中更為頻繁[7]。一系列證據(jù)表明,自噬通過促進癌細胞存活、細胞增殖、EMT以及耐藥性,在惡性腫瘤的發(fā)生發(fā)展中發(fā)揮細胞保護作用[19]。AMPK/mTOR信號的激活已被證明與自噬激活相關(guān)[17]。本研究證實NOD2的表達與自噬調(diào)節(jié)途徑、自噬體形成顯著相關(guān),表明NOD2在自噬中的潛在調(diào)節(jié)作用。
綜上所述,這項研究表明,NOD2可能通過AMPK/mTOR信號促進CC增殖、遷移和侵襲,其作用機制部分涉及自噬激活。因此,靶向NOD2可能是治療CC的有前途的治療靶點。

