血紅素加氧酶-1通過誘導抗病毒蛋白的表達增強IFN-α抗HBV效應
笪 蔚,王 琴,魏安邦,張 浩, 汪任冰,劉 倩,周 強
乙型肝炎病毒(hepatitis B virus, HBV)是DNA病毒科中一種嗜肝的、帶包膜的、部分雙鏈的 DNA病毒[1]。HBV感染是一個重要的全球性健康問題,據世衛組織估計,全球有2.57億人長期感染HBV,每年約有88.7萬人死于與HBV相關的并發癥[2]。血紅素加氧酶1(heme oxygenase-1, HO-1)是血紅素降解的關鍵酶,打開血紅素的卟啉環,并釋放等摩爾量的游離鐵、綠膽素(biliverdin, BV)和一氧化碳(carbon dioxide, CO)。HO-1是一種重要的應激反應蛋白,它具有抗氧化、抗凋亡和抗炎的作用,在生理和病理條件下均對機體起保護作用,也被認為是一種細胞保護酶[3];在過去的10年中,HO-1已被成功探索出對多種病毒的抗病毒作用,并且對包膜病毒有選擇性,能引起病毒包膜的破壞和解離;如HIV、HCV、HBV、流感、登革熱、埃博拉、呼吸道合胞病毒、人類單純皰疹病毒等[4];被認為是包膜病毒的通用殺病毒劑。在HBV感染中,Protzer et al[5]證明了HO-1可以通過降低HBV核心蛋白的穩定性,直接抑制HBV在肝細胞中的復制,從而抑制HBV核心共價閉合環狀DNA(HBV cccDNA)的產生,可見HO-1的誘導可能是治療乙型肝炎相關炎癥的新選擇,需要進一步研究其抗病毒機制,該研究旨在探究HO-1能否聯合現有的抗HBV藥物IFN-α來發揮更強的抗病毒作用。
1 材料與方法
1.1 實驗試劑HepG2、HepG2.2.15購自上海富源生物公司;HBV 1.3由安徽醫科大學第二附屬醫院檢驗科留存;si-HO-1質粒、TRIzol、引物序列購自上海生工生物公司;DMEM、PBS購自上海培源生物科技公司;胎牛血清購自南京維森特生物技術有限公司;0.25%胰酶消化液、CCK-8試劑、雙抗、RIPA 裂解液、BCA蛋白濃度檢測試劑盒購自上海碧云天生物有限公司;磷酸酶抑制劑購自上海陶術生物科技;HO-1抗體、MxA抗體購自英國 Abcam公司;p-IRF-3、IRF-3抗體、抗IRF-9、抗GAPDH、山羊抗兔(H+L) HRP和山羊抗鼠(H+L) HRP購自美國Affinity公司;Lipofectamine3000轉染試劑購自美國ThermoFisher公司;ECL底物發光試劑盒購自中國武漢Abbkine公司;RNA反轉錄試劑盒、熒光染料SYBR購自上海ToloScript公司。
1.2 實驗藥物Hemin(批次號:52180;純度>96%)購自美國sigma公司,Hemin用氫氧化鈉標準溶液充分溶解配成10 mmol/L的母液,-20℃保存;在實驗前用配制好的細胞培養基稀釋母液至所需使用的濃度。
1.3 實驗方法
1.3.1細胞培養與轉染 HepG2、HepG2.2.15 細胞培養:向DMEM培養基中加入10%FBS和1%的雙抗配制成新鮮培養基,對于HepG2.2.15細胞每100 ml培養基中加入320 ng遺傳霉素G418,然后在5% CO2、37 ℃培養箱里培養,待細胞生長至90%時,用胰酶消化2 min,1 ∶2傳代培養。等細胞長到對數期進行均勻鋪板,等細胞融合至60%~70%,用新鮮培養基換液后對細胞進行藥物處理48 h后進行qRT-PCR、Western blot 檢測,或進行siRNA轉染24 h,用藥物處理48 h后再進行qRT-PCR、Western blot 檢測。
1.3.2CCK-8實驗 將細胞株進行傳代,離心后用配制的細胞培養基重懸,進行細胞計數,以5×103個/孔的密度鋪進96孔板中。待細胞貼壁后,加入不同濃度的Hemin(0、5、10、20、50、75、100 μmol/L)置于37 ℃培養箱培養孵育6 d,每3 d換液1次。到待測時間后,以1 ∶10的比例將CCK-8試劑和提前配制的培養基混合,吸盡培養基,加入配好的溶液,1 h后酶標儀檢測450 nm處的吸光度值。
1.3.3HBV相關指標定量檢測 收集HepG2-HBV1.3經過藥物處理48 h及轉染小干擾RNA(Si RNA)24 h后再經過藥物處理后的細胞上清液;收集HepG2.2.15細胞經過不同藥物處理2、4、6 d 后的細胞上清液,用美國雅培全自動化學發光分析儀i4000SR檢測上清液中的乙肝表面抗原(HBsAg)、乙肝e抗原(HBeAg)。
1.3.4實時定量PCR分析 通過使用兩步逆轉錄聚合酶鏈式反應定量分析來測量基因表達。通過TRIzol提取總RNA,在260 nm處評估提取的RNA的濃度;然后逆轉錄為cDNA,GAPDH被用作定量的內參,引物設計序列見表1。然后進行RT-qPCR測定,反應條件:95℃預變性30 s,40個循環包括95 ℃、10 s,60 ℃、30 s,測定HO-1、IFN-β的mRNA表達水平。

表1 引物序列
1.3.5蛋白免疫印跡實驗 加入裂解緩沖液(PIPA ∶PMSF ∶磷酸酶抑制劑=100 ∶1 ∶1)以裂解細胞并獲得全細胞蛋白質裂解物。4℃離心去沉淀后,吸出細胞上清液。用BCA進行蛋白定量。隨后以1 ∶4比例加入SDS-PAGE蛋白上樣緩沖液,在100 ℃沸水的水浴鍋中水浴10 min使蛋白質變性,隨后將蛋白質信息轉至PVDF膜上,轉膜結束后,進行切膜,切分成所需的分子量條帶,再將條帶都放入快速封閉液中封閉1 h。封閉結束后多次洗膜。置條帶于HO-1抗體(兔源單抗1 ∶2 000)、MxA抗體(兔源單抗1 ∶1 000)、p-IRF-3(兔源單抗1 ∶1 000)、IRF-3抗體(兔源單抗1 ∶1 000)、IRF-9抗體(兔源單抗1 ∶1 000)、GAPDH(鼠源多抗1 ∶5000)一抗稀釋液中,搖床上4℃慢搖過夜,再用TBST緩沖液洗膜5次,每次5 min;根據一抗來源不同,分別放入山羊抗兔或鼠的二抗(1 ∶5 000)中室溫下孵育1 h,然后再TBST緩沖液洗膜;顯影液1 ∶1配制,滴于膜上,置于化學發光成像儀內顯影。

2 結果
2.1 Hemin誘導HO-1的表達實驗中選擇了不同濃度Hemin作用于兩種細胞系2 d誘導HO-1,結果顯示,HO-1的表達水平以劑量依賴的方式增加(圖1)。為了測定Hemin藥物的細胞毒作用,通過CCK-8法對HepG2、HepG2.2.15細胞進行細胞毒性檢測。結果顯示,濃度在5~50 μmol/L之間的Hemin持續作用細胞6 d后,對細胞不產生殺傷作用;而濃度在75 ~ 100 μmol/L之間的Hemin處理細胞會對細胞產生細胞毒作用(圖2)。
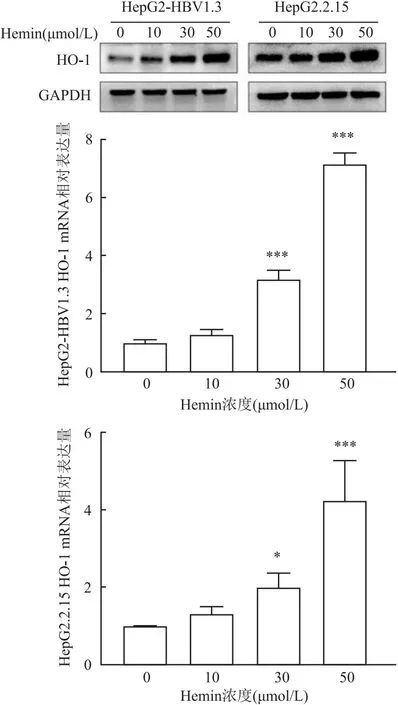
圖1 不同濃度Hemin對HO-1的誘導
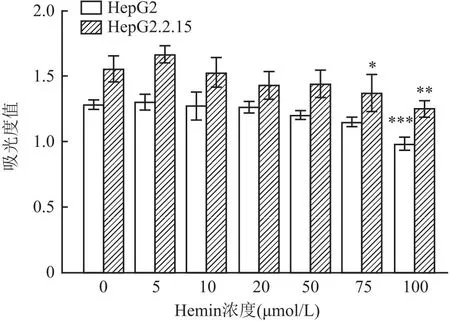
圖2 不同濃度的Hemin對HepG2、HepG2.2.15的生長抑制程度
2.2 HO-1對HBV的體外抗病毒活性實驗結果顯示不同濃度Hemin處理HepG2.2.15細胞組的HBV-DNA、HBeAg、HBsAg與對照組相比表達降低(圖3A),并與Hemin濃度成反比,當50 μmol/L Hemin濃度作用細胞時,對HBV-DNA、HBeAg有明顯的抑制作用,差異有統計學意義(F=24.19,P<0.001;F=33.37,P<0.001),而對HBsAg的抑制沒有HBV-DNA、HBeAg明顯;對HepG2-HBV1.3細胞同樣表現出HBV-DNA、HBeAg降低的抗病毒效應(圖3B),當50 μmol/L Hemin濃度作用細胞時同樣表現更明顯的抗病毒效應(F=92.68,P<0.001;F=53.61,P<0.001)。
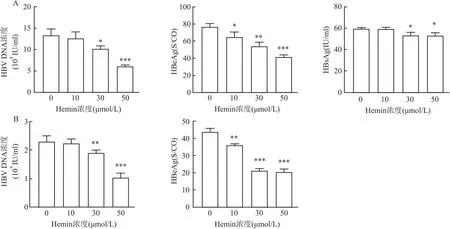
圖3 HO-1體外抗病毒效應
2.3 HO-1通過增強I型干擾素反應來發揮抗HBV作用不同濃度Hemin作用于HepG2-HBV1.3、HepG2.2.15細胞2 d,圖4顯示Hemin以劑量依賴的方式增強了IFN-β的mRNA表達以及HO-1、IRF-3、IRF-9及下游抗病毒蛋白MxA的表達;在50 μmol/L Hemin濃度作用下IFN-β的表達量明顯增高,差異有統計學意義(HepG2-HBV1.3:F=122.68,P<0.001;HepG2.2.15:F=289.3,P<0.001)(見圖4)。
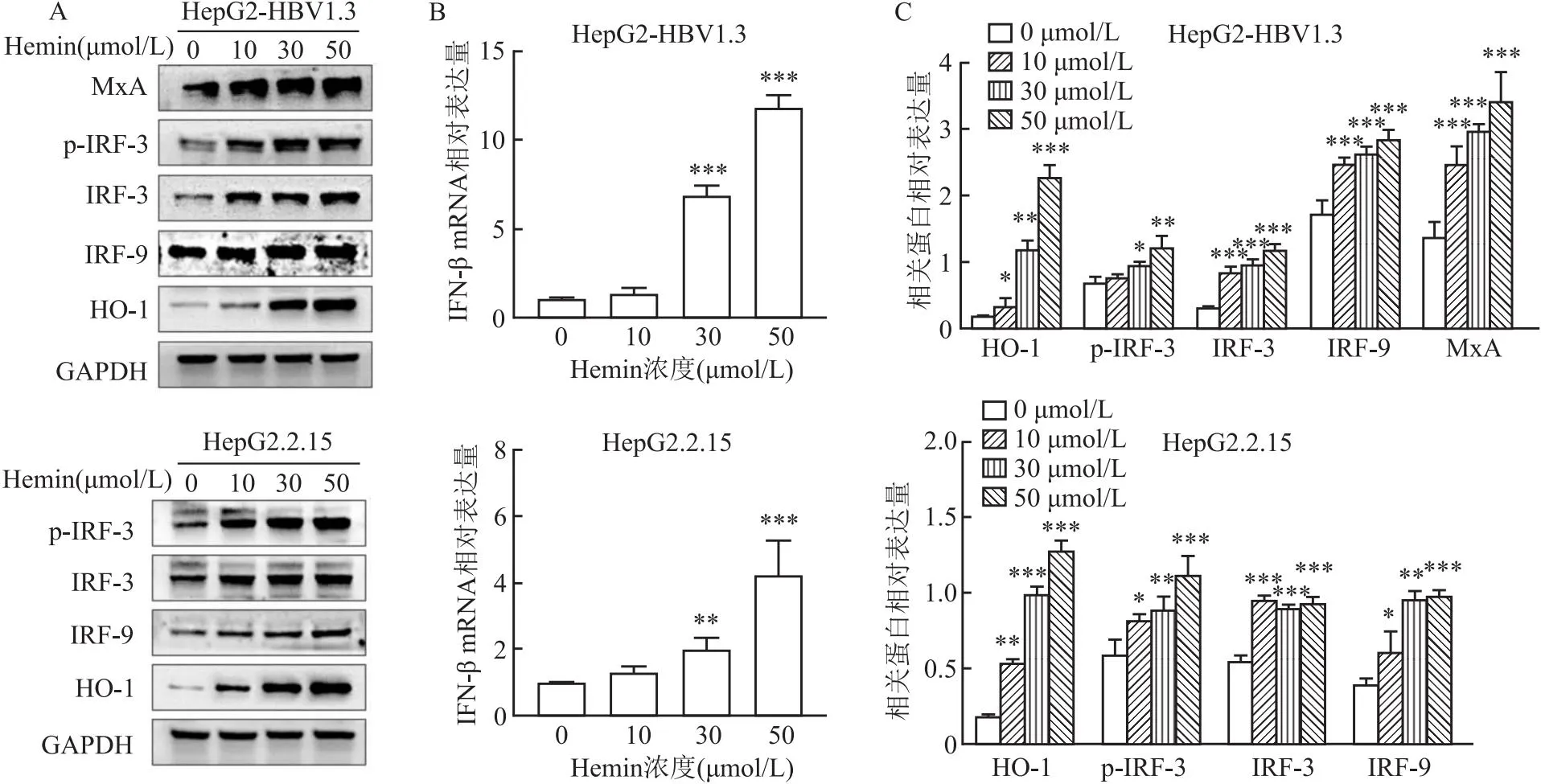
圖4 Hemin誘導HO-1增強IFN反應
2.4 Si-HO-1可以逆轉HO-1發揮的抗病毒作用為了確定HO-1誘導的I型干擾素上調和抗病毒作用是否涉及HO-1,設計HO-1 siRNA(si-HO-1)或NC-siRNA(si-NC)轉染HepG2-HBV1.3細胞后,再用Hemin刺激誘導;不做處理的為空白對照組,Hemin誘導的為陰性對照,結果表明,與si-NC和陰性對照組相比,si-HO-1處理組的HBsAg、HBeAg的表達有所增高;HO-1、IFN-β的mRNA表達降低,IRF-3、IRF-9及下游的抗病毒蛋白MxA的分子表達均有所下降,說明si-HO-1處理組在一定程度上逆轉了Hemin抗病毒作用(圖5)。
2.5 HO-1可以增強IFN-α的抗病毒效應IFN是一種具有免疫調節和抗病毒作用的細胞因子,是臨床治療慢性乙型肝炎的首選藥物之一;可以通過誘導具有抗病毒特性的ISG來增強免疫功能。然而,IFN治療有一些局限性,如成本過高、停藥后的反彈,大量患者在長期使用后出現耐藥性等副作用。因此,為進一步證明了HO-1聯合現有的IFN-α發揮更強的抗病毒作用,設計Control、Hemin、IFN-α和Hemin+IFN-α組分別作用2、4、6 d,實驗結果顯示聯合用藥組發揮更強的抗病毒作用,第6天時HBsAg、HBeAg較第2、4天更明顯,HBV-DNA也表現出相似的結果,可見聯合作用抗病毒效應與時間有相關性(圖6)。
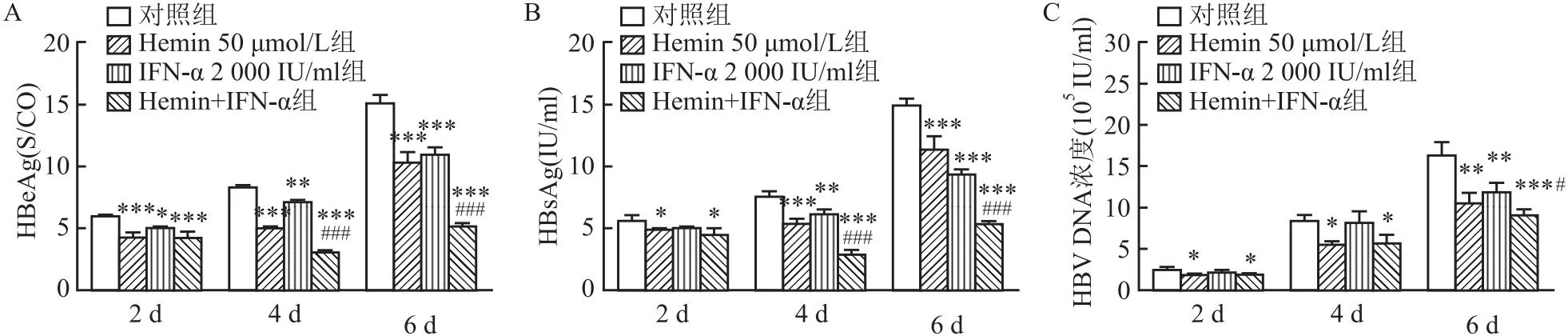
圖6 Hemin與IFN-α聯合作用于HepG2.2.15細胞的抗病毒效應
3 討論
乙型肝炎病毒是世界范圍內最常見的慢性病毒病原體,是已知最小的引起人類致病的DNA病毒之一,約3.2 kb,可通過血液或人體分泌物進行傳播。病毒通過獨特的HBV pgRNA中間體進行復制,最終在核內轉化為共價閉合 DNA(cccDNA),利用不同的啟動子,轉錄出4種mRNA,編碼多種不同病毒蛋白(HBsAg、HBeAg、HBcAg、RT等)并逆轉錄出 HBV DNA[6]。HBV標志物是評估 HBV 感染、肝炎和其他疾病不可或缺的工具。HBV-DNA、HBsAg和HBeAg是最常用的診斷HBV感染及預測治療期間病情復發和確定何時結束治療的有效血清標志物[7]。
HBV感染細胞后,會激活機體先天免疫系統,宿主細胞釋放IFNs,IFNs介導的抗病毒作用及其重要。IFNs是一種分泌型蛋白,可以由細胞識別不同病原菌后產生。IFNs與細胞表面的受體結合,開始激活JAK-STATs通路;磷酸化的信號轉導轉錄激活因子1/2(signal transducer and activator of transcription1/2,STAT 1/2)與干擾素調節因子-9 (interferon regulatory factor-9,IRF-9)結合,形成復合物干擾素刺激基因因子-3 (IFN-stimulated gene factor-3,ISGF-3);進一步,ISGF-3與核內干擾素刺激反應元件結合,誘導一系列干擾素刺激基因的表達,如抗黏液病毒蛋白A(MxA)、2′,5′-寡腺苷酸合成酶(2′,5′-Oligoadenylate synthetase,OAS)、雙鏈RNA依賴的蛋白激酶(double-stranded RNA-dependent protein kinase,PKR);這些干擾素刺激基因通過多種機制在病毒復制的不同的階段阻止病毒的復制[8]。IFN-JAK-STAT軸是經典的抗HBV信號通路;在病毒感染之前或期間激活,增強先天免疫反應從而增強IFN的表達將有助于提高宿主對抗病毒的能力。因此誘導或恢復I型IFN產生和相應抗病毒反應的方法可能增強抑制宿主中的HBV復制。已知HO-1廣譜抗病毒作用主要涉及3個方面:HO-1及下游產物直接抑制病毒復制、增強宿主細胞I型IFN反應間接抑制病毒復制、抑制病毒感染引發的炎癥損傷[9];實驗結果表明,HO-1有效地抑制了HBV DNA、HBeAg、HBsAg的表達,HO-1對HBeAg的抑制能力強于HBsAg,這可能與HO-1及其產物可以直接抑制HBV的核心蛋白及cccDNA相關[5]。研究[10]顯示通過激活HO-1介導的I型IFN反應在抑制病毒復制中發揮重要作用。實驗結果也顯示Hemin處理組的IFN-β也呈現高表達;不同濃度的Hemin不僅劑量依賴性誘導HO-1并且劑量依賴性誘導JAK-STAT通路中的IRF-9、MxA;但對于HepG2.2.15細胞來說,MxA在此細胞系中表達并不明顯,這可能與外源性的病毒基因組的整合,導致細胞系的基因組重排和染色體變異有關,從而影響基因的表達相關[11];而在瞬時轉染HBV-1.3的HepG2細胞中,MxA可以被輕易誘導。除了已被證明的HO-1及其產物可以通過降低HBV核心蛋白穩定性從轉錄層面直接抑制病毒復制,猜測HO-1的另一部分抗病毒作用可能是通過激活IFN-JAK-STAT軸來誘導ISG來發揮的。Lazear et al[12]研究認為IRF-3對響應病毒感染產生I型IFN和IFN刺激基因(ISG)至關重要。MA et al[13]也證明了IRF-3上有HO-1的特異性受體,HO-1可以與IRF-3特異性結合,并能促進其進入細胞核進行磷酸化誘導I型干擾素的產生來激活JAK-STAT通路。這表示HO-1可通過與IRF3的相互作用對IFN-β誘導來發揮抗病毒作用。
本實驗中,si-HO-1組能逆轉Hemin處理組HO-1誘導的抗病毒效應及相關分子的表達;并且si-HO-1組IFN-β mRNA表達也低于Hemin誘導組,推測Hemin發揮的抗HBV效應是通過HO-1來實現的;但是否也存在依賴IRF-3磷酸化及核轉位誘導I型IFN有待進一步研究。
HO-1不僅可以發揮一定的抗病毒作用,在細胞的抗炎、抗氧化、抗凋亡等細胞保護作用方面也被廣泛研究。研究較多的是Nrf2/HO-1信號通路,揭示了HO-1在減輕氧化應激和組織保護中發揮作用[14]。HO-1誘導的細胞損傷保護作用和多重抗病毒能力的結合,讓HO-1成為一個潛在的臨床抗HBV藥物。再者HO-1相關的誘導劑(如血紅素、環氧合酶抑制劑、他汀類藥物或雷帕霉素等)已是被批準用于治療人類疾病的藥物[15]。實驗結果表明聯合Hemin與現有的抗HBV藥物IFN-α發揮出更好的抗HBV作用,值得注意的是,本身實驗結果顯示,在HepG2.2.15細胞系中,低濃度的IFN-α在不同時間作用下并不能降低HBsAg、HBeAg、HBV-DNA的表達,后期實驗使用高濃度的IFN-α作用于HepG.2.15細胞表現出了抗病毒性。低濃度的IFN-α在體內能發揮抗病毒作用得益于人體強大的免疫調節功能,離開機體后,缺乏這種先天免疫,很難發揮抗病毒效應[16],有研究[17]顯示HBV的抗原或其核心蛋白等能夠抑制重要的抗病毒蛋白MxA來拮抗IFN-α的抗病毒作用。而HO-1與IFN-α聯合作用時,HO-1能夠降低核心蛋白的穩定性的表達,可能在一定程度上恢復了IFN-α的抗病毒活性,聯合作用時發揮了更強的抗病毒作用。
綜上所述,本研究闡明了Hemin誘導的HO-1表達與HBV復制之間的相關性。HO-1的上調以劑量依賴的方式抑制HBV-DNA復制及HBsAg、HBeAg的分泌,可能是通過促進IRF-3的磷酸化來增加I型干擾素的表達從而激活JAK-STAT通路來發揮抗病毒效應;并且聯合現有的抗病毒藥物IFN-α能發揮更強的抗病毒作用,HO-1具有顯著的治療潛力,可能有助于肝炎患者的治療,但需要進一步研究。

