谷氨酰胺轉氨酶催化交聯對肌原纖維蛋白凝膠特性影響的研究進展
張靖銘,馮旸旸,時平茹,孔保華,曹傳愛,王 輝,劉 騫
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
肌原纖維蛋白(myofibrillar protein,MP)是肉蛋白中最重要的組成部分,約占總蛋白質含量的55%~60%,其在熱處理條件下會通過非共價相互作用和共價交聯形成有序的三維網狀的凝膠基質,賦予肉制品良好的保水、保油特性和感官特性[1]。隨著人們對高品質肉制品需求的不斷增加,研究人員正在努力提高MP的凝膠特性,包括持水性、硬度、彈性、致密性等。考慮到非共價相互作用的鍵能較低,反應通常是不穩定和可逆的[2],而共價交聯在理想情況下能達到電子飽和的狀態,形成的化學結構更為穩定和堅固,因此研究MP的共價交聯具有更深遠的意義。
谷氨酰胺轉氨酶(transglutaminase,TGase)能夠催化蛋白質多肽鏈中谷氨酰胺殘基的γ-羧酰胺基與賴氨酸殘基的ε-氨基發生共價交聯,產生ε-(γ-谷氨酰胺)賴氨酸鍵,增強蛋白分子內或分子間的共價交聯(圖1),其交聯度(degree of cross-linking,DCL)對蛋白質的凝膠特性起到決定性作用[3]。DCL首先取決于底物蛋白質的種類,不同的蛋白質對TGase表現出不同的親和性,MP頭部的肌球蛋白中含有豐富且充分暴露的賴氨酸和谷氨酰胺殘基,使其成為TGase作用的良好底物[4]。目前已有大量學者研究了TGase的共價交聯對MP凝膠特性的影響,他們發現,該酶通過降低α-螺旋含量和增加β-折疊含量,顯著改變了MP的二級結構,使其形成了大分子聚合物[5-7]。這些結構的變化使MP的熱誘導凝膠具有更強的凝膠強度,且在一定范圍內DCL與凝膠強度呈現明顯的正相關性[8]。有研究證明,提升的凝膠強度也賦予肉制品更優越的硬度、彈性、黏結性和咀嚼性等質構特征[9-10]。同時,由于凝膠結構變化減少了風味前體物質的損失,產品會表現出更加突出的風味特征[11]。此外,有研究表明隨著DCL增加,肌球蛋白的水解增強,消化物中存在生物活性肽的可能性也增加[12]。
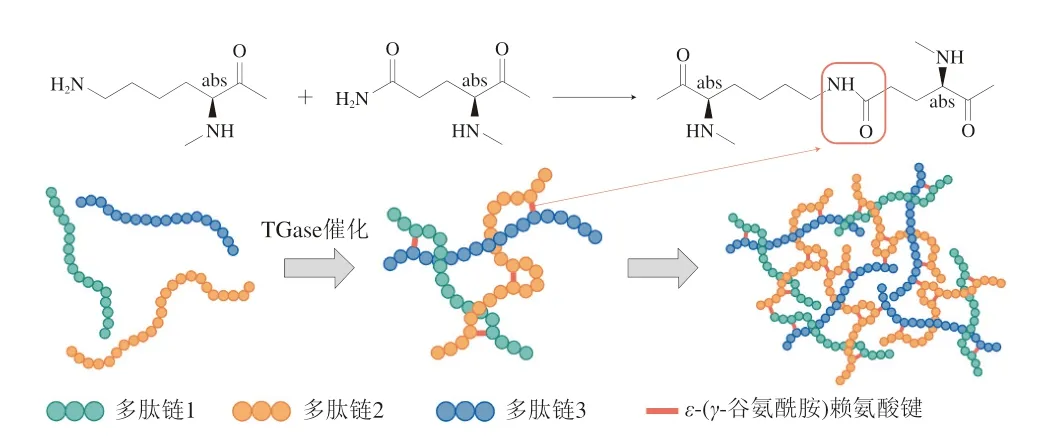
圖1 TGase催化共價交聯過程Fig.1 Covalent cross-linking process catalyzed by TGase
現階段對于TGase催化共價交聯改善MP凝膠特性的研究已經趨于完善,然而在實際應用方面還存在著一些亟待解決的問題,如TGase催化交聯會增強蛋白質-蛋白質的相互作用而抑制蛋白質-水的相互作用,導致凝膠的持水性降低[13],在產品中表現出較大的蒸煮損失。因此,近年來研究者開始關注外源添加物和新型加工技術協同TGase對MP凝膠特性的影響,但現有文獻對其影響DCL的情況和機制缺乏歸納總結。本文詳細介紹了TGase催化MP-DCL測定和表征方法,通過分析其影響因素揭示TGase改善MP凝膠品質的內在機制,并綜述了外源添加物或新型加工技術協同TGase對MP凝膠特性的影響及分子作用機制,為后續TGase在現代肉制品工業中的應用提供理論參考。
1 DCL的表征及其影響因素
1.1 DCL的測定和表征
目前國內外對于表征TGase催化效果的DCL的測定方法如表1所示。ε-(γ-谷氨酰胺)賴氨酸鍵是TGase催化MP共價交聯過程中形成的一種異肽鍵,其含量的多少直接表明了DCL的數量多少。同時,因為MP中的游離氨基參與異肽鍵形成,所以游離氨基含量的降低可間接反映ε-(γ-谷氨酰胺)賴氨酸鍵的增加,即DCL增加,可用下式表示[8]。此外,大分子聚集物的形成或肌球蛋白重鏈(myosin heavy chain,MHC)的減少也可以表示DCL的增加。
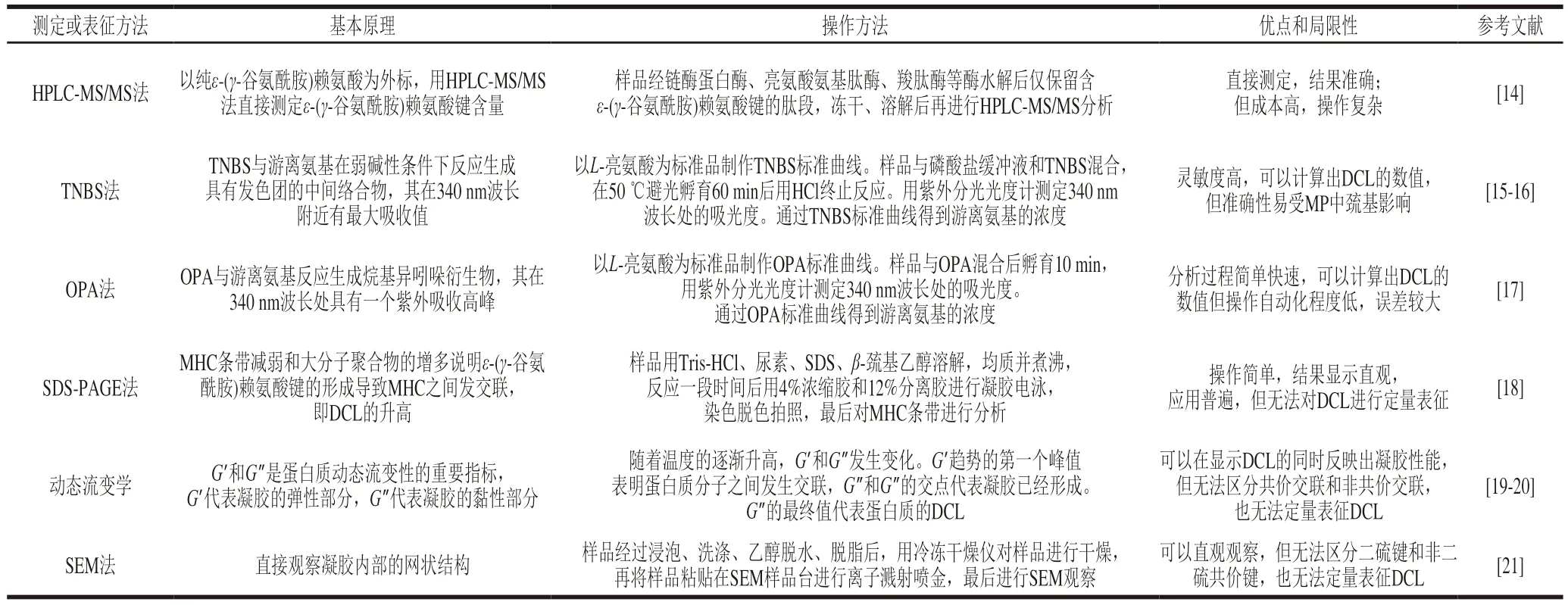
表1 DCL的測定和表征方法Table 1 Summary of methods for determination and characterization of DCL
式中:a表示酶處理前游離氨基含量;a′表示酶處理后游離氨基含量。
1.2 DCL的影響因素
TGase作為一種蛋白質交聯酶,其催化MP共價交聯的過程符合酶促反應動力學,因此DCL受內部因素和反應環境的制約,其中內部因素包括酶濃度、底物濃度和底物結構,反應環境包括溫度、時間和離子強度(圖2)。
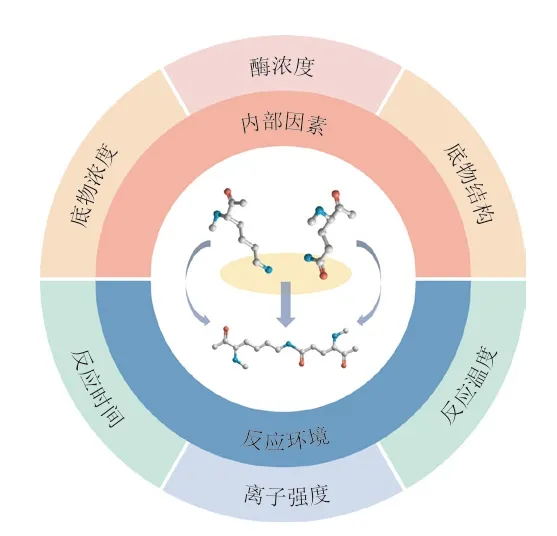
圖2 TGase催化MP交聯的影響因素Fig.2 Factors influencing MP cross-linking catalyzed by TGase
1.2.1 酶濃度和底物濃度
在酶促反應中,酶濃度和底物的濃度是限制反應速率的最主要因素。研究發現,TGase添加量的增加使MP的G′值顯著增大,其原因是當TGase添加量較低時,只有少部分MP分子能夠產生交聯,當TGase添加量充足時,MP分子之間才會充分交聯[22]。同時,楊明柳等[23]研究發現SDS-PAGE圖譜中MHC帶隨TGase添加量的增加逐漸減弱,同樣說明了DCL隨TGase添加量的增加而增加。但值得注意的是,由于MP中的谷氨酰胺和賴氨酸殘基含量有限,所以DCL并不是隨著TGase添加量的增加而無限增加[24]。
1.2.2 底物結構
氧化會改變MP結構,進而影響MP分子內及分子間的共價交聯。Li Chunqiang等[25]研究發現經TGase處理的輕度氧化MP的DCL為87.6%,未氧化MP的DCL為64.7%,而過度氧化MP的DCL僅為33.8%,說明輕度氧化有利于增加DCL,使MP形成更致密、均勻的三維網絡凝膠結構。這可能是因為輕度氧化時,MP分子中有少量巰基轉化為二硫鍵使蛋白質聚集,拉近了谷氨酰胺和賴氨酸殘基的距離而促進TGase的催化反應[26]。
1.2.3 反應溫度
一方面,溫度的變化會導致MP結構發生變化,研究表明肌球蛋白頭部在30~50 ℃時開始聚集,50~60 ℃時形成較大的球狀聚集體[27];另一方面,溫度還會影響酶的活性,TGase作用的溫度范圍為4~65 ℃,最適溫度為45~55 ℃[28]。Shi Yafang等[29]研究了TGase在30~90 ℃條件下作用20 min對DCL及MP凝膠特性的影響,結果表明,在40 ℃條件下,TGase的交聯能力最強并對MP凝膠的質構特性具有最明顯的提升效果。
1.2.4 反應時間
根據溫度的不同,酶的作用時間也不相同,TGase催化常用的有4 ℃低溫長時間交聯和40 ℃短時間孵育兩種方式,其中40 ℃孵育因為短時高效而得到更廣泛的關注。郭秀瑾等[30]在酶添加量10 U/g、反應溫度40 ℃條件下研究不同MP凝膠化時間對DCL的影響,發現前4 h內MHC含量逐漸下降且MP凝膠的微觀結構越來越規則和致密,證明隨著反應時間的延長,DCL逐漸增加。Fang Mengxue等[31]也發現在酶添加量9 U/g、40 ℃的條件下反應0 h時,DCL為18.52%,隨著反應時間延長至2 h和12 h,DCL分別增加至34.76%和62.87%。不同TGase催化時間形成的不同DCL的MP凝膠微觀結構如圖3所示。

圖3 不同DCL的MP凝膠微觀結構[31]Fig.3 Microstructure of MP gels with different DCL[31]
1.2.5 離子強度
溶液離子強度的變化會改變環境的pH值,研究發現在25 ℃、100 U/g條件下,TGase催化的MP凝膠在酸性環境中強度較低,在弱堿性環境中強度相對較高,pH 8.5時凝膠強度最大[32]。同時,因MP具有鹽溶特性,高鹽離子濃度能夠促使MP結構展開,增加TGase對谷氨酰胺和賴氨酸殘基的可及性,提高DCL[26]。此外,研究發現Ca2+具有激活TGase的作用,能夠增加DCL,使MP凝膠品質增強,微觀結構緊密、均勻,空洞孔洞少;但是過高的Ca2+含量則會導致過度交聯,導致MP凝膠強度、彈性下降[33]。
2 外源添加物與TGase協同對DCL和MP凝膠特性的影響
在過去的研究和實際生產中,許多外源添加物已被開發并用于MP改性,包括多酚、堿性氨基酸、親水膠體、淀粉和非肉蛋白等。但由于大多數的外源添加物都是通過非共價相互作用修飾MP結構以改善其凝膠特性,作用相對有限且不穩定,因此近年來研究者們開始關注外源添加物與TGase的協同作用。本節對這些不同外源添加物與TGase協同催化MP交聯的效果及其分子作用機制綜述如下。
2.1 多酚
多酚是一類從植物中提取的天然小分子化合物,具有很強的自由基清除能力和抗氧化活性,因此通常作為功能性食品添加劑應用到肉制品中。多酚具有特殊的結構和特性,能夠與MP發生可逆或不可逆的相互作用,并以劑量依賴的方式誘導MP聚集,從而改變MP的氨基酸側鏈基團、功能和形態性質[34]。較低濃度的多酚能有效提高MP的交聯程度,而高濃度的多酚會由于“氨基-醌”“巰基-醌”等相互作用發生過度交聯,破壞MP的二、三級結構,導致MP聚集不均勻,形成較差的三維凝膠網絡,凝膠強度降低[35]。TGase催化MP發生共價交聯的特性可以很好地彌補多酚的劣勢,因此有研究者將二者復配應用于MP體系中,研究其協同作用對DCL和MP凝膠特性的影響。
Zhang Daojiu等[36]研究了TGase協同原花青素B2(proanthocyanidin B2,PCB2)對MP凝膠特性的影響,結果表明PCB2通過與MP中的巰基結合而轉化為醌-巰基配合物,能夠在一定程度上提升DCL,進而促進更加致密的MP凝膠三維網絡結構的形成,提高了MP凝膠特性。但值得注意的是,PCB2和TGase協同作用所產生的大分子聚集物會導致MP溶解度的降低。Chang Jinyang等[37]研究了TGase與綠原酸(chlorogenic acid,CA)協同改善氧化MP凝膠特性的效果,其結果表明高濃度CA會導致MP凝膠的網絡結構松散、孔徑大且不規則,而在TGase與CA協同作用下MP凝膠網絡結構緊湊、孔隙均勻,這說明TGase能夠克服高劑量CA引起的凝膠結構劣變,增加DCL。同時,二者的協同作用使更多的水分子被截留在凝膠內部,并使水分分布趨于均勻,顯著提高氧化損傷MP凝膠的持水能力。同時,有研究者通過分子對接說明了表沒食子茶素沒食子酸酯(epigallocatechin gallate,EGCG)與MHC的共價和非共價相互作用,確認了以MHC為底物的TGase催化機制(圖4)。
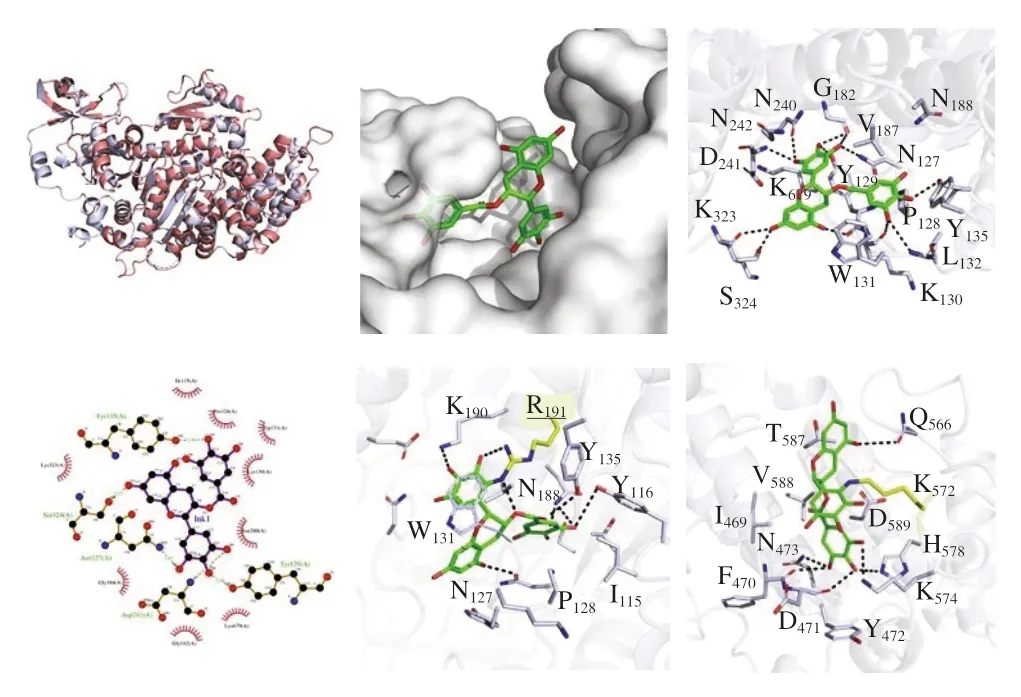
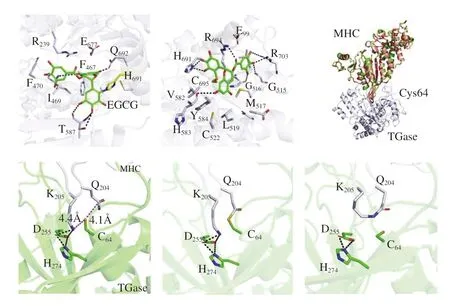
圖4 通過分子對接分析MHC與EGCG的相互作用及TGase的催化機制[38]Fig.4 Interaction analysis between MHC and EGCG and catalytic mechanism of TGase via molecular docking[38]
2.2 堿性氨基酸
堿性氨基酸是人體的必需或半必需氨基酸,包括精氨酸(arginine,Arg)、賴氨酸(lysine,Lys)和組氨酸(histidine,His),作為一種安全無毒、來源廣泛、營養健康且價格低廉的小分子物質,將其添加到食品體系中不會引入有害物質,是一種綠色的食品添加劑。大量研究表明,在MP溶液中添加堿性氨基酸能夠提高體系pH值,并通過電荷作用擾亂MP分子結構,使肌球蛋白絲狀體解離,進而使MP溶解度增加[39]。另外也有研究者發現堿性氨基酸可以通過與MP中酸性氨基酸殘基發生相互作用抑制MP聚集,起到增加MP溶解度的效果[40]。溶解度的增加會使得MP結構展開,不僅有利于形成良好的三維網絡結構,還可以增加TGase對賴氨酸和谷氨酰胺殘基的可及性,增加DCL并改善MP凝膠特性[41]。
Cao Yungang等[42]研究發現與單獨添加TGase或Lys的實驗組相比,二者協同作用的MP凝膠呈現出更為精細、光滑、致密的網絡結構,說明TGase與Lys在提升DCL和改善凝膠結構方面具有協同作用。此外,Lys的ε-氨基作為TGase的反應底物,使得Lys可以在TGase的作用下被連接到MP分子內部,因其本身具有咸味,可以有效地提升產品的風味特征和營養價值[43]。Cao Yungang等[44]的另一項研究表明,TGase與Arg的組合也能夠協同增加DCL,并顯著提高MP的凝膠強度和持水性,使其呈現出細膩、致密的微觀結構。Shi Tong等[45]進一步研究在微波輻射條件下,Arg與TGase協同改善低鹽MP凝膠特性的分子作用機制,發現Arg能夠結合在MP表面,并通過靜電作用和陽離子相互作用增加MP的水分散性,使其在TGase作用下發生更大程度的交聯,其交聯機制如圖5所示。同時,在TGase作用下相互靠近的MHC能與Arg的羧基產生相互作用破壞掉原有的氫鍵,產生新的氫鍵,使MP分子出現更多的展開和聚集行為,顯著提高熱誘導凝膠的DCL,進而提升凝膠強度和保水性。
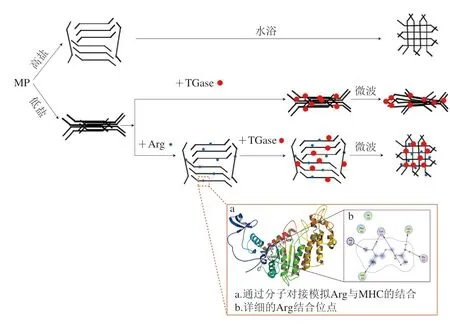
圖5 Arg與TGase協同改善低鹽MP凝膠特性的機制[45]Fig.5 Synergic mechanism of action of Arg combined with TGase in improving the gel properties of low-salt MP[45]
2.3 親水膠體
親水膠體是以單糖為單位形成的大分子多糖,在自然界中來源豐富,因具有良好的增稠、膠凝、穩定、保水以及乳化能力,在食品行業中迅速發展并得到廣泛應用[46]。肉制品加工過程中常用的親水膠體包括魔芋膠、卡拉膠、可得然膠、黃原膠、海藻酸鈉和納米纖維素等,溶于水后能夠與水分子相互作用形成水凝膠,在MP體系中形成較穩定的蛋白質-多糖-水復合體系,對于致密穩定的MP凝膠形成有促進作用[47]。基于過去幾年的突出成果和快速進展,目前關于親水膠體的研究正轉向與其他成分相互作用的調控。
孫樂常等[48]研究在熱誘導凝膠形成過程中添加TGase和魔芋膠(konjac gum,KGM)對MP凝膠品質的影響,結果表明KGM的加入引起了MP周圍水分子的重排,改變了MP的分子間作用力,從而導致MP中親水性氨基酸暴露,為TGase催化ε-(γ-谷氨酰胺)賴氨酸鍵的形成提供了有利條件,增加了DCL。同時,有研究者在魚明膠與TGase和κ-卡拉膠的雙交聯實驗中也觀察到了類似的結果[49]。但是,Zhang Xiaowei等[50]研究發現羧化納米纖維素(carboxylated nanofiber cellulose,cNFC)和TGase能夠協同提升MP凝膠的質構特性,但并未增加DCL。其作用機制如圖6所示,TGase催化MP交聯,抑制cNFC的運動,形成MP-cNFC半互穿網絡結構,其中兩種物質幾乎不發生相互作用而是保持各自的結構,相互糾纏、相互支撐,從而提高MP的凝膠強度。
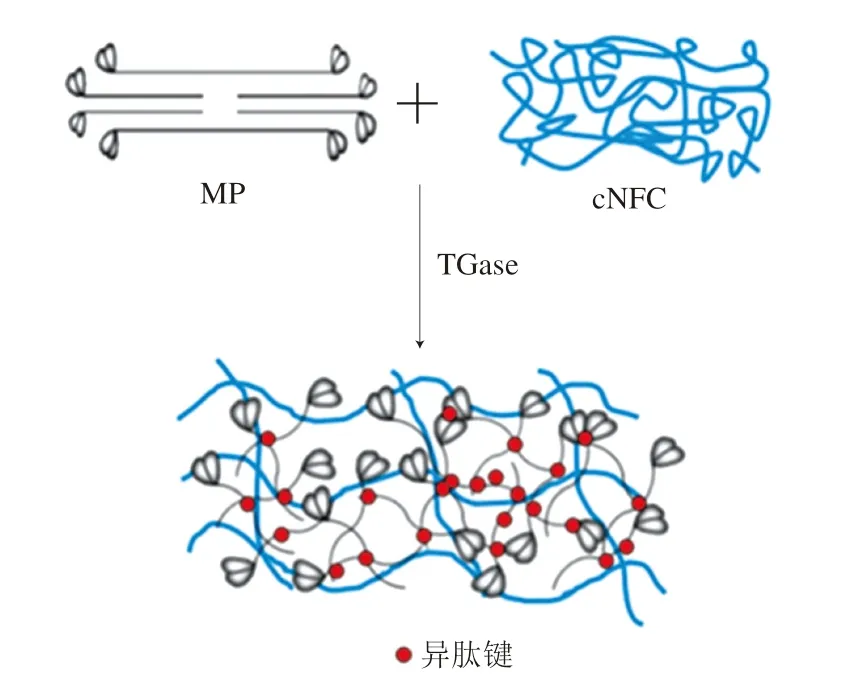
圖6 TGase催化MP-cNFC半互穿網絡形成機制[50]Fig.6 Formation mechanism of MP-cNFC semi-interpenetrating polymer network catalyzed by TGase[50]
2.4 淀粉
淀粉作為一種水固結劑,在許多肉制品生產過程中起到了降低成本、提高保水性、改善質構特性的重要作用。雖然MP和淀粉在加熱過程中的熱轉變是相互獨立的,但淀粉在加熱溫度達到70 ℃時發生糊化,淀粉顆粒吸收大量的水,體積膨脹到初始大小的數倍,能夠對MP凝膠的網絡結構起到支撐作用,使其具有更好的持水力和更高的凝膠強度[51]。
夏秀芳[52]、鄧思楊[53]等研究不同的馬鈴薯淀粉和TGase添加量對MP熱誘導凝膠特性的影響,發現馬鈴薯淀粉與TGase的添加能夠促使MP在分子內和分子間產生交聯,形成大分子物質。但二者作用機制不同且沒有觀察到協同作用。淀粉糊化吸水后與MP相互作用形成淀粉-蛋白-水的復合型網絡結構,提升了MP凝膠的持水性和凝膠強度,主要涉及氫鍵等非共價作用[54];而TGase是通過催化作用形成ε-(γ-谷氨酰胺)賴氨酸鍵,使MP凝膠網絡更為致密,共價作用是此過程中的主要因素。此外,有研究者發現添加過量的淀粉會導致DCL降低,其原因可能是在加熱升溫的過程中,淀粉糊化的發生先于MP凝膠的形成,過量的淀粉顆粒遮蔽了賴氨酸和谷氨酰胺殘基,降低了TGase對底物的可及性,進而導致DCL降低[55]。
2.5 植物蛋白
在肉制品加工中,添加植物蛋白能夠在保證產品質量的前提下降低成本,提高經濟效益。這是因為植物蛋白本身可以通過填補凝膠空隙或者改變凝膠結構而影響MP熱誘導凝膠特性[56]。然而,由于缺乏結構變化,植物蛋白和MP分子之間的相互作用通常有限,甚至可能由于干擾MP凝膠行為而對凝膠品質產生負面影響[57]。
Jiang Jiang等[58]研究改性的大豆分離蛋白(soybean protein isolate,SPI)與TGase協同作用對DCL和MP凝膠特性的影響,發現酸改性的SPI能夠明顯提升MP的最終G′值,且TGase的加入進一步強化了上述現象,說明TGase與酸改性的SPI在增加DCL方面有明顯的協同作用。推測其原因,一方面是SPI增大了MP的溶解度,增強了TGase對底物氨基酸殘基的可及性;另一方面是TGase能催化SPI中的β-伴大豆球蛋白(7S)和球蛋白(11S)與MP中活性基團發生共價交聯。同時,有研究者發現超聲改性的豌豆分離蛋白(pea protein isolate,PPI)和TGase對于改善低磷環境下MP的凝膠特性具有相似的協同效應,能使焦磷酸鈉(sodium pyrophosphate,SPP)的添加量減少50%,其作用機制如圖7所示[59]。此外,Lee等[60]用紅豆分離蛋白和TGase聯合作用于低鹽MP體系,發現二者的協同效應能夠克服低鹽造成的凝膠結構劣變,獲得的MP凝膠仍具有良好的持水力和堅固、致密的凝膠結構。
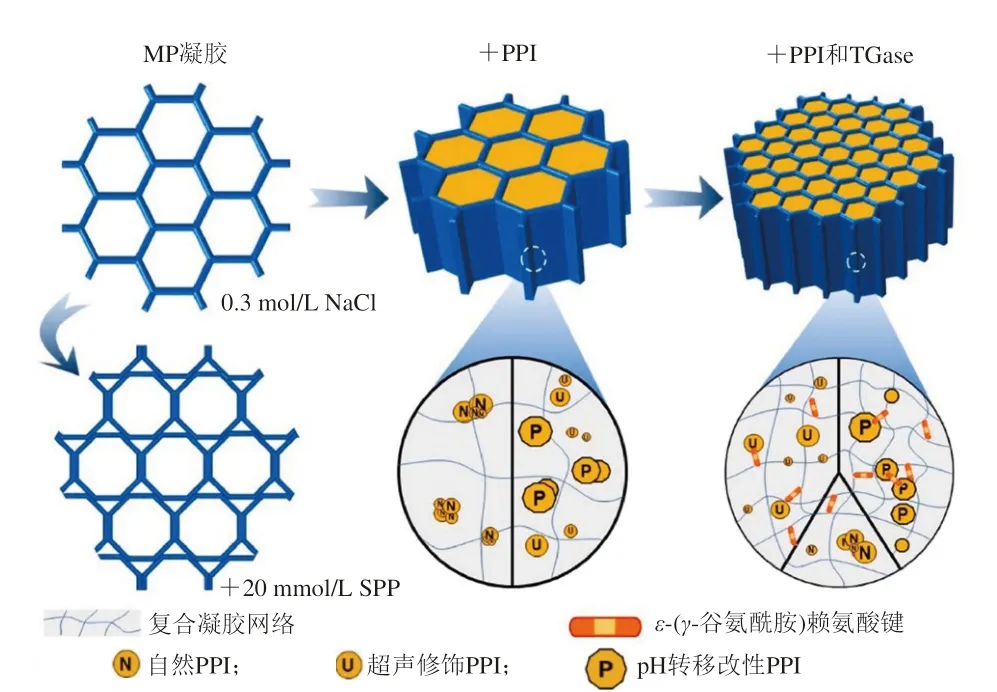
圖7 TGase催化MP和改性PPI復合凝膠形成機制[59]Fig.7 Mechanism of composite gel formation from MP and modified PPI catalyzed by TGase[59]
3 新型加工技術對TGase催化MP共價交聯程度的影響
隨著人們對高品質食品需求的增長,超聲處理(ultrasound treatment,UT)、高壓處理(high-pressure processing,HPP)、微波和脈沖電場等一系列新型加工技術正在食品工業中推廣應用,由于其具有獨特的能量傳輸機制,生產效率更高、產品品質更好、對環境的影響更小,因此近年來研究者針對上述新型加工技術開展了大量研究。本節綜述了UT、HPP、微波協同TGase對DCL和MP凝膠品質的影響及其分子作用機制。
3.1 超聲波技術
UT是一項新興的非熱加工技術,因其無污染、安全、易操作等優點在食品加工領域得到了廣泛的研究,具有很大的應用潛力。超聲波能夠產生機械效應、熱效應和空化效應,其中空化效應對MP結構的影響最為顯著。空化效應即超聲產生的氣泡在爆破時引起微射流對物體表面造成物理損傷的現象,能夠破壞肌纖維的Z線和M線,增大肌纖維間的間隙,進而增強蛋白質-水相互作用,同時使蛋白質的活性基團暴露,有利于蛋白質-蛋白質相互作用,有助于形成均勻致密的三維網絡結構[61]。近年來,超聲輔助酶技術被廣泛應用于改變食物蛋白質的結構和性質[62-63]。
Feng Jiaqi等[64]研究TGase和UT及其組合對MP凝膠特性的影響,其動態流變學結果表明UT-TG處理組樣品的G′值最高,其次為TGase處理組和UT處理組樣品,未經處理樣品的G′值最低,說明TGase與UT的聯合作用提升了MP-DCL,得到了具有較高強度和彈性的凝膠。其SEM結果表明,UT-TG處理組樣品的凝膠網絡結構更緊密,孔隙更小,且比TGase處理組和UT處理組樣品的凝膠網絡連通性更高,結構更有序。這是因為UT能夠促進TGase運動,使其擴散到MP分子的各個位點,從而在加熱過程中形成更均勻有序的凝膠網絡[65]。Gao Xia等[66]研究發現,超聲產生的空化效應會釋放大量的能量并產生強烈的剪切力,導致蛋白質構象變化,肌動球蛋白解離,使肌球蛋白在鹽溶液中的溶解度升高,并隨著反應進行均勻分散,充分暴露出供TGase作用的活性基團,在其熱誘導凝膠中形成更多的ε-(γ-谷氨酰胺)賴氨酸鍵,其作用機制如圖8a所示。此外,還有研究者推測UT改變了TGase的構象,提高了TGase活性,并誘導了更適合TGase作用的MP構象,使DCL進一步增加[67]。但也有研究表明,過強的超聲強度可能會導致TGase結構大幅改變,喪失其原有活性[68]。
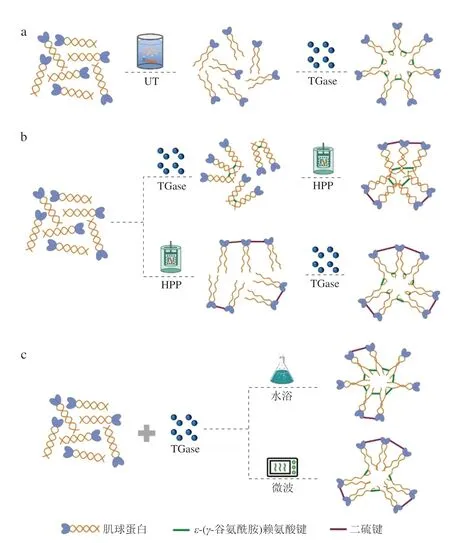
圖8 新型加工技術影響TGase催化MP凝膠形成的作用機制Fig.8 Mechanism of the effect of novel processing technologies on MP gel formation catalyzed by TGase
3.2 HPP技術
HPP是一項高效率、低能耗、無毒無害的非熱處理技術,因其對菌落致死率高達97%,能夠有效延長產品的貨架期,已作為一種冷殺菌手段在食品行業中得到了廣泛應用[69]。近年來,研究者又發現HPP能夠改變蛋白質結構,暴露出巰基和疏水基團,減少蛋白與水分子的接觸,有利于蛋白質-蛋白質相互作用[70]。同時,HPP還會影響蛋白質側鏈的相互作用,進而引起蛋白質變性、聚集或凝膠化,但其形成的凝膠結構類似于一種“海綿狀”,主要由疏水作用力維持,無法形成均勻穩定的凝膠結構[71]。因此,近年來研究者嘗試利用TGase彌補HPP誘導凝膠的不足。
Herranz等[71]研究TGase、HPP和這兩種處理的組合在MP凝膠形成過程中的作用,其結果表明,僅添加TGase的處理組形成的凝膠共價鍵比例較大,凝膠結構具有很強的剛性特征,而HPP處理產生的壓縮-膨脹效應會使得非共價鍵重新組合,產生更富有彈性的凝膠網絡,二者的聯合作用沒有觀察到明顯的協同效果。但Kunnath等[72]研究發現TGase對HPP誘導的MP凝膠特性具有明顯的提升效果,具體表現為TGase的加入使HPP誘導的MP凝膠網狀結構呈現出更為連續、均勻的狀態,在后續加熱過程中,相互靠近的巰基形成二硫鍵進一步加強了MP聚集,形成表面連續均勻、孔洞小的凝膠,具有更強的凝膠強度。
上述研究結果并不一致,這可能與HPP作用的強度、時間等因素有關,但更重要的似乎是HPP與TGase的作用順序。如圖8b所示,先加入TGase反應一段時間后再進行HPP,則HPP作用效果不顯著,這是因為TGase催化產生的共價鍵強于HPP建立的非共價相互作用[73]。先進行HPP可以促進MP的展開,使更多活性基團暴露,更容易被TGase催化形成共價鍵[41]。
3.3 微波處理技術
與傳統加熱相比,微波處理是一種綠色、環保、清潔的技術,它通過產生電磁場進行加熱,直接引起材料分子內的振動,由于其穿透能力強、加熱速度快、加工時間短、能源效率高、操作簡單,在食品工業中得到了廣泛應用,包括烹飪、殺菌、干燥、解凍、生物活性成分提取和誘導MP凝膠化等[74]。微波因其特殊的交變電場,可以改變蛋白質分子內部的電荷環境和內電場分布,從而破壞蛋白質肽鏈之間的靜電作用,和傳統的水浴加熱相比更容易形成肌球蛋白聚集體從而形成更好的凝膠結構[75-76]。
然而,Cao Hongwei等[77]研究相同的TGase反應條件下,微波加熱與傳統水浴加熱對MP凝膠特性的影響,結果表明兩種加熱方式誘導的MP凝膠的DCL差異不大。這是因為微波所產生的交變電場對MP分子有“撕扯”的作用,有利于MP結構展開,原本包埋在其內部的活性殘基暴露,使得二硫鍵廣泛形成,但二硫鍵所產生的空間位阻會阻礙ε-(γ-谷氨酰胺)賴氨酸鍵的形成,且隨著時間的延長,二硫鍵作用形成的大分子聚集體又會將原本暴露出來的活性殘基重新包埋起來,降低TGase對底物的可及性,進一步阻止TGase催化MP交聯[78]。其潛在的機制如圖8c所示。
但值得注意的是,微波除了簡單的熱效應外,還可以通過非熱效應對酶本身直接產生作用,如酶分子的結構和構象變化,引起酶活性的變化,最終影響其作用結果[79]。研究發現TGase的活性受微波功率和加熱時間的影響。在相同的升溫速率下,微波加熱的TGase活性在40 ℃時達到最高值,且高于常規水浴加熱,這是因為TGase分子自身的介電特性使其在微波交變電場的作用下發生偶極-偶極相互作用,活性位點發生改變而使酶活性提高[80]。因此,將微波改性的TGase加入到MP體系中或許是提高DCL的一種有效手段。
4 結語
如今消費者的健康意識逐漸增強,清潔標簽食品的發展成為必然趨勢,低鹽低磷等肉制品的開發生產已經成為肉品行業的熱點研究問題。TGase能夠催化生成ε-(γ-谷氨酰胺)賴氨酸鍵,提高DCL,賦予MP良好的凝膠特性,進而改善肉制品品質,這對于清潔標簽肉制品的生產具有重要意義。由于TGase單獨作用對MP凝膠特性的提升效果有限,因此研究者將其他外源添加物和新型加工技術引入到TGase催化MP共價交聯的過程中,旨在彌補TGase作用缺陷的同時進一步提升MP凝膠特性,以獲得品質更優的產品。
近幾年,關于TGase與外源添加物或新型加工技術協同改善MP凝膠特性的研究已經取得了一定成果,然而不可忽視的是這些方案還存在著一些問題。第一,雖然目前國內外已有大量研究表明外源添加物如多酚、堿性氨基酸、淀粉、親水膠體和非肉蛋白等能夠與TGase協同提高MP交聯程度,但對二者協同作用機制研究的深度和廣度還有不足,未來可深入探究其分子互作行為和凝膠過程中MP結構的演化規律。第二,各種新型加工技術與TGase聯合作用時的參數選擇還不明確,強度過低作用效果不明顯,強度過高可能破壞TGase的結構使其失活或對MP結構造成損傷,此外新型加工技術與TGase的作用順序也是未來研究的一項重點。第三,現有研究大多集中在MP體系中,但對于實際生產中面臨的多組分共混體系的研究還不夠豐富,因此在未來的研究中,應當考慮TGase的共價交聯作用對多組分體系凝膠結構的影響,擴大TGase在食品領域中的應用。第四,研究TGase與外源添加物或新型加工技術協同作用改善凝膠結構對肉制品口感、風味釋放和消化吸收等特性的影響,以便合理控制TGase催化的MP-DCL,為實際生產奠定理論基礎。

