miR-210通過NF-κB信號通路對胃癌細(xì)胞的增殖、凋亡、侵襲及轉(zhuǎn)移的影響*
魏明喬, 趙麗楠, 吳一辰, 王拓, 李樹敏
(赤峰學(xué)院附屬醫(yī)院 檢驗(yàn)科, 內(nèi)蒙古 赤峰 024000)
胃癌是全球范圍內(nèi)發(fā)病率和病死率均較高的疾病,目前臨床中對胃癌患者的治療主要為手術(shù)聯(lián)合放化療和藥物治療,但因胃癌患者早期并無明顯癥狀,多數(shù)患者確診時已經(jīng)為中晚期,因此臨床治療的總體預(yù)后較差,總體生存率也較低[1-2]。近年來隨著分子生物學(xué)的不斷發(fā)展,尋找有效信號通路干預(yù)已經(jīng)成為臨床治療胃癌的熱點(diǎn),以期能為今后胃癌防治提供新方向[3]。核轉(zhuǎn)錄因子(Nuclear factor kappa-B,NF-κB)是一種特定多效轉(zhuǎn)錄因子,已有研究指出NF-κB信號通路激活可造成下游效應(yīng)因子轉(zhuǎn)錄,促進(jìn)細(xì)胞增殖和血管形成,參與到機(jī)體炎性反應(yīng)中,促進(jìn)胃癌的發(fā)生發(fā)展[4-5]。已經(jīng)明確NF-κB在多數(shù)腫瘤中為活化狀態(tài),可促進(jìn)腫瘤的發(fā)生和進(jìn)展,也能夠在一定程度上發(fā)揮抗腫瘤作用,因此臨床中調(diào)整NF-κB信號通路有望成為臨床防治胃癌的有效方法[6]。微小RNA(microRNA,miRNA)為長度18~22個核苷酸的內(nèi)源性非編碼RNA,其可與相關(guān)靶mRNA相互作用,進(jìn)而影響mRNA的轉(zhuǎn)錄過程以調(diào)節(jié)相關(guān)基因表達(dá)[7]。近年來已有研究指出miRNA在細(xì)胞增殖、侵襲、轉(zhuǎn)移、凋亡及存活中均有重要作用,如miR-210對結(jié)腸直腸癌、膀胱癌、乳腺癌等均有促進(jìn)作用,且該過程與NF-κB信號通路密切相關(guān)[8]。但臨床中尚未明確miR-210在MGC803胃癌細(xì)胞中的表達(dá)情況,因此本研究分析了miR-210通過NF-κB信號通路參與胃癌發(fā)生發(fā)展的免疫調(diào)控作用,以期能為今后臨床治療提供指導(dǎo)。現(xiàn)報告如下。
1 材料與方法
1.1 材料
1.1.1細(xì)胞株 由北京協(xié)和細(xì)胞資源中心購入MGC803胃癌細(xì)胞以及正常的胃黏膜上皮細(xì)胞。
1.1.2主要儀器及試劑 胎牛血清(美國Gibco公司);青霉素、鏈霉素(華北制藥股份有限公司);miR-210 inhibitor及inhibitor control(上海皓元生物醫(yī)藥科技有限公司);Trizol試劑和Lipofectamine 2000試劑(賽默飛世爾科技有限公司);CKK-8(日本同仁公司);Transwell小室(美國Coring公司);熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(PCR)測定試劑盒、逆轉(zhuǎn)錄試劑盒和AnnexinⅤ-FITC/PI細(xì)胞凋亡測定試劑盒(日本TaKaRa公司);電化學(xué)發(fā)光(ECL)試劑(碧云天生物科技研究所);IκBα、p-IκBα、NF-κB和p-NF-κB抗體(美國CST公司)。
1.2 研究方法
1.2.1細(xì)胞培養(yǎng)和轉(zhuǎn)染[7]胃黏膜上皮細(xì)胞采用RPMI-1640培養(yǎng)基(含10%胎牛血清)在37 ℃、5%CO2培養(yǎng)箱中培養(yǎng)。每周2~3次更換新鮮培養(yǎng)基,在密度達(dá)到80%時傳代后使用。將MGC803胃癌細(xì)胞置入含有10%胎牛血清的改良Eagle培養(yǎng)基(dulbecco's modification of eagle's medium dulbecco,DMEM)培養(yǎng)基內(nèi)培養(yǎng),分別加入100 mg/L鏈霉素和1×105U/L青霉素,然后放置在含有5%CO2的37 ℃、95%相對濕度培養(yǎng)箱內(nèi)培養(yǎng),直至細(xì)胞貼壁生長密度超過80%時,加入0.25%胰蛋白酶進(jìn)行消化傳代。將對數(shù)生長期的MGC803胃癌細(xì)胞在6孔板上接種,每孔接種2×105個細(xì)胞,置入培養(yǎng)箱內(nèi)常規(guī)培養(yǎng),當(dāng)細(xì)胞達(dá)到50%融合時,依據(jù)Lipofectamine 2000試劑說明書轉(zhuǎn)染miR-210 inhibitor及miR-210 inhibitor control,并將細(xì)胞分為空白對照組、陰性對照組(miR-210 inhibitor control)及實(shí)驗(yàn)組(miR-210 inhibitor),將各組細(xì)胞置入37 ℃培養(yǎng)箱內(nèi)繼續(xù)培養(yǎng)72 h。
1.2.2qRT-PCR檢測miR-210表達(dá)[7]Trizol法提取對數(shù)生長期的MGC803胃癌細(xì)胞中總RNA,使用逆轉(zhuǎn)錄試劑盒合成cDNA,以其為模板,行熒光定量PCR試劑盒擴(kuò)增,條件為:94 ℃預(yù)變性3 min,94 ℃ 15 s、56 ℃ 20 s、72 ℃ 10 s,共40個循環(huán)。使用定量2-ΔΔCt法計(jì)算miR-210相對表達(dá)水平。
1.2.3CCK-8實(shí)驗(yàn)檢測細(xì)胞增殖[7]將轉(zhuǎn)染后MGC803胃癌細(xì)胞接種至96孔板內(nèi),每孔接種5×103個細(xì)胞,設(shè)置3個復(fù)孔,細(xì)胞貼壁生長后,分別在24、48及72 h時每孔內(nèi)均緩慢加入CCK-8溶液10 μL,置入37 ℃培養(yǎng)箱內(nèi)孵育4 h,使用酶標(biāo)儀測定450 nm波長處的OD值,重復(fù)3次,繪制生長曲線。
1.2.4Transwell實(shí)驗(yàn)檢測細(xì)胞侵襲[7]各組細(xì)胞轉(zhuǎn)染后的MGC803胃癌細(xì)胞均加入0.25%胰蛋白酶消化,使用Eagle培養(yǎng)基培養(yǎng)液懸浮和調(diào)整細(xì)胞濃度為1×108個/L。Transwell小室的上室內(nèi)加入100 μL細(xì)胞懸液,下室內(nèi)加入含有10%胎牛血清的DMEM培養(yǎng)液500 μL,置入37 ℃培養(yǎng)箱內(nèi)培養(yǎng)48 h。取出Transwell小室,0.1%結(jié)晶紫染色20 min、PBS洗滌、風(fēng)干后隨機(jī)選取5個視野觀察記錄,重復(fù)3次。
1.2.5劃痕實(shí)驗(yàn)檢測細(xì)胞遷移 將轉(zhuǎn)染后的MGC803胃癌細(xì)胞接種至6孔板內(nèi),每孔接種1×106個細(xì)胞,置入37 ℃培養(yǎng)箱內(nèi)培養(yǎng)細(xì)胞至貼壁單層生長,使用無菌移液槍對6孔板表面做垂直直線劃痕,PBS洗滌后更換培養(yǎng)液,培養(yǎng)48 h,均設(shè)置3個復(fù)孔,使用顯微鏡觀察細(xì)胞遷移個數(shù),重復(fù)3次。
1.2.6流式細(xì)胞儀檢測細(xì)胞凋亡 將轉(zhuǎn)染后培養(yǎng)72 h的MGC803胃癌細(xì)胞使用預(yù)冷PBS洗滌2次,離心收集1×106個細(xì)胞,加入100 μL結(jié)合緩沖液重懸細(xì)胞,然后加入5 μL的FITC-Annexin V溶液孵育15 min,再加入5 μL的PI染液,混勻避光反應(yīng)15 min,使用流式細(xì)胞儀檢測細(xì)胞凋亡情況,重復(fù)3次。
1.2.7Western blot檢測IκBα、p-IκBα、NF-κB、p-NF-κB水平 取對數(shù)生長期MGC803胃癌細(xì)胞的蛋白,加入適量RIPA裂解液于冰上裂解30 min,置于4 ℃下12 000r/min離心30 min,取上清液,加入等量總蛋白上樣,以10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,蛋白分離后電轉(zhuǎn)至PVDF膜上,置入含5%脫脂奶粉的封閉液內(nèi)封阻1 h,分別加入一抗(1∶500)后置于4 ℃下過夜雜交,PBST洗滌3次,10 min/次,然后加入HRP標(biāo)記的二抗(1∶2 000),室溫下雜交2 h,PBST洗滌3次,10 min/次,加ECL試劑顯影,以β-actin作為內(nèi)參照,使用Image J軟件分析蛋白表達(dá)情況,重復(fù)3次。
1.3 統(tǒng)計(jì)學(xué)方法
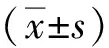
2 結(jié)果
2.1 正常胃黏膜上皮細(xì)胞與胃癌細(xì)胞中miR-210表達(dá)水平
與正常胃黏膜上皮細(xì)胞相比,MGC803胃癌細(xì)胞中miR-210水平升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖1。

注:(1)與正常胃黏膜上皮細(xì)胞比,P<0.05。
2.2 各組miR-210轉(zhuǎn)染效率
與空白對照組、陰性對照組細(xì)胞相比,實(shí)驗(yàn)組細(xì)胞中miR-210表達(dá)水平降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖2。

注:(1)與空白對照組比,P<0.05;(2)與陰性對照組相比,P<0.05。
2.3 各組細(xì)胞增殖能力的比較
與空白對照組、陰性對照組相比,實(shí)驗(yàn)組細(xì)胞的增殖能力降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),空白對照組和陰性對照組相比,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。 見圖3。

注:(1)與空白對照組比,P<0.05;(2)與陰性對照組比,P<0.05。
2.4 各組細(xì)胞侵襲能力的比較
與空白對照組、陰性對照組相比,實(shí)驗(yàn)組轉(zhuǎn)染后48 h的細(xì)胞侵襲個數(shù)減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.05 ),空白對照組和陰性對照組相比,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。見圖4和表1。
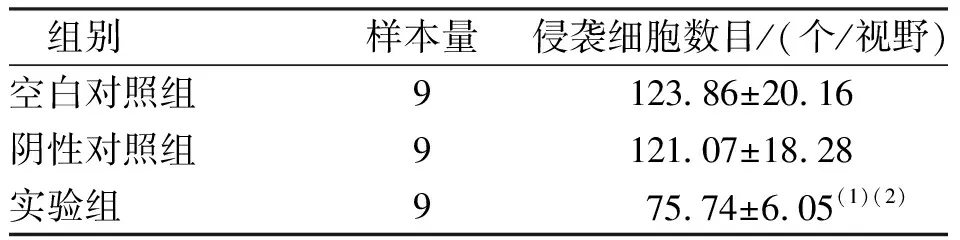
表1 各組細(xì)胞侵襲能力的比較Tab.1 Comparison of cell invasion ability among three groups

圖4 各組細(xì)胞侵襲侵襲能力(Tranwell,×100)Fig.4 Comparison of cell invasion ability among three groups(Tranwell,×100)
2.5 各組細(xì)胞遷移情況比較
與空白對照組、陰性對照組相比,實(shí)驗(yàn)組劃痕的距離變化明顯,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖5和表2。

表2 各組細(xì)胞遷移情況的比較Tab.2 Comparison of cell migration among three groups

圖5 各組細(xì)胞劃痕試驗(yàn)結(jié)果Fig.5 Result of cell scratch assay in three groups
2.6 各組細(xì)胞凋亡情況比較
與空白對照組、陰性對照組相比,實(shí)驗(yàn)組細(xì)胞凋亡率升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),空白對照組和陰性對照組相比,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。見圖6和表3。

表3 各組細(xì)胞凋亡能力的比較Tab.3 Comparison of apoptosis ability in each group

圖6 各組細(xì)胞凋亡能力的比較Fig.6 Comparison of apoptosis ability among three groups
2.7 各組細(xì)胞中IκBα、p-IκBα、NF-κB和p-NF-κB蛋白水平的比較
如圖7,與空白對照組、陰性對照組相比,實(shí)驗(yàn)組細(xì)胞中IκBα、p-IκBα、NF-κB和p-NF-κB蛋白水平均降低,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),空白對照組和陰性對照組相比,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。

注:A為蛋白表達(dá)條帶圖,B為蛋白表達(dá)水平;(1)與空白對照組比,P<0.05;(2)與陰性對照組比,P<0.05。
3 討論
近年來雖然對胃癌患者的診斷、手術(shù)治療和靶向治療等方面均有明顯進(jìn)展,但由于胃癌的發(fā)病分子機(jī)制尚不明確,因此雖然部分患者可獲得及時合理的治療,仍然無法獲得較佳的預(yù)后[9]。有研究指出[10],miRNA表達(dá)異常對腫瘤細(xì)胞的增殖、侵襲、轉(zhuǎn)移均有一定作用,因此深入探究miRNA的生物學(xué)功能對惡性腫瘤的早期診斷和靶向治療具有積極意義。既往有研究表明[11],人類多種腫瘤內(nèi)miR-210均呈現(xiàn)高表達(dá),其能夠靶向調(diào)控基因表達(dá)或信號通路活化,是臨床已經(jīng)明確的致癌基因之一。Liu等[12]在研究中指出,骨肉瘤組織中miR-210表達(dá)明顯高于正常組織,且miR-210可促進(jìn)骨肉瘤細(xì)胞的侵襲和遷移。Luan等[13]也指出,前列腺組織中miR-210表達(dá)水平高于癌旁組織,其可通過下調(diào)BNIP3表達(dá)而抑制前列腺癌細(xì)胞凋亡。同時臨床中也有文獻(xiàn)指出miR-210的高表達(dá)與乳腺癌、腎癌、多發(fā)性骨髓瘤等腫瘤淋巴結(jié)轉(zhuǎn)移、TNM分期、不良預(yù)后等均存在相關(guān)性[14-15]。因此積極明確miR-210在胃癌發(fā)生發(fā)展中的作用,對改善患者預(yù)后有重要意義。
miRNA可對基因內(nèi)源性非編碼RNA進(jìn)行調(diào)控,且miRNA在腫瘤的發(fā)病機(jī)理中有重要作用,miRNA表達(dá)譜可作為臨床診斷、預(yù)后、疾病管理的潛在生物標(biāo)志[16]。因此本研究中下調(diào)miR-210后細(xì)胞增殖能力降低,細(xì)胞遷移、侵襲率降低,而細(xì)胞凋亡率升高,同時細(xì)胞內(nèi)p-IκBα、p-NF-κB水平均降低,提示p-IκBα、p-NF-κB水平均降低,提示miR-210可能通過激活NF-κB信號通路而調(diào)控了某些相關(guān)蛋白表達(dá),進(jìn)而促進(jìn)了細(xì)胞凋亡。本研究結(jié)果與既往研究一致,抑制NF-κB信號通路可抑制宮頸癌細(xì)胞增殖、侵襲和遷移,進(jìn)而促進(jìn)細(xì)胞凋亡[17]。由于NF-κB可以IκB相結(jié)合形成復(fù)合體,進(jìn)而在細(xì)胞質(zhì)內(nèi)以無活性形式存在,因此當(dāng)細(xì)胞遭受外界刺激后,IκB發(fā)生磷酸化而暴露NF-κB核定位位點(diǎn),進(jìn)而轉(zhuǎn)移至細(xì)胞核內(nèi),對相關(guān)基因的轉(zhuǎn)錄和表達(dá)過程進(jìn)行調(diào)控,達(dá)到調(diào)控細(xì)胞增殖、侵襲、遷移、凋亡的效果[18]。而miR-210作為缺氧特異性microRNA,無論是在病理性還是生理性的低氧環(huán)境下,其均會呈現(xiàn)高表達(dá)。因此當(dāng)胃癌患者發(fā)病后體內(nèi)miR-210表達(dá)也會升高,此時miR-210可通過靶向基因SDHD激活低氧誘導(dǎo)因子(hypoxia inducible factor,HIF-1),而HIF-1激活上調(diào)后又會促進(jìn)miR-210表達(dá)變化,進(jìn)而影響腫瘤血管生成過程,這種作用形成惡性循環(huán)[19]。
綜上所述,MGC803胃癌細(xì)胞內(nèi)miR-210水平明顯升高,下調(diào)miR-210可通過抑制NF-κB信號通路抑制胃癌細(xì)胞增殖、侵襲和遷移,促進(jìn)胃癌細(xì)胞凋亡。提示通過抑制miR-210表達(dá)可形成一個協(xié)同或輔助作用因子而影響腫瘤的生長和發(fā)展,為開發(fā)胃癌抗血管生成藥物提供了理論基礎(chǔ)。
- 貴州醫(yī)科大學(xué)學(xué)報的其它文章
- 老年阻塞性睡眠呼吸暫停低通氣綜合征患者夜間呼吸暫停情況與認(rèn)知障礙的關(guān)系*
- 腹腔鏡結(jié)直腸癌根治術(shù)聯(lián)合微波消融術(shù)與聯(lián)合腹腔鏡肝切除術(shù)的療效比較*
- 解剖性肝切除術(shù)后腹腔感染的影響因素及早期血清指標(biāo)預(yù)測價值*
- 雙波長激光輔助一次性根管治療磨牙慢性根尖周炎的療效觀察*
- 妊娠期婦女血小板抗體檢測結(jié)果的影響因素分析*
- 朗格漢斯細(xì)胞組織細(xì)胞增生癥臨床特點(diǎn)及其BRAF V600E 基因突變與預(yù)后的相關(guān)性*

