脂肪酸代謝紊亂與糖尿病血管微循環障礙
宇文雅 王西強 劉靜 劉仲偉
【摘要】脂肪酸過氧化物、脂質過氧化產物以及飽和脂肪酸是糖尿病脂肪酸代謝紊亂的特征性病理代謝產物,可通過誘導血小板聚集、引發血管收縮、增加血管通透性、誘發炎癥反應等一系列機制,導致構成微循環結構的重要細胞發生功能障礙和損傷,誘發微循環障礙。現對上述機制及相關新型治療策略做一綜述,為其臨床防治提供新的線索與思路。
【關鍵詞】糖尿病;脂肪酸代謝;微循環障礙
【DOI】10.16806/j.cnki.issn.1004-3934.2024.02.000
Fatty Acid Metabolism Disorders and
Diabetic Vascular Microcirculation Dysfunction
YU Wenya1,2,WANG Xiqiang2,3,LIU Jing2,3,LIU Zhongwei2,3
(1.School of Medicine,Xizang Minzu University,Xianyang 712082,Shaanxi,China;2.Department of Cardiology,Shaanxi Provincial Peoples Hospital,Xian 710068,Shaanxi,China;3.Integretive Traditional Chinese Medicine?and Western Medicien?Key Lab,Research?Office of Shaanxi Administration of Traditional Chinses Medicine,Xian 710068,Shaanxi,China)
【Abstract】Fatty acid peroxidation products,lipid peroxidation products,and saturated fatty acids are characteristic pathological metabolic products of fatty acid metabolic disorder in diabetes. They?can induce platelet aggregation,trigger vasoconstriction,increased vascular permeability,and provoke inflammatory responses. These mechanisms lead to dysfunction and damage of vital cells that constitute the microcirculation,thus inducing microcirculatory disorders. This review discusses the above mechanisms and related novel therapeutic strategies,providing new clues and ideas for their clinical prevention and treatment.
【Keywords】Diabetes mellitus;Fatty acid metabolism;Microcirculation dysfunction
糖尿病是一種常見的代謝性疾病,其發病率隨著西式飲食的流行和人口老齡化的加劇而不斷上升。除了血糖水平的異常外,糖尿病患者還經常伴隨有脂代謝紊亂,特別是脂肪酸代謝的異常[1]。隨著對糖尿病微循環障礙研究的深入,越來越多的證據表明,脂肪酸代謝異常與糖尿病微循環障礙密切相關[2]。微循環障礙會導致組織缺血、缺氧和代謝紊亂等,嚴重時甚至會引起組織壞死和器官功能障礙[3]。現探討糖尿病脂肪酸代謝異常與微循環障礙的關系,為進一步研究提供新的線索。
1 ?糖尿病脂肪酸代謝紊亂與微循環障礙
在糖尿病中,脂肪酸代謝紊亂包括脂肪酸的合成、儲存和利用過程的異常。這些異常過程導致血液中脂質過氧化產物(lipid peroxidation product,LPP)、脂肪酸過氧化物(fatty acid peroxidation product,FAPP)和飽和脂肪酸(saturated fatty acid,SFA)含量增加[4]。這一紊亂的機制復雜,涉及脂肪組織分布和結構的改變、胰島素抵抗以及脂肪酸氧化代謝的異常?[5]。脂肪酸代謝的異常與糖尿病微循環障礙的發生和發展密切相關,產生的毒性代謝產物對微循環的主要構成細胞造成直接影響,誘發細胞功能障礙、結構損傷以及細胞凋亡,進一步加重微循環障礙。
糖尿病患者的脂肪酸代謝紊亂會產生一系列的過氧化脂質,主要包括LPP和FAPP。前者包括丙二醛(malondialdehyde,MDA)、甲醛以及丙酮酸等,后者則包括如4-羥基-2-壬烯醛(4-Hydroxy-2-nonenal,4-HNE)、花生四烯酸過氧化物(hydroperoxyoctadecadienoic acid,HPODE)、丙二醛-乙醛加合物(malondialdehyde-acetaldehyde,MAA)以及脂質過氧化物(lipid peroxide,LPO)等?[6]。這些毒性代謝產物可導致細胞內環境紊亂,損傷細胞結構和功能,誘發炎癥反應,參與微循環障礙的發生和發展。另外,高血糖和高胰島素水平可能會導致SFA的過度產生和堆積,包括棕櫚酸(palmitic acid,PA)、硬脂酸(stearic acid,SA)和肉豆蔻酸。這些SFA可刺激內皮細胞及血管平滑肌細胞產生氧化應激和自由基,增加血管內皮細胞的炎癥反應,導致細胞功能障礙和損傷[7]。這些效應可能會導致微循環血管舒張功能異常和通透性增高,進一步影響微循環的正常功能。
糖尿病狀態下機體微循環遭受明顯損傷,可出現微循環障礙,嚴重時可導致糖尿病患者的病殘及死亡。中國2型糖尿病微血管并發癥總體患病率為35.5%,其中糖尿病視網膜病變患病率為27.8%,糖尿病腎病為22.7%,糖尿病神經病變為16.7%[4]。糖尿病視網膜病變早期可能無明顯的癥狀,但隨著病情的發展,可能出現視力模糊、視野缺失甚至失明。眼底檢查可發現視網膜出血、滲出、新生血管等病變。糖尿病腎病是糖尿病微血管并發癥中最主要的死亡原因。早期可能出現微量白蛋白尿,隨著病情的發展,可能出現大量蛋白尿、腎功能下降,最終導致尿毒癥。糖尿病神經病變主要表現為感覺異常、運動障礙以及自主神經功能障礙等。
糖尿病微循環障礙的發病機制復雜,涉及到多個系統、多種細胞類型及復雜的細胞信號網絡。糖尿病患者的高血糖狀態會導致包括血管張力的平衡、維持血液的流動性和通透性等內皮細胞的正常功能受損,造成微循環障礙。此外,高血糖狀態會引發氧化應激和炎癥反應,損傷線粒體、內質網等重要細胞結構,導致構成微循環的組織損傷,進而引發微循環障礙。糖尿病患者存在顯著的脂肪酸代謝紊亂,可通過多種機制導致內皮功能障礙,包括影響一氧化氮的產生、誘導微循環內皮細胞凋亡、加重加速氧化應激以及誘導血小板聚集等[8]。這些機制相互作用,共同導致糖尿病微循環障礙的發生和發展。
2 ?LPP
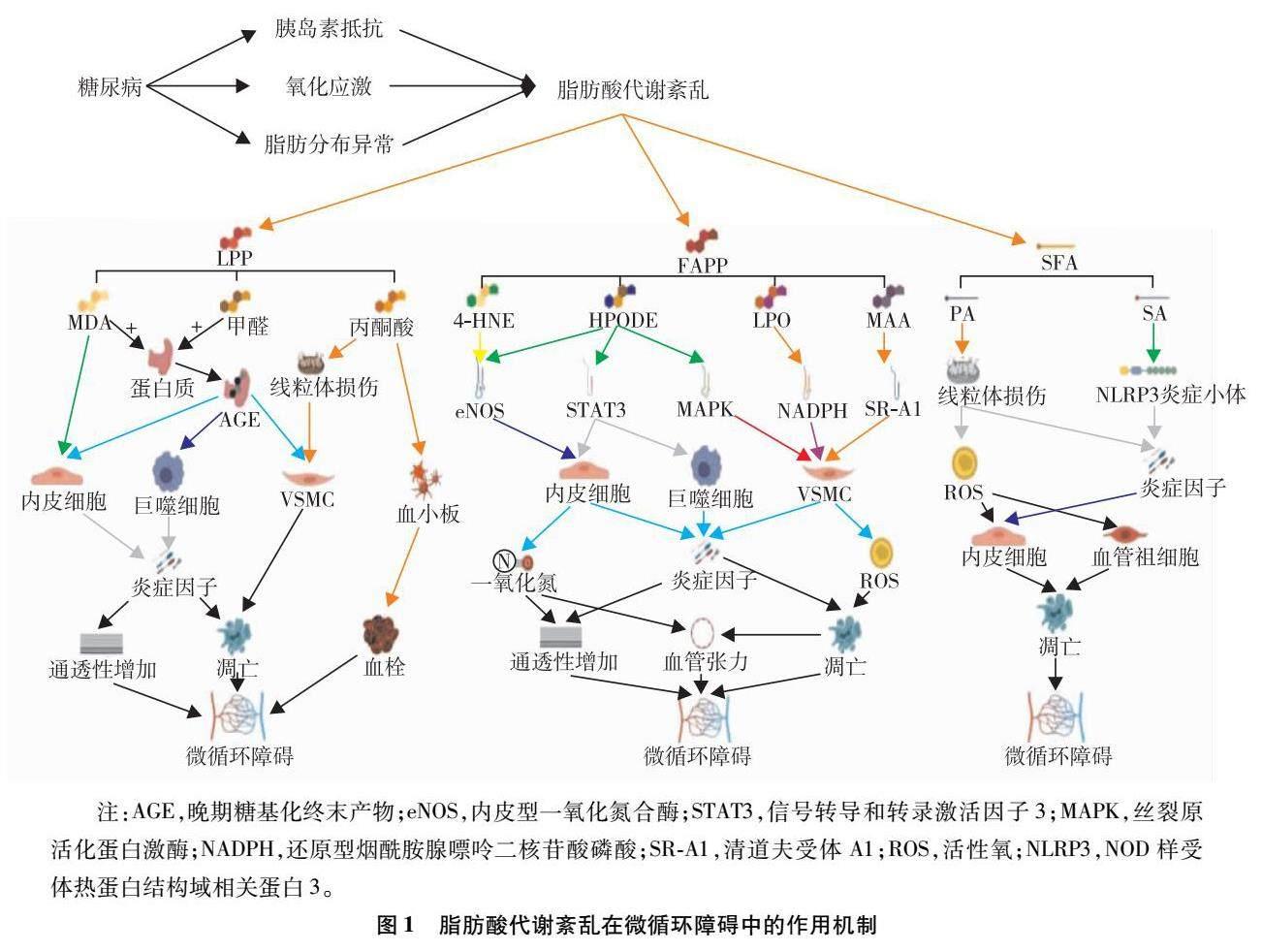
LPP是糖尿病脂肪酸代謝紊亂的標志性毒性代謝產物。LPP是指在脂質過度氧化過程中生成的多種羥基化合物,其特點包括高度反應性、易與細胞膜和蛋白質結合、可導致細胞內部環境發生變化并影響細胞功能。在糖尿病患者中LPP主要包括MDA、丙酮酸以及甲醛等,這些產物可導致氧化應激以及局部炎癥反應,加速血管內皮細胞、平滑肌細胞和血小板等細胞的損傷,進而導致微循環障礙[9]。概括的作用機制見圖1。

圖1 ?脂肪酸代謝紊亂在微循環障礙中的作用機制
2.1 ?MDA
研究[10]表明,MDA與微循環障礙密切相關,MDA的水平可用來評估微循環功能的改變和疾病的進展。在一項關于尿毒癥引起的血管功能障礙的研究[11]中,研究者發現抑制MDA的生成和代謝可改善糖尿病患者的微循環功能,減少并發癥的發生。MDA對血管內皮細胞有直接的損傷作用,可誘導細胞凋亡和內皮細胞功能的異常及凋亡。其次,MDA還可誘導巨噬細胞對微循環的浸潤,產生包括白細胞介素-1β、腫瘤壞死因子-α等炎癥因子,誘導內皮細胞及血管平滑肌細胞損傷,最終導致微循環血管舒張功能障礙,血流灌注下降。MDA可與氨基酸和蛋白質反應,形成高度不穩定的羧基化產物,稱為晚期糖基化終末產物。在一項關于多囊卵巢綜合征病理機制的研究[12]中,研究者發現晚期糖基化終末產物可直接或間接地導致細胞膜脂質的氧化和結構損傷,導致細胞膜的通透性增加,進而影響微循環的正常功能。此外,MDA也可誘導血小板激活和血栓形成。在一項關于糖尿病患者血小板功能的研究[13]中,研究者發現MDA可促進血小板聚集和血栓素A2的合成與釋放,從而促進血小板的激活和血栓形成。
2.2 ?丙酮酸
丙酮酸是一種由脂肪酸和糖分解產生的LPP。丙酮酸水平在糖尿病時異常升高,對血管微循環功能產生不良影響。丙酮酸可促進內皮細胞的氧化應激和炎癥反應,導致內皮細胞損傷和血管擴張功能降低,進而引起微循環障礙。這一觀察得到了Sun等[14]的研究支持,他們發現環境空氣污染物暴露的小鼠表現出全身胰島素抵抗、全身炎癥和內臟脂肪增加,這些都可能與丙酮酸的作用有關。其次,丙酮酸可抑制電子傳遞鏈,影響能量代謝,導致內皮細胞的功能障礙和缺血,最終影響血管內皮功能。Salmon等[15]的研究討論了內皮糖皮質在疾病中的功能障礙,包括丙酮酸可能引起的內皮細胞功能障礙和微循環障礙。此外,丙酮酸還可影響血小板功能和血液流變學,增加血栓形成風險,也可能是導致微循環障礙的原因之一。Cooper等[16]的研究討論了高胰島素血癥、鎂、維生素D、血栓和COVID-19之間的關系,可能與丙酮酸引起的血小板功能障礙和血液流變學改變有關。
2.3 ?甲醛
脂質過氧化可導致脂肪酸、磷脂和膽固醇的氧化分解,進而形成一系列的活性氧自由基和反應性代謝產物,其中包括甲醛。甲醛可與氨基酸、核酸等生物分子發生縮合反應,形成穩定的加合物,從而導致蛋白質和核酸的功能失調。這些加合物可能會激活炎癥反應、促進氧化應激和細胞凋亡等過程,進而導致血管內皮細胞損傷和血管收縮,最終導致血管微循環障礙。Lozano等[17]發現,高脂飲食和高脂高果糖飲食8個月后大鼠的脂質過氧化水平及甲醛水平顯著升高,導致了血管微循環損傷,表現為腸系膜動脈的內皮源性超極化因子介導的松弛反應減弱等。
3 ?FAPP
高血糖狀態下,過多的葡萄糖在線粒體中被氧化,釋放大量的氧自由基,作用于脂肪酸分子最終產生FAPP。FAPP是一類非常活潑的氧化物質,可通過損傷膜脂、影響細胞信號傳遞和抑制酶活性等多種機制導致微循環障礙。典型的FAPP包括4-HNE、HPODE、MAA以及LPO等。在誘發微循環障礙中的作用機制見圖1。
3.1 ?4-HNE
4-HNE是由于脂肪酸受到氧化應激作用后產生的一種反應性代謝產物。研究[18]表明,糖尿病狀態是4-HNE產生的重要原因之一。研究[19]發現,4-HNE能通過抑制內皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的輔助因子BH4降低eNOS活性,使NO生成減少,進而產生抑制影響血管內皮細胞功能,影響微循環血管張力調控。Guo等[20]的研究表明,對4-HNE的清除可有效降低腦卒中的發生概率,提示4-HNE在誘發血管損傷中扮演重要的角色。此外,既往研究[21]表明,4-HNE激活STAT3(信號轉導及轉錄激活蛋白3)信號通路,促進IL6以及TNFα等炎性細胞因子的合成和釋放,增加血管壁的滲透性,導致微血管漏出和組織水腫,參與微循環障礙的發生發展的病理生理過程。
3.2 ?HPODE
花生四烯酸是一種多不飽和脂肪酸,是細胞膜磷脂中的一種重要成分,可被多種酶類催化氧化成為一系列生物活性物質,包括HPODE。在糖尿病患者中,HPODE是一種常見的FAPP,也是導致微循環障礙的重要因素之一。Ramasamy等的研究表明,HPODE可影響細胞中eNOS的表達水平[22],進而引起NO合成量降低使血管舒張能力下降。Natarajan等[23]的研究表明,HPODE可通過Ras及MAPK信號通路誘發VSMCs內多種炎癥基因表達,導致血管局部炎癥反應。此外,HPODE也可通過影響主動脈內皮細胞HO1信號通路,引起血管內皮細胞的凋亡和炎癥反應的增加,從而損傷血管內皮層,加速微循環障礙的進程。研究[24]表明,HPODE還能通過激活NADPH氧化酶(NADPH oxidase,NOX)和誘導內皮細胞線粒體氧化損傷的方式,增加內皮細胞和巨噬細胞中的活性氧簇生成,導致氧化應激反應的增強,損傷血管壁,從而導致微循環障礙的發生和發展。因此,HOPDE在糖尿病患者中的異常產生和積累,對于微循環障礙的發生和進展起到了重要作用。
3.3 ?MAA
MAA是由脂肪酸過氧化產物與醛類物質如MDA或丙酮反應形成的復合物,其在糖尿病相關并發癥中發揮了重要作用。研究[25]發現,在高脂飲食喂養的動脈粥樣硬化小鼠模型中,MAA能誘導內皮細胞、平滑肌細胞以及巨噬細胞產生一系列炎癥反應,進而引起微循環的結構性損傷。此外,MAA還能通過激活清道夫受體A1(SR-A1),影響NF-κB信號通路,促進氧化應激和炎癥反應的產生,從而導致血管內皮功能異常和微循環障礙[26]。
3.4 ?LPO
LPO是一類在脂肪酸過氧化反應中生成的氧化產物。在糖尿病的胰島素抵抗狀態下,過量的游離脂肪酸被攝入細胞,導致脂肪酸代謝紊亂和過氧化反應的增加。這些反應導致LPP的生成,包括LPO[27]。LPO在糖尿病中被認為是導致微循環障礙的關鍵因素之一。Pavelkina等[28]在對出血熱腎病綜合征(HFRS)腎臟微循環障礙的研究中發現,LPO可影響微循環內皮的細胞膜通透性,最終導致顯著的腎臟微循環障礙。此外,LPO被發現與高靜水壓誘導的VSMCs功能障礙密切相關[29]。LPO的水平糖尿病腎病的發生密切相關,通過補充銀杏葉提取物等降低LPO水平有助于改善糖尿病腎病動物的腎臟微循環[30]。
4 ?SFA
糖尿病患者體內SFA的水平顯著升高,與胰島素抵抗、營養不良以及慢性炎癥反應有關。胰島素抵抗的情況會導致脂肪酸在脂肪細胞中的儲存發生障礙,釋放進入血液循環[31]。營養不良是糖尿病的常見伴隨癥狀之一,導致體內蛋白質分解代謝加快,同時也會引起脂肪酸代謝異常,導致水平升高[32]。糖尿病患者常伴隨有慢性低度炎癥,炎癥狀態也會刺激脂肪細胞釋放SFA[33]。參與微循環障礙的機制如圖1所示。
4.1 ?PA
近年來的研究表明,PA可能與微循環障礙存在關聯。一些研究發現,在糖尿病患者中,血液中PA的水平明顯升高,且這種升高與微血管并發癥的發生密切相關[34]。研究[35]還發現,PA可引起內皮細胞功能異常,增加內皮細胞向白細胞的黏附,促進炎癥反應,從而導致微循環障礙的發生和發展。PA也可能通過誘導氧化應激反應來促進微循環障礙的發生。糖尿病患者常處于氧化應激狀態,而PA的過多攝入可能加劇氧化應激反應,導致微循環障礙的發生[36]。
4.2 ?SA
在高脂飲食或糖尿病的情況下,SA可通過增加內皮細胞的氧化應激和炎癥反應來影響微循環功能。研究[37]發現,SA誘發循環血管祖細胞凋亡,而后者是微循環形成中的重要細胞成分。此外,SA還可通過激活NLRP3炎癥小體來誘導炎癥反應,從而損傷內皮細胞并導致微循環障礙[38]。
5 ?治療進展
針對糖尿病微循環障礙的發病機制,近年來,研究者們也出現了一些新的治療方案。一些抗氧化劑被認為在治療糖尿病微循環障礙中有效。研究[39]表明,抗氧化劑如維生素E、維生素C、多酚等可減少LPP的生成,從而減輕糖尿病引起的微循環障礙。除此之外,一些抗氧化劑如乙酰半胱氨酸等還可降低糖尿病患者血清中的LPP水平,降低脂質過氧化的損害[40]。研究發現,一些針對細胞焦亡的藥物可能對糖尿病微循環障礙有效。如caspase-1抑制劑VX-765、Gasdermin D(GSDMD)抑制劑Disulfiram以及NLRP3炎性小體抑制劑MCC950可顯著改善糖尿病腎病及糖尿病視網膜病變動物模型的微循環障礙[41]。抗VEGF藥物已被研究作為治療糖尿病視網膜病變和糖尿病黃斑水腫的潛在治療方法,代表性的藥物如Aflibercept及Faricimab等被證實可降低糖尿病視網膜病變惡化的風險,并減少新的黃斑水腫的發生[42]。Takeda G蛋白偶聯受體5在糖尿病微循環障礙中扮演重要角色,參與調控內皮細胞功能,其激動劑Compound12被認為可改善糖尿病腎病[43]。還有一些藥物也被證明可減輕糖尿病相關的微循環障礙。例如,α-硫辛酸可減輕糖尿病引起的神經病變和微循環障礙[44]。醛糖還原酶抑制劑也可減少脂質過氧化的生成,從而降低糖尿病相關的微循環障礙[45]。還有一些中成藥及中藥單體,如益氣解毒化瘀湯α-藤黃酮等,也可通過作用于JNK、ERK1/2等關鍵信號通路改善糖尿病視網膜病變的病理變化[46]。此外,一些物理療法也被證實有效。研究[47]表明靜態磁場可增加血管擴張劑維拉帕米的療效,對糖尿病足及糖尿病腎病有效。然而,目前這些治療方法雖然大部分都還處于臨床前的研究階段,需進一步的臨床實驗證實其療效,但它們為防治糖尿病引起的微循環障礙提供了新的思路和希望。
6 ?展望
盡管對糖尿病相關的脂肪酸代謝紊亂和微循環障礙已有一定的理解,但仍存在許多未解決的問題和挑戰。首先,目前的研究大多基于動物模型和體外細胞實驗,其結果可能并不能完全反映人體內的實際情況。因此,需更多的臨床研究來驗證這些發現,并探索脂肪酸代謝紊亂如何影響糖尿病患者的生活質量和并發癥的風險。其次,需更全面地理解脂肪酸代謝紊亂如何影響微循環。這不僅包括生物化學的機制,還包括臨床的影響,如如何影響疾病的治療和管理。此外,也需更深入地研究脂肪酸代謝紊亂與微循環障礙之間的因果關系,以及如何通過調節脂肪酸代謝來改善微循環障礙。最后,需利用新的技術和指標來研究脂肪酸代謝紊亂和微循環障礙,如對超聲造影以及血流儲備分數等先進檢查手段的探索,結合新型生物標記物的檢測,以更準確地反映微循環的狀態。
7 ?小結
本綜述探討了糖尿病相關的脂肪酸代謝紊亂與微循環障礙的關系。筆者闡述了脂肪酸代謝紊亂通過生成一系列的毒性代謝產物,通過多種機制導致構成微循環的細胞結構及功能受損,最終引發微循環障礙。目前雖有一些針對上述病理生理過程的治療策略出現,但仍未能解決這一重大的臨床問題。總之,需進一步深入研究糖尿病脂肪酸代謝紊亂對血管微循環的影響,以便開發更有效的治療策略,提高糖尿病患者的生活質量和預后。
參考文獻
[1] Wali?JA,Jarzebska N,Raubenheimer D,et al.?Cardio-metabolic effects of high-fat diets and their underlying mechanisms—A?narrative review[J]. Nutrients,2020,12(5):1505.
[2] Lytrivi?M,Castell AL,Poitout V,et al.?Recent insights into mechanisms of β-cell lipo- and glucolipotoxicity in type 2 diabetes[J].?J Mol Biol,2020,432(5):1514-1534.
[3] 中國微循環學會糖尿病與微循環專業委員會. 糖尿病微循環障礙臨床用藥專家共識(2021年版)[J]. 中國醫學前沿雜志(電子版),2021,13(4):49-57.
[4] Jaganjac M,Zarkovic N. Lipid peroxidation linking diabetes and cancer:the importance of 4-Hydroxynonenal[J]. Antioxid Redox Signal,2022,37(16-18):1222-1233.
[5] Demir S,Nawroth PP,Hering S,et al.?Emerging targets in type 2 diabetes and diabetic complications[J]. Adv Sci (Weinh),2021,8(18):e2100275.
[6] Ali J,Aziz MA,Rashid MMO,et al.?Propagation of age-related diseases due to the changes of lipid peroxide and antioxidant levels in elderly people:a narrative review[J]. Health Sci Rep,2022,5(3):e650.
[7] Lovegrove JA. Dietary dilemmas over fats and cardiometabolic risk[J]. Proc Nutr Soc,2020,79(1):11-21.
[8] Cheng YY,Qu SL,Liu YJ,et al.?Meta-analysis of the epidemiology of microvascular complications in people with type 2 diabetes in mainland China[J]. Glob J Obes Diabetes Metab Syndr,2020,7(2):18-23.
[9]Dasu MR,Jialal I. Free fatty acids in the presence of high glucose amplify monocyte inflammation via Toll-like receptors[J]. Am J Physiol Endocrinol Metab,2011,300(1):E145-E154.
[10] Mas-Bargues C,Escrivá?C,Dromant M,et al. Lipid peroxidation as measured by chromatographic determination of malondialdehyde. Human plasma reference values in health and disease[J]. Arch Biochem Biophys,2021,709:108941.
[11] Brunet P,Gondouin B,Duval-Sabatier A,et al. Does uremia cause vascular dysfunction?[J]. Kidney Blood Press Res,2011,34(4):248-290.
[12] Rudnicka E,Suchta K,Grymowicz M,et al. Chronic low grade inflammation in pathogenesis of PCOS[J]. Int J Mol Sci,2021,22(7):3789.
[13] Ni H. The platelet “sugar high” in diabetes[J]. Blood,2012,119(25):5949-5951.
[14] Sun Q,Yue P,Deiuliis JA,et al. Ambient air pollution exaggerates adipose inflammation and insulin resistance in a mouse model of diet-induced obesity[J]. Circulation,2009,119(4):538-546.
[15] Salmon AHJ,Satchell SC. Endothelial glycocalyx dysfunction in disease:albuminuria and increased microvascular permeability[J]. J Pathol,2012,226(4):562-574.
[16] Cooper ID,Crofts CAP,DiNicolantonio JJ,et al. Relationships between hyperinsulinaemia,magnesium,vitamin D,thrombosis and COVID-19:rationale for clinical management[J]. Open Heart,2020,7(2):e001356.
[17] Lozano I,van der Werf R,Bietiger W,et al. High-fructose and high-fat diet-induced disorders in rats:impact on diabetes risk,hepatic and vascular complications[J]. Nutr Metab(Lond),2016,13:15.
[18] Dham D,Roy B,Gowda A,et al. 4-Hydroxy-2-nonenal,a lipid peroxidation product,as a biomarker in diabetes and its complications:challenges and opportunities[J]. Free Radic Res,2021,55(5):547-561.
[19] Whitsett J,Picklo?MJ?Sr,Vasquez-Vivar J. 4-Hydroxy-2-nonenal increases superoxide anion radical in endothelial cells via stimulated GTP cyclohydrolase proteasomal degradation[J]. Arterioscler Thromb Vasc Biol,2007,27(11):2340-2347.
[20] Guo JM,Liu AJ,Zang P,et al. ALDH2 protects against stroke by clearing 4-HNE[J]. Cell Res,2013,23(7):915-930.
[21] Hosoi T,Kuwamura A,Thon M,et al. Possible involvement of 4-hydroxy-2-nonenal in the pathogenesis of leptin resistance in obesity[J]. Am J Physiol Cell Physiol,2019,316(5):C641-C648.
[22] Ramasamy S,Parthasarathy S,Harrison DG. Regulation of endothelial nitric oxide synthase gene expression by oxidized linoleic acid[J]. J Lipid Res,1998,39(2):268-276.
[23] Natarajan R,Reddy MA,Malik KU,et al. Signaling mechanisms of nuclear factor-kappab-mediated activation of inflammatory genes by 13-hydroperoxyoctadecadienoic acid in cultured vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol,2001,21(9):1408-1413.
[24] Biswas P,Swaroop S,Dutta N,et al. IL-13 and the hydroperoxy fatty acid 13(S)HpODE play crucial role in inducing an apoptotic pathway in cancer cells involving MAO-A/ROS/p53/p21 signaling axis[J]. Free Radic Biol Med,2023,195:309-328.
[25] Duryee MJ,Clemens DL,Opperman PJ,et al. Malondialdehyde-acetaldehyde modified (MAA) proteins differentially effect the inflammatory response in macrophage,endothelial cells and animal models of cardiovascular disease[J]. Int J Mol Sci,2021,22(23):12948.
[26] Sapkota M,DeVasure JM,Kharbanda KK,et al. Malondialdehyde-acetaldehyde (MAA) adducted surfactant protein induced lung inflammation is mediated through scavenger receptor a (SR-A1)[J]. Respir Res,2017,18(1):36.
[27] Lawrence JR,Campbell GR,Barrington H,et al. Clinical and biochemical determinants of plasma lipid peroxide levels in type 2 diabetes[J]. Ann Clin Biochem,1998,35(Pt3):387-392.
[28] Pavelkina VF,Abrashina IV,Kovalenko EN,et al.?Oxidative stress and the state of antioxidant defenses in hemorrhagic fever with renal syndrome[J]. Pulse,2021,23(11):48-50.
[29] Jin R,Yang R,Cui C,et al. Ferroptosis due to cystathionine γ lyase/hydrogen sulfide downregulation under high hydrostatic pressure exacerbates VSMC dysfunction[J]. Front Cell Dev Biol,2022,10:829316.
[30] Hidayat R,Wulandari P. Effects of andrographis paniculata (Burm. F.) extract on diabetic nephropathy in rats[J]. Rep Biochem Mol Biol,2021,10(3):445-454.
[31] Palomer X,Pizarro-Delgado JP,Barroso E,et al. Palmitic and oleic acid:the Yin and Yang of fatty acids in type 2 diabetes mellitus[J]. Trends Endocrinol Metab,2018,29(3):178-190.
[32] Knebel B,Müller-Wieland D,Kotzka J. Lipodystrophies—Disorders of the fatty tissue[J]. Int J Mol Sci,2020,21(22):8778.
[33] Tang C,Deng X,Qu J,et al.?Fenofibrate attenuates renal tubular cell apoptosis by up-regulating MCAD in diabetic kidney disease[J]. Drug Des Devel Ther,2023,17:1503-1514.
[34] Pillon NJ,Azizi PM,Li YE,et al. Palmitate-induced inflammatory pathways in human adipose microvascular endothelial cells promote monocyte adhesion and impair insulin transcytosis[J]. Am J Physiol Endocrinol Metab,2015,309(1):E35-E44.
[35] Sindhu S,Akhter N,Wilson A,et al. MIP-1α expression induced by co-stimulation of human monocytic cells with palmitate and TNF-α involves the TLR4-IRF3 pathway and is amplified by oxidative stress[J].?Cells,2020,9(8):1799.
[36] Spigoni V,Fantuzzi F,Fontana A,et al. Stearic acid at physiologic concentrations induces in vitro lipotoxicity in circulating angiogenic cells[J]. Atherosclerosis,2017,265:162-171.
[37] Karasawa T,Kawashima A,Usui-Kawanishi F,et al. Saturated fatty acids undergo intracellular crystallization and activate the NLRP3 inflammasome in macrophages[J]. Arterioscler Thromb Vasc Biol,2018,38(4):744-756.
[38] Rahimi-Madiseh M,Malekpour-Tehrani A,Bahmani M,et al. The research and development on the antioxidants in prevention of diabetic complications[J]. Asian Pac J Trop Med,2016,9(9):825-831.
[39] Augustine J,Troendle EP,Barabas P,et al. The role of lipoxidation in the pathogenesis of diabetic retinopathy[J]. Front Endocrinol (Lausanne),2021,11:621938.
[40] Kurutas EB. The importance of antioxidants which play the role in cellular response against oxidative/nitrosative stress:current state[J]. Nutr J,2016,15(1):71.
[41] Gu J,Geng K,Guo M,et al. Targeting pyroptosis:new insights into the treatment of diabetic microvascular complications[J]. Evid Based Complement Alternat Med,2022,2022:5277673.
[42] Bahr TA,Bakri SJ. Update on the management of diabetic retinopathy:anti-VEGF agents for the prevention of complications and progression of nonproliferative and proliferative retinopathy[J]. Life(Basel),2023,13(5):1098
[43] Zhang M,Dong Z,Dong W,et al. Role of Takeda G protein?coupled receptor 5 in microvascular endothelial cell dysfunction in diabetic retinopathy (Review)[J]. Exp Ther Med,2022,24(5):674.
[44] Jiao S,Dong Y,Chang X,et al. Effects of α lipoic acid combined with olmesartan medoxomil on blood glucose and oxidation indicators in patients with diabetic nephropathy:a protocol for a parallel,randomized,double-blind,controlled clinical trial[J]. Medicine(Baltimore),2022,101(17):e29080.
[45] Thakur S,Gupta SK,Ali V,et al. Aldose reductase:a cause and a potential target for the treatment of diabetic complications[J]. Arch Pharm Res,2021,44(7):655-667.
[46] Xuan C,Ding W,Zhan L,et al.?Potential Mechanisms of Yiqi Jiedu Huayu Decoction in the Treatment of Diabetic Microvascular Complications Based on Network Analysis,Molecular Docking,and Experimental Validation[J]. Evid Based Complement Alternat Med,2023,2023:5034687.
[47] Gmitrov J. Static Magnetic Field Versus Systemic Calcium Channel Blockade Effect on Microcirculation:Possible Mechanisms and Clinical Implementation[J]. Bioelectromagnetics,2020,41(6):447-457.
.
稿日期:2023-06-04