姜黃素納米顆粒聯合可注射水凝膠用于改善心肌梗死后微環境的體外效果評價研究
岳田 黃剛 楊佳麗 何建 旦增頓珠 高寒 秦珊珊 侯君 徐俊波
【摘要】目的?為探索心肌梗死后的新治療策略,本研究結合生物材料探索心肌梗死后惡劣微環境的改善策略。方法?通過對生物相容的透明質酸改性與羧甲基殼聚糖共同制備可注射水凝膠,同時制備納米膠束包載的姜黃素(PP@Cur)用以改善心肌細胞的凋亡。通過流式細胞術、熒光染色驗證了Cur納米膠束的微環境改善作用以及心肌細胞保護作用。結果?Cur納米顆粒結合水凝膠能夠改善心肌梗死后的高炎癥和高活性氧環境。結論 ?生物材料結合納米遞送平臺用于梗死心臟微環境改善是可行的并且有望成為心肌梗死治療的重要研究方向。
【關鍵詞】心肌梗死;微環境;炎癥;活性氧;心肌細胞凋亡
【DOI】10.16806/j.cnki.issn.1004-3934.2024.02.000
Evaluation Study of the in Vitro Effect of Curcumin Nanopartrticle Combined with Injectable Hydrogel for Improving the Microenvironment after Myocardial Infarction
YUE Tian1,2,HUANG?Gang1,YANG Jiali2,HE?Jian2,Danzen Dunzhu3,GAO?Han3,QIN?Shanshan3,HOU?Jun1,XU?Junbo1
(1.Department of Cardiology,Chengdu Third Peoples Hospital/Affiliated Hospital of Southwest Jiaotong University,Chengdu?610014,China;2.School of Life Science and Engineering,Southwest Jiaotong University,Chengdu?610031,China;3.Medical College,Tibet University,Lhasa?850000,China)
【Abstract】Objective?In order to explore new therapeutic strategies after myocardial infarction, this study explores the improvement of the harsh microenvironment after myocardial infarction by combining biomaterials. Methods?Injectable hydrogels were prepared by biocompatible modified hyaluronic acid and?carboxymethyl chitosan, and curcumin nanomicelles (PP@Cur) were prepared to correct?the apoptosis of cardiomyocytes. The microenvironmental ameliorating effect?and cardiomyocyte protective effect of Cue nanomicelles were verified by flow cytometry and fluorescence staining. Results?Cur nanoparticles combined with hydrogel can correct?the high inflammation and high reactive oxygen species environment after myocardial infarction.Conclusion?The combination of biomaterials and nano delivery platforms for correct?the microenvironment of infarcted hearts is feasible and has potential to become an important research direction for the treatment of myocardial infarction.
【Keywords】Myocardial infarction;Microenvironment;Inflammation;Reactive oxygen species;Cardiomyocyte apoptosis
心肌梗死是由于心臟急慢性缺血,導致心臟功能部分喪失的疾病[1]。臨床采用溶栓、經皮冠狀動脈介入治療以及冠狀動脈旁路移植術等手段修復心肌細胞的血流供應,由于心臟功能的不可逆喪失,患者的預后并不理想。迫切地需要新的治療手段來改善患者心肌梗死治療后的預后[2]。
通常,心肌梗死后的組織修復分為三個階段,即梗死期、急性炎癥期和修復期[3]。其中第三階段與心肌梗死后修復直接相關,并影響著患者的預后。恢復期內,隨著滲漏內容物的清除,機體進入慢性炎癥階段(修復階段),在梗死環境中,持續的炎癥上調NOD樣受體熱蛋白結構域相關蛋白3炎癥小體的表達[4],過度的炎癥小體激活會產生不利的影響,其次細胞外基質中的過量活性氧(reactive oxygen species,ROS)的積累也進一步地損傷心肌細胞[5],隨后心臟負荷增加并進一步損傷心肌細胞,造成心肌細胞不斷損失的惡性循環并最終走向心力衰竭[6]。因此,針對心肌梗死后的炎癥和ROS進行治療,能夠在一定程度上延緩心肌細胞的持續損傷,延緩心室重塑、纖維化過程并減少心力衰竭的可能[7-8]。然而,由于心臟組織跳動的特性,藥物在損傷組織內的富集量低、駐留時間短限制了該治療策略微環境改善作用。
隨著生物材料研究的不斷發展,可植入生物材料在組織修復中展現出良好的應用前景[9]。其中,可注射水凝膠因其生物相容性極佳、能夠軟化瘢痕同時能夠為損傷的心臟組織提供機械支撐而被廣泛研究[10-11]。然而水凝膠本身并不具有治療作用,需要結合其他的治療藥物進行治療。姜黃素(curcumin,Cur),一種植物來源的多酚類化合物,因其具有抗炎抗氧化的特性,成為理想的微環境改善活性分子[12-17]。然而,水溶性差,口服給藥利用率低限制了Cur在心肌梗死治療中的應用,經納米膠束包裹可以有效增加藥物利用率[18]。
基于此,本課題設計制備了一種以氧化透明質酸(oxidized hyaluronic acid,OHA)、羧甲基殼聚糖(carboxymethyl chitosan,CMCs)為基材的希夫堿可注射水凝膠,同時負載由聚乙二醇(polyethylene glycol,PEG)-聚己內酯(polycaprolactone,PCL)包裹的Cur納米顆粒(PP@Cur),用以改善心肌梗死后微環境。通過體外細胞實驗詳細驗證了其微環境改善作用,包括可注射水凝膠以及納米顆粒的細胞生物相容性、對巨噬細胞極化的影響、自由基清除效果、對細胞內活性氧水平的影響。
1??材料與方法
1.1??主要實驗試劑
主要實驗試劑包括:透明質酸(hyaluronic acid,HA)(Mw=80萬)、CMCs(Mw=240萬,脫乙酰度>90%,取代度>80%)、PEG(Mw=2?000)、Cur、高碘酸鈉、2',7'-二氯熒光素二乙酸酯(2′,7′-Dichlorodihydrofluorescein diacetate,DCFH-DA)、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH)、丁二酸酐、苯甲醇、ε-己內酯均購自中國上海畢得醫藥科技股份有限公司;二環己基碳二亞胺、4-二甲氨基吡啶均購自日本東京化成工業株式會社;吡啶、乙二醇、二氯甲烷、氯仿、苯甲醇均購自中國成都科隆試劑;鈣黃綠素、碘化丙啶來自中國上海碧云天生物技術股份有限公司;生物試劑均來自中國武漢普諾賽生命科技有限公司;Elisa試劑盒購自中國江蘇酶免實業有限公司;H9C2細胞系由中國西部戰區總醫院惠贈;RAW264.7細胞系由中國西南交通大學生命科學與工程學院惠贈。
1.2??可注射水凝膠的制備
1.2.1??HA的氧化改性
HA 10.00?g,溶解于90?mL去離子水。高碘酸鈉0.60?g溶解于10?mL去離子水,高碘酸鈉水溶液加入HA中,室溫避光反應5?h。1?mL乙二醇終止反應。去離子水,8?000~14?000分子量透析48?h,凍干獲得OHA。
1.2.2??可注射水凝膠的制備
OHA(2.5% w/v)與CMCs(5% w/v)等體積混合觀察水凝膠成膠時間,26?G針頭注射。
1.3??納米膠束的制備
1.3.1??羧基化PEG的制備
PEG 10.00?g溶解于100?mL氯仿,加入丁二酸酐1.97?g及1?mL吡啶,60?℃反應8?h,除去溶劑,50?mL二甲基亞砜溶解后,1?000分子量對去離子水透析48?h,經凍干獲得羧基化PEG。
1.3.2 ?PCL的聚合制備
重蒸ε-己內酯10.00?g,苯甲醇129.60?mg及氯化亞錫101.70?mg均勻混合。真空干燥5?h,升溫至140?℃反應6?h。冷卻后,5?mL二氯甲烷溶解,溶液緩慢滴加進50?mL冰乙醇中并持續攪拌,過濾冰乙醇清洗干燥獲得PCL。
1.3.3??PEG-PCL聚合物制備
羧基化PEG 1.60?g溶解至30?mL二氯甲烷中,加入二環己基碳二亞胺133.9?mg,室溫攪拌15?min后加入PCL 3.200?g及4-二甲氨基吡啶79.30?mg,氮氣保護室溫反應48?h,去離子水終止反應。過濾白色沉淀固體,除去溶劑后加入20?mL乙酸乙酯重新溶解,0?℃靜置12?h后過濾收集濾液,經減壓蒸餾,二氯甲烷重新溶解后滴入預冷的不斷攪拌的冰乙醇中,重復二氯甲烷溶解、冰乙醇析出過程3次,干燥后獲得PEG-PCL聚合物。
1.3.4??Cur的包封(PP@Cur)
10.00?mg PEG-PCL及1.00?mg?Cur溶解至10?mL四氫呋喃中,隨后將PEG-PCL及Cur的四氫呋喃溶液緩慢滴加進不斷攪拌的10?mL 磷酸緩沖液(phosphate buffer solution,PBS)中,保持轉速300?r/min直至四氫呋喃完全揮發。獲得載藥納米膠束溶液,隨后經過濾、凍干獲得黃色納米膠束粉末。
1.4??水凝膠及納米膠束的性能表征
1.4.1??水凝膠性能表征
傅里葉變換紅外光譜:分別稱取OHA、CMCs、凍干水凝膠樣品10.00?mg與20.00?mg溴化鉀粉末混合研磨后壓片,檢測400~4?000?cm-1范圍內的紅外吸收光譜。
成膠時間、可注射效果:將2.5%OHA的PBS溶液,與5%CMCs的PBS溶液等體積混合,羅丹明B染色,觀察并記錄至混合后的成膠時間。
流變學性能:制備直徑25?mm,厚度0.1?cm的水凝膠圓片,37?℃,測定水凝膠的儲能模量及損耗模量隨角頻率(0.1~100?rad/s)變化曲線。
掃描電子顯微鏡形貌觀察:水凝膠樣品經噴金(10?nm)后,掃描電子顯微鏡觀察水凝膠形貌。
水凝膠的溶脹性能檢測:水凝膠加入5?mL去離子水將其完全浸泡,37?℃環境下,記錄不同時間點膠體吸水后的質量,直至膠體吸水平衡且質量保持穩定后,達到溶脹平衡。設定時間點的凝膠質量[Wq(mg)]、凝膠的初始質量[Wp(mg)],用于計算溶脹百分比;溶脹百分比(%)=(Wq-Wp)÷Wp×100。
水凝膠的體外降解實驗:水凝膠加入10?mL PBS,37?℃,50?r/m振蕩,不同時間點取出凝膠凍干后記錄凝膠的質量。凝膠初始質量[W0(mg)]、設定時間點質量[Wt(mg)],用于計算降解百分數[ΔW(%)];ΔW(%)=(W0-Wt)÷Wt。
1.4.2??納米膠束的表征
動態光散射粒徑分布、電位檢測:納米顆粒經動態光散射儀檢測粒徑。馬爾文電位皿檢測并記錄納米膠束的電荷特性。
膠束的載藥率和包封率:膠束中的Cur的包載量通過紫外分光光度計(UV-VIS)檢測制備Cur標曲后,檢測納米顆粒中Cur含量計算載藥率[LC(%)]和包封率[EE(%)]。計算方法為:LC(%)=膠束中Cur質量÷膠束質量×100%;EE(%)=膠束中Cur質量÷Cur投料質量×100%。
膠束的藥物釋放考察:稱取20.00?mg膠束粉末,10?mL PBS復溶后,500分子量透析袋檢測不同時間袋外Cur釋放量。
載藥納米膠束的自由基清除效果評價:1?mg/mL的PP@Cur溶液,稀釋至100?μg/mL、50?μg/mL、25?μg/mL、0?μg/mL。采用DPPH法檢測PP@Cur的自由基清除效率(Dvc%)的計算方法為:Dvc%=(A空白-A陽性對照)÷A空白×100%。
納米膠束形貌檢測:1?mg/mL的PP@Cur,滴加至銅網上,1?min后吸去多余液體,重復兩次。1?%(w/w)的磷鎢酸復染,TEM下觀察納米膠束的形貌。
1.5??體外細胞實驗評價
無特殊說明,完全培養基均為含10%胎牛血清以及1%青霉素-鏈霉素(雙抗)的DMEM高糖培養基。
1.5.1??細胞相容性評價
細胞增殖與毒性檢測試劑盒(CCK-8)檢測:按CCK-8試劑盒說明書檢測細胞與200?μg/mL、100?μg/mL、50?μg/mL、25?μg/mL以及10?μg/mL納米顆粒/水凝膠培養24h后細胞活力。具有細胞、藥物溶液的孔的吸光度[A(加藥)],培養基吸光度[A(空白)]和細胞吸光度[A(0加藥)]用于計算細胞活力;細胞活力(%)=[A(加藥)-A(空白)]÷[A(0加藥)-A(空白)]×100%。
活/死染色:按細胞活/死染色試劑盒說明書檢測細胞與200?μg/mL、100?μg/mL、50?μg/mL、25?μg/mL以及10?μg/mL納米顆粒/水凝膠培養24?h后細胞活力。
1.5.2??巨噬細胞極化流式細胞儀檢測
脂多糖(50?ng/mL)、Cur(5?μg/mL)、PP@Cur(50?μg/mL)培養RAW264.7細胞系至48?h。藻紅蛋白標記的小鼠CD86流式抗體,4?℃孵育40?min。Triten-100破膜后,異硫氰酸熒光素標記的小鼠CD206流式抗體,4?℃孵育40?min。經流式細胞儀器檢測巨噬細胞的M1/M2表型。
1.5.3??DCFH-DA檢測細胞內ROS水平
H9C2細胞以5×105/孔,接種至24孔板,100?μM H2O2模擬高ROS環境24?h。DCFH-DA工作液與H9C2細胞共同孵育1?h,PBS清洗后,Hoechst33342工作液染色20?min(室溫)。熒光顯微鏡下觀察細胞內ROS分布。流式細胞儀定量檢測細胞內的ROS水平。
1.6??統計及分析方法
采用SPSS進行統計分析,Origin2023圖形繪制。無特殊說明n=3,計量資料服從正態分布的采用變量平均值±標準差表示,統計學差異采用t檢驗,“n.s.”表示無顯著性差異P>0.05,“*”表示顯著水平為0.05,“**”表示顯著水平為0.01,“***”表示顯著水平為0.001,“****”表示顯著水平為0.0001。
2??結果
2.1??可注射水凝膠的制備及表征
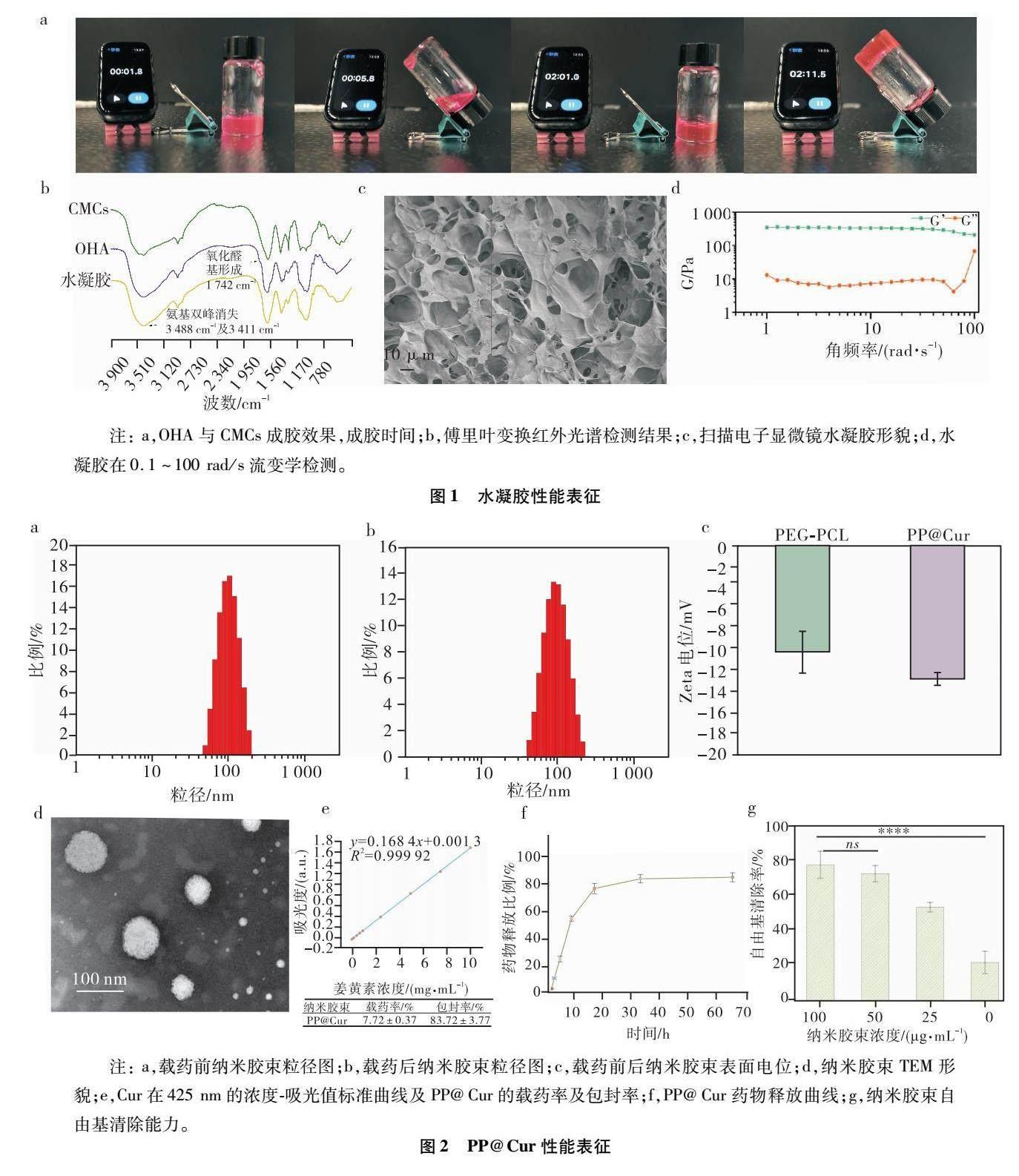
OHA中醛基與CMCs氨基,在pH=7.4時形成動態希夫堿鍵[19],交聯形成水凝膠。對成膠時間進行檢測(圖1a),可注射水凝膠在90?s左右凝固成膠。
傅里葉變換紅外光譜表明,OHA在1?724?cm-1出現明顯的吸收,此處的-C=O吸收表示醛基的形成。而在CMCs的紅外光譜中,3?488?cm-1處以及3?411?cm-1處的雙峰吸收表明CMCs中存在著裸露的氨基結構。形成水凝膠后,氨基的特征吸收以及醛基的特征吸收均消失,表明水凝膠通過希夫堿鍵進行交聯(圖1b)。隨后,通過掃描電子顯微鏡對水凝膠的表面形貌進行觀測。水凝膠呈現疏松多孔的結構,空隙大小處于10~50?μm之間,能夠實現納米膠束的包封(圖1c)。
通過對水凝膠進行流變性能檢測,在0.1~100?rad/s的往復運動范圍內,G均>G,表明水凝膠在往復運動的過程中,可以保持完整的凝膠狀態,不會因為運動碎裂,滿足心臟部位的注射及載藥需求(圖1d)。

2.2??納米膠束的制備與表征
納米膠束經DLS檢測(圖2a、b),載藥前的納米膠束粒徑分布于(82.95±3.87)nm,而載藥后的納米膠束粒徑分布在(106.10±2.44)nm,載藥前后均保持均勻的納米狀態。且載藥后納米膠束較載藥前增加,表明藥物的成功包載。隨后對納米膠束的表面電荷情況進行檢測(圖2c),納米膠束攜帶負電荷且載藥并不會改變其表面電荷狀態,表面的負電荷有利于降低納米膠束于細胞膜表面的親和,降低納米膠束的細胞毒性[20]。TEM的結果也表明納米膠束呈現均勻的球狀(圖2d),粒徑的分布與DLS結構符合[21]。
根據UV-VIS檢測結果,納米膠束中Cur的載藥率保持在(7.72±0.37)%,而包封率保持在(83.72±3.77)%(圖2e)。表明納米膠束能夠高效地包載。隨后進行藥物釋放實驗,在15?h內,藥物持續釋放,隨后達到釋放的穩定,并最終藥物的釋放達到80%(圖2f)。隨后DPPH證明了PP@Cur能夠有效地清除環境中的ROS(圖2g)。
2.3??載PP@Cur改善微環境及心肌細胞保護的體系細胞實驗評價
2.3.1??納米膠束及水凝膠的細胞相容性評價
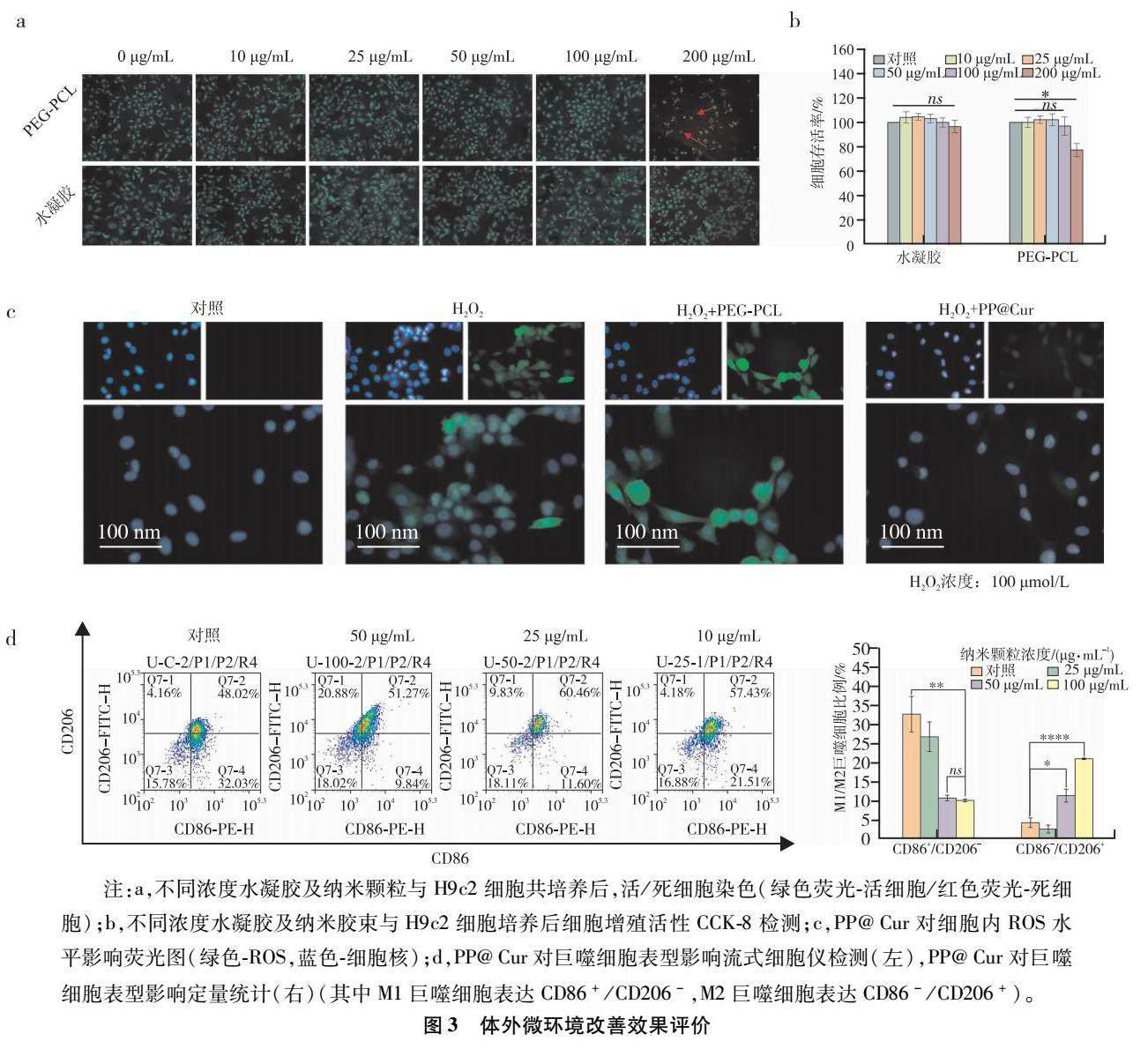
細胞活/死染色印證了材料細胞相容性良好(圖3a),細胞均呈現綠色熒光(活細胞)。根據CCK-8的檢測結果,經過36?h與細胞的共同培養,細胞并沒有明顯的死亡,均保持在90%以上,符合實驗及治療的需求(圖3b)。
2.3.2??納米膠束改善細胞內高ROS環境
細胞內的高ROS會誘發心肌細胞的持續凋亡,同時刺激炎癥細胞的激活[22],因此,改善細胞內外的高ROS有利于保持心臟功能,降低心肌細胞的進一步損傷。如圖所示,PP@Cur能夠有效地清除細胞內的ROS(圖3c)。

2.3.4??PP@Cur能夠有效促進巨噬細胞由M1向M2轉化
巨噬細胞的表型在一定程度上會影響微環境中炎癥水平[23]。因此,改變巨噬細胞的表型,尤其是促進巨噬細胞由M1向M2表型轉化有利于降低過度的炎癥反應,改善高炎癥微環境[24]。因此,本研究利用脂多糖建立心肌梗死后的高炎癥微環境。不同濃度的納米膠束進行治療。結果表明,隨著納米膠束的給藥濃度增加,M1表型的巨噬細胞比例逐步下降,而M2表型的巨噬細胞逐步增加(圖3d)。
3??討論
本研究成功設計和制備了負載PP@Cur的多糖水凝膠,并詳細闡述了水凝膠負載水凝膠用于心肌梗死后微環境改善的作用效果。簡言之,心肌梗死后微環境中的高ROS環境和炎癥環境造成心肌細胞持續凋亡,并造成心臟功能的持續損失,因此,損傷心肌微環境改善對心肌梗死后的預后影響顯著。
本研究通過模擬高炎癥環境和高ROS環境建立體外惡劣微環境,評價經治療后的巨噬細胞表型變化、炎癥因子分泌,PP@Cur能夠有效地促進巨噬細胞由促炎表型(M1)向炎癥抑制表型(M2)轉變,表型改變的巨噬細胞降低了促炎因子腫瘤壞死因子-α的表達、同時炎癥抑制因子白細胞介素-10表達升高。另一方面,PP@Cur能夠有效地清除自由基并降低高ROS環境下細胞內ROS水平。綜上,PP@Cur能夠有效地改善高ROS、高炎癥的惡劣微環境,為心肌梗死后組織修復創造良好環境。
作者貢獻聲明 ?徐俊波、侯君:提出并設計了本研究的實驗方案,對本研究做出了同等貢獻;岳田:完成了本研究的實驗,并撰寫了本文;楊佳麗、何健、旦增頓珠:對數據進行了分析;高寒、秦珊珊:對數據分析進行了校對
參 考 文?獻
[1]《中國心血管健康與疾病報告2022》編寫組. 《中國心血管健康與疾病報告2022》要點解讀[J]. 中國心血管雜志,2023,28(4):297-312.
[2]于超,王英杰,遲相林,等.2018年版歐洲動脈高血壓管理指南與中國高血壓防治指南在高血壓定義、分類與分層上的幾點異同[J].中華高血壓雜志,2019,27(9):811-813.
[3]Nian M,Lee P,Khaper N,et al. Inflammatory cytokines and postmyocardial infarction remodeling[J]. Circ?Res,2004,94(12):1543-1553.
[4]王麗鳳,任駿.NLRP3炎癥小體與心臟驟停復蘇后心肌缺血再灌注損傷的研究進展[J].生命科學,2023,35(11):1527-1534.
[5]Garcia-Gardu?o TC,Padilla-Gutierrez JR,Cambrón-Mora D,et al. RAAS:a?convergent player in ischemic heart?failure and cancer[J]. Int?J Mol?Sci,2021,22(13):7106.
[6]Braunwald E. Diabetes,heart?failure,and renal dysfunction:the vicious circles[J].?Prog?Cardiovasc?Dis,2019,62(4):298-302.
[7]Han?D,Wang?F,Qiao?Z,et al.?Neutrophil membrane-camouflaged nanoparticles alleviate inflammation and promote angiogenesis in ischemic myocardial injury[J].?Bioact?Mater,2022,23,369-382.
[8]Shilo?M,Oved?H,Wertheim?L,et al.?Injectable nanocomposite implants reduce ROS accumulation and improve heart?function after infarction[J].?Adv?Sci (Weinh),2021,8(24):e2102919.
[9]Leach DG,Young S,Hartgerink JD. Advances in immunotherapy delivery from implantable and injectable biomaterials[J].?Acta Biomater,2019,88:15-31.
[10]Liao X,Yang X,Deng H,et al. Injectable hydrogel-based nanocomposites for cardiovascular diseases[J].?Front?Bioeng?Biotechnol,2020,8:251.
[11]Tu Y,Chen N,Li C,et al. Advances in injectable self-healing biomedical hydrogels[J].?Acta Biomater,2019,90:1-20.
[12]余美榮,蔣福升,丁志山. 姜黃素的研究進展[J]. 中草藥,2009,40(5):828-831.
[13]Anand P,Kunnumakkara AB,Newman RA,et al. Bioavailability of curcumin:problems and promises[J].?Mol?Pharm,2007,4(6):807-818.
[14]Duan W,Yang Y,Yan J,et al. The effects of curcumin post-treatment against myocardial ischemia and reperfusion by activation of the JAK2/STAT3 signaling pathway[J].?Basic Res?Cardiol,2012,107(3):263.
[15]Geng HH,Li R,Su YM,et al.?Curcumin protects cardiac myocyte against hypoxia-induced apoptosis through upregulating miR-7a/b expression[J]. Biomed?Pharmacother,2016,81:258-264.
[16]Lin X,Liu Y,Bai A,et al. A viscoelastic adhesive epicardial patch for treating myocardial infarction[J]. Nat Biomed Eng,2019,3(8):632-643.
[17]Cai X,He Y,Cai L,et al. An injectable elastic hydrogel crosslinked with curcumin-gelatin nanoparticles as a multifunctional dressing for the rapid repair of bacterially infected wounds[J]. Biomater Sci,2023,11(9):3227-3240.
[18]Mohamed?S,Parayath?NN,Taurin?S,et al. Polymeric nano-micelles:versatile platform for targeted delivery in cancer[J].?Ther?Deliv,2014,5(10):1101-1121.
[19]Lu?CH,Yu?CH,Yeh?YC. Engineering nanocomposite hydrogels using dynamic bonds[J].?Acta Biomater,2021,130:66-79.
[20]Isoglu?IA,Ozsoy?Y,Isoglu?SD.?Advances in micelle-based drug delivery:cross-linked systems[J].?Curr?Top?Med?Chem,2017,17(13):1469-1489.
[21]Das?A,Yadav?N,Manchala?S,et al.?Mechanistic investigations of growth of anisotropic nanostructures in reverse micelles[J].?ACS Omega,2021,6(2):1007-1029.
[22]Peet C,Ivetic A,Bromage DI,et al. Cardiac monocytes and macrophages after myocardial infarction[J]. Cardiovasc Res,2020,116(6):1101-1112
[23]Kim?Y,Nurakhayev?S,Nurkesh?A,et al. Macrophage polarization in cardiac tissue repair following myocardial infarction[J].?Int?J Mol?Sci,2021,22(5):2715.
[24]Kologrivova?I,Shtatolkina?M,Suslova?T,et al. Cells of the immune system in cardiac remodeling:main players in resolution of inflammation and repair after myocardial infarction[J].?Front?Immunol,2021,12:664457.
收稿日期:2024-01-09