結直腸癌MMR表達與微衛星病灶狀態及預后水平的關聯研究*
韓金蘭,張惠瑞
(河南省濮陽惠民醫院 病理科,河南 濮陽 457000)
結直腸癌為臨床常見消化道惡性腫瘤,多見于40歲以上中老年男性群體,相關研究數據表明,此病患病在所有惡性腫瘤中居第三位,病死率居第五位[1]。目前針對早期結直腸癌臨床多以外科手術為主要治療方法,而對于病情已進展至中期、晚期,且已錯失手術最佳時機患者來說,含奧沙利鉑的一線化療更具臨床優勢[2]。盡管目前用于治療中晚期結直腸癌的手術及化療方案均已逐步成熟及規范化,但仍有部分患者治療后遠期生存率較低,常規治療方法難以實現對肉眼無法察覺的微小轉移病灶的有效治療[3]。近年有研究指出[4-5],基于遺傳學改變的錯配修復基因(MMR)表達缺失在結直腸癌的發病機制中有重要作用,與患者為微衛星病灶不穩定(MSI)也有密切關聯。為進一步優化中晚期結直腸癌患者的臨床治療方法,本研究旨在分析MMR基因表達情況與微衛星病灶狀態及預后水平的關聯。
1 資料與方法
1.1 一般資料
本次研究以2020年7月至2022年7月河南省濮陽惠民醫院收治的102例結直腸癌患者為研究對象,根據免疫組化檢測結果,將入組患者分為MMR表達缺失組(dMMR組,42例)和MMR完全表達組(pMMR組,60例),兩組患者一般資料比較見表1。本次研究已獲得醫院倫理委員會批準(T63738)。
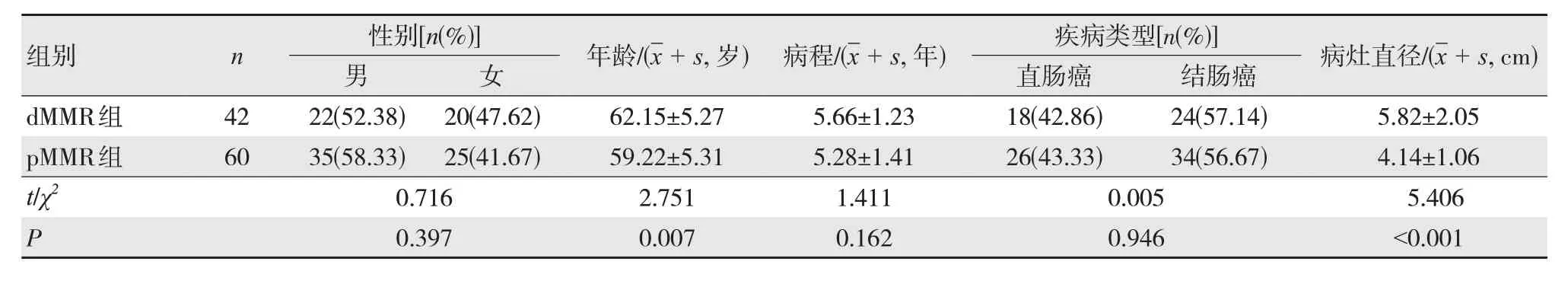
表1 兩組患者一般資料比較
納入標準:①符合結直腸癌診斷要點[6];②經臨床評估確認為中期、晚期患者;③符合含奧沙利鉑一線化療指征且自愿接受化療;④均已知悉此次研究試驗目的及內容,同意獲取并公開既往臨床資料。
排除標準:①早期結直腸癌者;②參與本研究前1個月內接受過其他相關化療者;③經臨床評估預計生存周期不足1年者;④臨床資料缺失者。
1.2 方法
MMR基因檢測方法:①將病灶組織進行常規石蠟切片后予以脫蠟,加入0.01 mmol/L的檸檬酸鈉緩沖溶液修復切片組織中抗原;加入濃度為3%的過氧化氫溶液(海德潤制藥,H11021382,3%)并于室溫下孵育10 min,然后封閉內源性過氧化氫酶。②應用磷酸鹽緩沖液對樣本進行反復沖洗,后加入1∶10的MMR單抗稀釋后孵育120 min;再次應用磷酸鹽緩沖液(北京生物制品研究所,S10850002)反復沖洗并加入MMR單抗后再孵育30 min經磷酸鹽緩沖液進行第3次反復沖洗后加入二氨基聯苯胺[北京沃凱生物科技有限公司,滬食藥監械(準)字2013第1401615號]進行原位雜交顯色反應。③依次采用蘇木素復染,經脫水、透明并應用中性樹膠予以封片后,于顯微鏡下隨機觀察3個400倍視野,評估陽性細胞比例及染色強度,若腫瘤組織中無任何細胞核染色則判定為MMR表達缺失,反之則為MMR陽性。
含奧沙利鉑一線化療方法:首日取130 mg/m2奧沙利鉑(深圳海王藥業,H20031048,20 mL∶40 mg)加入至500 mL濃度為5%的葡萄糖溶液中稀釋后經靜脈持續滴注2 h;第1~5天按500 mg/m2劑量經靜脈注射5-氟尿嘧啶,每3周用藥1次;第1~14天按1 000 mg/m2劑量口服卡培他濱(上海羅氏制藥,H20073024,500 mg),2次/d,21 d為1個周期,所有患者均連續治療3個周期。
1.3 觀察指標
①比較兩組患者的一般資料、臨床資料:一般資料包括性別、年齡、病程、疾病類型、病灶直徑等;臨床資料包括腫瘤分化程度(低分化、中分化、高分化)、腫瘤浸潤深度(T1~T4)、腫瘤區域淋巴結受累情況(N0~N2)、腫瘤遠處轉移情況(M0、M1)[7]及微衛星病灶狀態[微衛星病灶穩定(MSS)、微衛星病灶檢測標志物<40%(MSI-L)、微衛星病灶檢測標志物≥40%(MSI-H)][8]。②結直腸癌MMR表達缺失的危險因素分析[9]:由于自變量、因變量間存在非線性關系,本研究將存在MMR表達缺失設為自變量,其余單因素設為因變量,將存在一定差異的單因素納入Logistic多因素回歸分析,當P<0.05時認為該因素為導致結直腸癌MMR表達缺失的危險因素。③預后情況評估:依據實體腫瘤療效評估標準[10],以靶病灶最大直徑和為基數,若治療后直徑和較基線水平減小>30%時判定為完全緩解(CR),較基線水平減小20%~30%時判定為部分緩解(PR),較治療前減小不足20%但病灶未生長時判定為病情穩定(SD),較治療前病灶再次生長則判定為疾病進展(PD),CR、PR之和百分比記錄為病灶客觀緩解率(ORR),CR、PR、SD之和百分比記錄為疾病控制率(DCR);記錄并對比兩組隨訪期間的無進展生存率(PFS)、總生存率(OS)、中位PFS以及中位OS,自隨機分化開始,任何原因導致患者病情進展記錄為PFS,任何原因導致患者死亡記錄為OS[11]。④MMR表達缺失與MSI及預后的相關性分析[12]:經Spearman相關性系數驗證MMR表達情況與MSI、病灶ORR、DCR、中位PFS、中位OS的相關性。
1.4 統計學方法
數據均采用軟件SPSS 22.0處理,計數資料以百分率(%)表示,比較用χ2檢驗,計量資料以均數±標準差()表示,比較用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 結直腸癌MMR表達缺失的統計學單因素分析
統計學單因素分析結果顯示,兩組患者的年齡、病灶直徑、腫瘤分化程度、腫瘤區域淋巴結受累情況、腫瘤遠處轉移情況及微衛星病灶狀態均差異有統計學意義(P<0.05),見表2。

表2 結直腸癌MMR表達缺失的統計學單因素分析 [n(%)]
2.2 結直腸癌MMR表達缺失的Logistic多因素回歸分析
結合單因素分析結果,分別對P<0.05的單因素進行賦值,具體賦值情況見表3。

表3 各單因素賦值情況
Logistic多因素回歸分析結果顯示,年齡≥60歲、病灶直徑≥5 cm、腫瘤低分化、區域淋巴結受累N0、腫瘤遠處轉移M0、MSI-L或MSI-H為導致結直腸癌MMR表達缺失的危險因素,見表4。
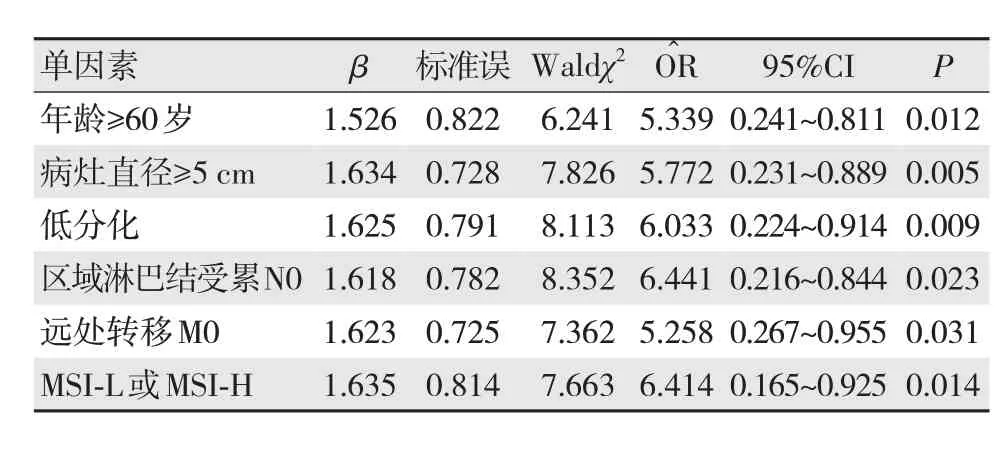
表4 不孕癥的Logistic多因素回歸分析
2.3 兩組患者的MSI及預后情況比較
經含奧沙利鉑一線化療治療后,pMMR組的ORR、DCR、中位PFS、中位OS均高于dMMR組,MSI低于dMMR組,差異有統計學意義(P<0.05),見表5。
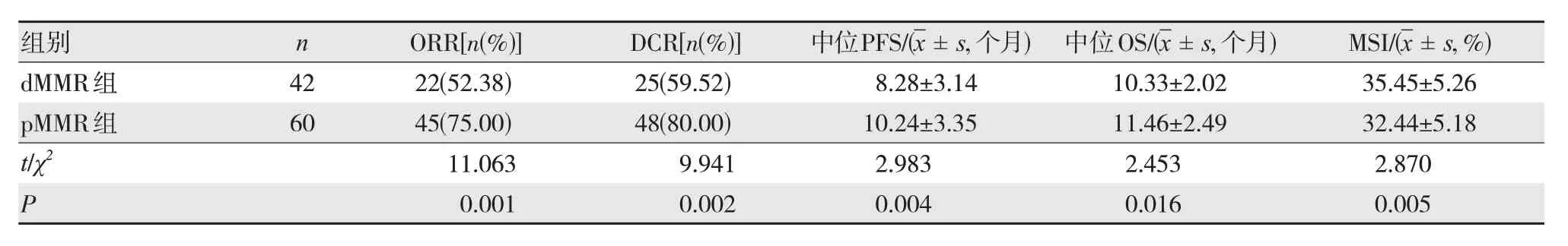
表5 兩組患者的預后情況比較
2.4 MMR表達缺失與MSI、預后情況的相關性分析
經Spearman相關性系數驗證,MMR表達缺失與結直腸癌的ORR、DCR、中位PFS、中位OS負相關,與MSI表達正相關,見表6。
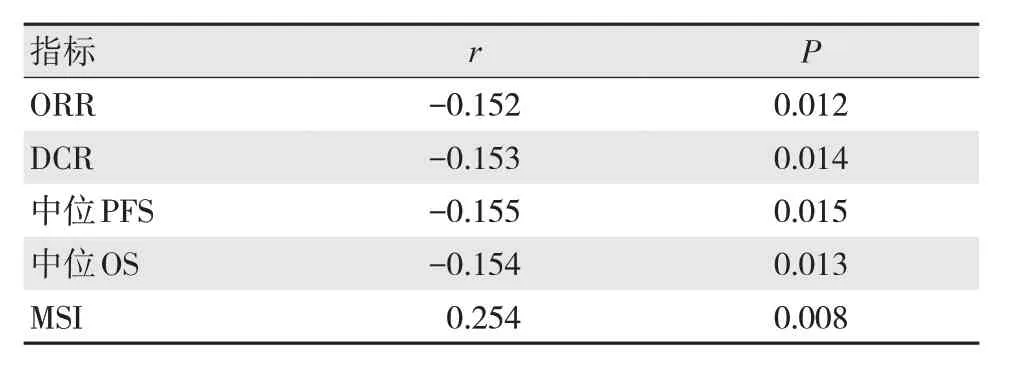
表6 MMR表達缺失與MSI、預后情況的相關性分析
3 討論
結直腸癌為臨床常見消化道惡性腫瘤,多見于中老年群體,近年隨國內人口老齡化加劇,其患病率在逐步上升。目前針對早期結直腸癌,多以根治性手術為主要治療方法,但對于病灶已發生明顯浸潤或遠處轉移的中期、晚期患者,臨床更多會實施含奧沙利鉑的一線化療[13]。但實踐表明[14],因存在部分肉眼難以識別的微小轉移病灶,部分患者經上述一線化療治療后的遠期生存期仍處于較低水平,深入分析結直腸癌發病機制并探討其機制中的可控環節并予以針對性治療或可進一步增加患者臨床獲益。近年隨分子生物學技術的不斷進步及發展,臨床逐步認識到了遺傳學改變在結直腸癌發生及病情進展中的重要作用。
已有的研究證實[15],結直腸癌的MMR表達缺失會導致微衛星病灶不穩定并增加微小病灶向遠處轉移、擴散風險,除會加大臨床治療難度外,還可能進一步提升病死風險。本研究結果顯示,年齡≥60歲、病灶直徑≥5cm、腫瘤低分化、區域淋巴結受累N0、腫瘤遠處轉移M0、MSI-L或MSI-H為導致結直腸癌MMR表達缺失的危險因素。目前已發現的與結直腸癌發病相關的MMR基因主要包括MLH1、MLH2、MSH6、PMS2等4種,當上述MMR基因表達均為陰性時則判定為MMR表達缺失[16]。目前認為,MMR表達缺失與腫瘤細胞的生物學特征存在密切關聯,MMR基因表達缺失的結直腸癌患者預后相對較好,因此dMMR患者中大多區域淋巴結未受累且病灶未發生遠處轉移[17]。MMR基因能有效矯正DNA堿基錯配并抑制基因突變,對預防腫瘤發生或惡變均有積極意義,但當MMR基因受外界生物因素及溫度變化干擾時,則無法識別DNA復制時堿基錯配并促使MSI發生[18]。MSI為基因上由多個重復單位組成的單核苷酸區域,廣泛存在于人類基因組,其分布均勻,具有多態性、可遺傳性等特征[19]。本研究中兩組患者的統一經含奧沙利鉑方案化療后的預后情況、差異有統計學意義,dMMR組內患者多為高度MSI-H,其對應的ORR、DCR較pMMR組更低,中位PFS、中位OS較pMMR組更短,提示若結直腸癌患者伴有MMR表達缺失或MSI-H時不適宜應用一線化療進行治療。馮強等[20]研究指出,MMR表達缺失且伴高度MSI者對5-氟尿嘧啶(5-FU)、奧沙利鉑在內的一線化療似乎敏感性較低,該研究中,高度MSI患者應用FOLFOX4方案治療后的病情復發時間較非MSI患者更短,提示此類患者對含5-FU及奧沙利鉑的FOLFOX4化療方法敏感性較差,且該學者認為,MMR蛋白的表達與MSI表達之間存在明顯相關性。曾輝光等[21]也認為,MMR表達缺失所致MSI可對結直腸癌的5-FU基礎化療效果產生不利影響,為有效指導臨床治療,應將MSI作為其常規檢測項目。而本研究經Spearman相關性系數驗證,MMR表達與結直腸癌的ORR、DCR、中位PFS、中位OS正相關,與MSI表達負相關,也進一步證實了MMR表達與結直腸癌MSI及預后水平的關聯。
綜上所述,結直腸癌MMR表達缺失可導致MSI,dMMR及高度MSI會影響患者含奧沙利鉑一線化療效果,為增加患者臨床獲益并改善預后水平,應進行MMR及MSI檢測并酌情調整治療方案。

